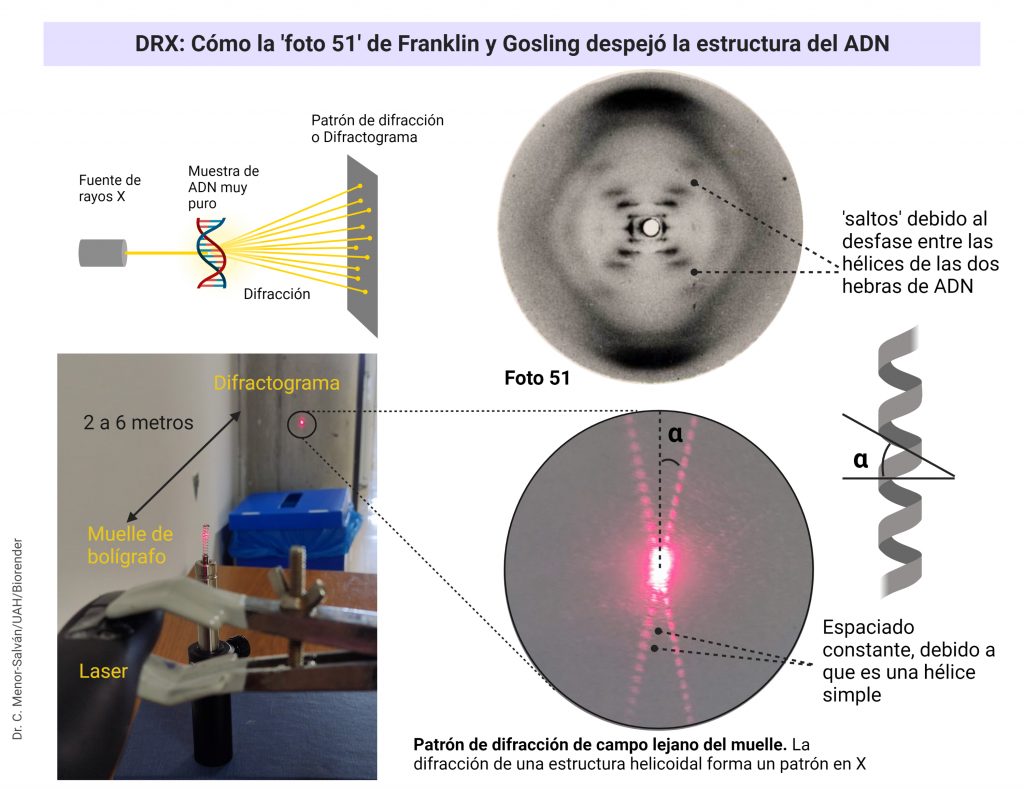
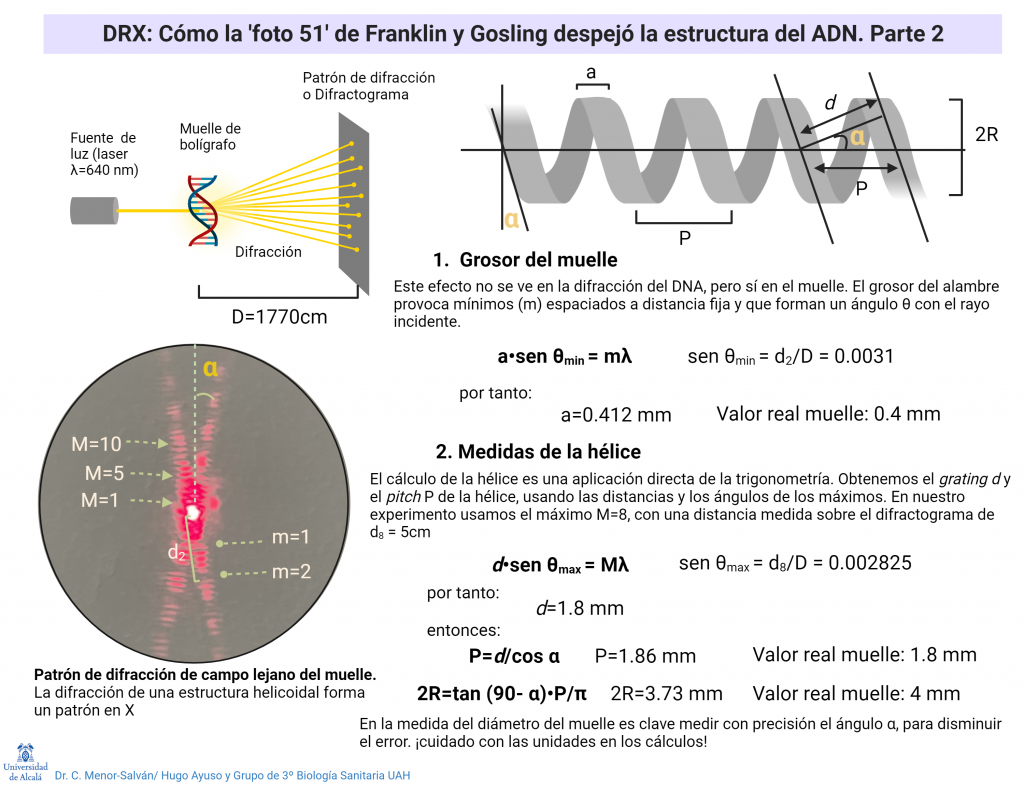
EL LACTATO UN BIOMARCADOR ALIADO DE NUESTRO ENTRENAMIENTO
Por Giorgia Gallinato Raffaele, Biología sanitaria, UAH
Los deportistas están constantemente sometidos a una alta exigencia de trabajo fruto de las elevadas cargas de entrenamiento y todo lo que conlleva una competición. Por ello, la valoración de biomarcadores, la valoración bioquímica del estado nutricional y de diferentes parámetros como el lactato, la ferritina, la creatina kinasa, hemoglobina o el ratio cortisol-testosterona; son esenciales para mantener el control y mejorar el rendimiento del deportista.
En este post vamos a hablar sobre uno de estos biomarcadores, en concreto, sobre el lactato y la encima que lleva a cabo su producción, la lactato deshidrogenasa (LDH). Explicaremos como este ha pasado a ser este nuestro aliado en el entrenamiento, oponiendo las ideas que se tenían sobre dicho anión.

No ha sido hasta realizarse estudios en la última década, que se mantenía la idea de que el lactato jugaba un papel de “creador de la fatiga” ante el ejercicio de elevada intensidad y la insuficiencia de oxígeno (anaerobiosis). Muy lejos de ello, ahora sabemos que son varias las funciones que se adscriben a la aparición de altas concentraciones de lactato en el espacio extracelular. Además de jugar un papel energético, el lactato mejora la actividad muscular durante ejercicios intensos y duraderos. Y también, se reconocen múltiples acciones específicas del lactato a nivel celular: favorece el mantenimiento de su excitabilidad; interviene en la conductancia del canal de potasio dependiente de ATP; es un metabolito necesario en el sostenimiento de la glucólisis; tiene un efecto parcial como tamponador de radicales ácidos; y es un cebador en la fosforilación oxidativa en la mitocondria. Por otro lado, actúa sobre la síntesis de colágeno ayudando a la cicatrización de las heridas y como protector de lesiones cerebrales post-isquémicas transitorias. Estas funciones fisiológicas atribuyen un apreciado papel al lactato, otorgándole un protagonismo especial en el metabolismo intermediario de los diferentes tejidos, en la señalización entre células y en la misma célula.
No pretendo extenderme mucho en los aspectos puramente bioquímicos, pero para entender lo relevante que es este anión, producto final del metabolismo de la glucosa, para los deportistas y sus entrenadores; tenemos que hablar primero un poco de como se forma el ácido láctico y de la enzima encargada de su metabolismo, la ya mencionada LDH.
Entonces, ¿cómo llega el lactato a nuestras fibras musculares?
El lactato se produce debido a una falta de oxígeno durante la contracción muscular. Cuando realizamos ejercicio nuestro cuerpo utiliza energía proveniente de lo que llamamos metabolismo aeróbico, (proceso en el cual se usa el oxígeno para producir energía a partir de glucosa en sangre, a través de la fosforilación oxidativa) suficiente para caminar o subir unas escaleras. Sin embargo, esta forma de producir energía es muy lenta y cuando la intensidad del ejercicio sube a niveles de exigencia altos, es insuficiente, así pues necesitamos de otra fuente de energía para cubrir la demanda. Se activa entonces la vía metabólica anaeróbica, cuyo principal sustrato es el glucógeno intramuscular, que se encuentra dentro de las fibras y sufre una serie de reacciones, glucólisis anaerobia, obteniendo como productos 2 moléculas de ATP y ácido láctico. Esto ocurre principalmente en las fibras musculares de tipo IIb, que son las de contracción más rápida, la ventaja de esta respiración, porque a pesar de que es poco eficiente (obtenemos un máximo de 3 ATP, frente a los hasta 39 ATP que se pueden obtener en la fosforilación oxidativa), nos proporciona de forma inmediata la energía que nos falta a cambio de la acumulación de lactato en sangre. Aunque cabe apuntarse que estos términos de respiración anaerobia y aerobia se encuentran puestos en duda actualmente, pero esto no viene al caso.
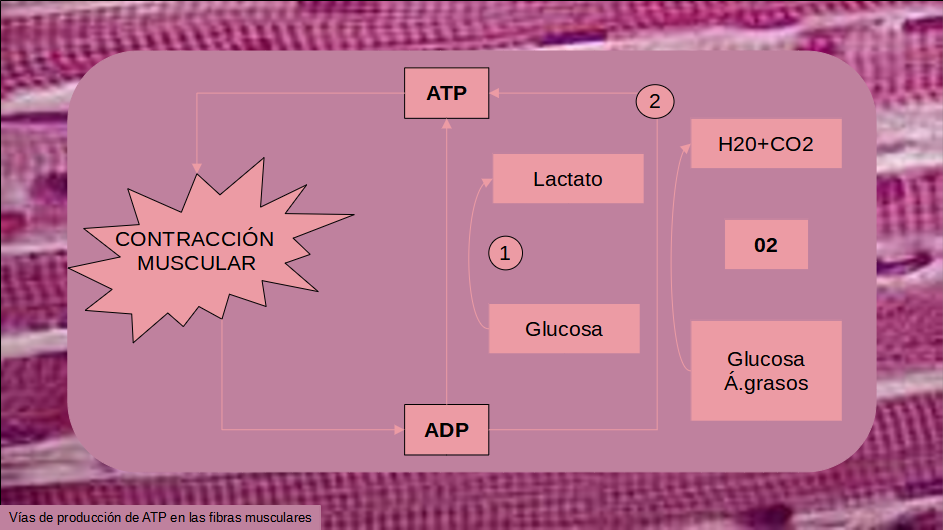
Sin embargo, este mecanismo de obtención de energía no se puede mantenerse durante un periodo prolongado, ya que tan solo en 15 minutos de ejercicio muy intenso puede agotarse del 60% al 70% del glucógeno almacenado en los músculos. El agotamiento total puede producirse después de 90 minutos de ejercicio intenso. Y es que se necesitan entre 24 y 48 horas para reponer las reservas del mismo.
Bien es cierto es que el efecto que produce la acumulación de lactato es algo desagradable, se experimenta una sintomatología temporal de sensación de hormigueo en las piernas, falta de fuerza y sobre todo ganas de vomitar; producida por la presencia excesiva de ácido láctico en el torrente sanguíneo, experimentando acidosis láctica. Pero a pesar de presentar esta sintomatología no es el lactato el culpable de nuestra fatiga, si no que no es más que un aviso de nuestro organismo que nos está diciendo que ya ha llegado a su máximo esfuerzo y está sufriendo una alta fatiga.
¿Y que es ese “ácido láctico” que hemos nombrado ya varias veces y nos provoca esta sintomatología que llevó a pensar que el lactato era responsable de nuestra fatiga?
De nuevo trataré de ser breve con la explicación bioquímica.
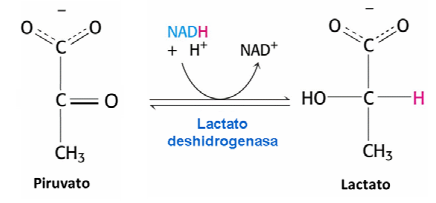
El ácido l-láctico (enantiómero funcional biológicamente), se produce a partir del ácido pirúvico a través de la LDH en el proceso de fermentación. El lactato se produce continuamente en el metabolismo; la concentración de lactato en sangre usualmente es inferior a 2 mmol/l en reposo, pudiendo aumentar hasta 12 mmol/l ante un ejercicio de alta intensidad. Este incremento de lactato no tiene lugar hasta que el índice de producción no supera al de eliminación, influyendo en ello varios factores como transportadores monocarboxilatos, concentración de enzima y la capacidad oxidativa de los tejidos.
Vamos a explicar que quiere decir esto exactamente. En el estado de reposo, a pH fisiológico, en el cuerpo humano 7’35, el lactato se encuentra únicamente en su forma disociada, es decir como lactato y no como ácido. Cuando como hemos venido diciendo hasta ahora la demanda energética, de nuestras fibras musculares en especial, sobrepasa las disponibilidad de oxígeno en sangre para seguir llevando a cabo la respiración aerobia, bajo estas condiciones, la piruvato deshidrogenasa no alcanza a convertir el piruvato a acetil-coA lo suficientemente rápido y el piruvato comienza a acumularse. Esto generalmente inhibiría la glucólisis y reduciría la producción de ATP, para que esto no ocurra la LDH comienza a jugar su papel. La LDH reduce el piruvato a lactato oxidando el NADH+, obteniéndose como producto NAD+ que es necesario en la glucolisis para así seguir generando ATP. El lactato producido sale de la célula muscular y circula por la sangre. La situación ante la que nos encontramos ahora en la sangre es una variación del PH. En concreto una disminución, en más de un cuadro de 0’2 (acidificación del ph), a su vez la presencia de CO2 en sangre se eleva y por tanto el nivel de bicarbonato es bajo. Llegamos a la situación que veníamos tratando de explicar, nos encontramos ante la acidosis láctica del metabolismo.
Posteriormente este lactato producido sale de la célula muscular y circula por el torrente sanguíneo hasta el hígado, donde se vuelve a transformar en glucosa por gluconeogénesis. Al ciclo que comprende la glicólisis en la célula muscular y su reciclaje por gluconeogénesis en el hígado se le conoce como ciclo de Cori, que lo dejaremos para otro momento, porque ya estamos cerca de comprender lo que este post trata de explicar.
Ahora que ya conocemos que es el lactato y como se produce, podemos explicar por qué este es nuestro aliado en el entrenamiento.
Hemos comprendido que cuando nos encontramos ante la acidosis láctica, estamos en la situación en la que nuestro cuerpo por un ejercicio intenso se encuentra en su punto de máximo esfuerzo. Para entrenadores y deportistas la clave está en preparar un entrenamiento que haga posible que alcancemos nuestro umbral de lactato en el punto más elevado posible, lo que nos ayudará a mantener una intensidad alta de ejercicio sin acumular lactato, manteniendo por un periodo más prolongado el rendimiento. Es decir, con esta técnica de entrenamiento, conseguiremos que a la hora de la competición podamos esforzar aún más nuestro organismo, porque acostumbrado a trabajar a muy altas intensidades y regulada la producción de lactato en el entrenamiento, seremos capaces de rendir a una intensidad muy alta sin que nuestro cuerpo acumule el lactato, así rindiendo durante más tiempo a una mayor intensidad.
A pesar de que se habla de trabajar con el umbral de lactato como una “modalidad de entrenamiento”, este difiere mucho dependiendo del deporte que practiquemos e incluso dentro de los diferentes deportes, de la modalidad. Pues, por ejemplo, un corredor de maratón y un corredor de 100 metros requieren alcanzar y mantener el umbral de lactato durante periodos de tiempo diferentes. En el primer caso nos interesa mantener el lactato en un nivel lo más bajo posible dentro de su máximo ya que aunque lo entrenemos inevitablemente durante la competición lo vamos a alcanzar, durante un periodo de tiempo prolongado; sin embargo, en el segundo caso, no se requiere del mantenimiento de lactato en sangre constante durante un periodo de tiempo, si no mantener el nivel de lactato lo más bajo posible durante el breve tiempo del esfuerzo para poder actuar con la máxima potencia e intensidad. Bien es cierto que el control del lactato y los resultados son más notables en las pruebas prolongadas, pero este método de entrenamiento será efectivo en todas las disciplinas. Por eso reincido en la idea de que cada entrenamiento ha de ser pautado por un preparador físico, y específico para cada deportista.
Pongamos para finalizar, un ejemplo concreto de prueba de lactato en un entrenamiento para waterpolistas.
El waterpolo es un deporte colectivo y en el que se pueden realizar cambios sin límite de número a lo largo del partido, pero eso no implica que a los deportistas no les interese regular sus niveles de lactato, todo lo contrario, ya que los partidos son largo y muy exigentes, así durante el tiempo de juego serán más intensos, además tendrán una mayor facilidad de recuperación cuando les toque descanso.
El test se puede realizar durante el juego, pero esto es algo complejo, porque en cada partido ocurren diferentes situaciones y no todos los partidos tienen las mismas exigencias; así que la mejor opción para los waterpolistas es realizar una prueba de natación, sin lugar a duda algo muy importante en este deporte.
Habitualmente se realizan test de entorno unas 4-6 series de 50, 100 o 200 metros (series de corta-media distancia) que se tratarán de hacer todas a la máxima velocidad y entre cada serie se descansará lo mismo. Lo que tratamos de buscar, la base del entrenamiento, es que el deportista realice todas la series aproximadamente en el mismo tiempo y que este sea cercano a su mejor marca en la prueba. Lo que ocurrirá, es que a medida que pasen las series, los niveles de lactato aumentarán, a pesar de que haya descanso entre series porque no será un descanso completo, ante la fatiga generada y acumulada en el organismo, nuestras fibras musculares requerirán cada vez de una mayor y más rápida producción de ATP, que desencadenará la acumulación de lactato en sangre, cada vez las series se realizarán más lento, los niveles de lactato en las últimas series serán mucho más altos que en las primeras.

Para la medición de lactato, realizaremos un pequeño pinchazo en el lóbulo de la oreja (se puede realizar en el dedo, pero en el caso de los nadadores lo realizaremos en la oreja por comodidad, será más fácil mantener la oreja seca durante el pinchazo), tomaremos la pequeña muestra de sangre y un aparato medidor de lactato nos proporcionará la cantidad de lactato que hay en sangre. Es importante realizar la medición antes de comenzar la prueba, entre series y pasado un periodo de descanso al finalizar para también controlar la recuperación.
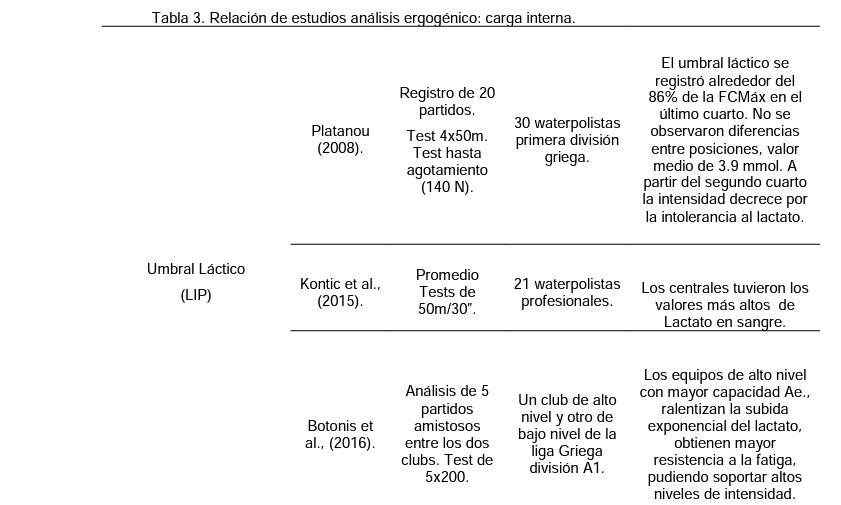
Estudios realizados, aunque son breves los datos disponibles sobre waterpolistas, certifican que como ocurre en las últimas series del test, en el último cuarto de los partidos, los niveles de lactato son más elevados. También se observa que en los equipos de mayor nivel es considerable la ralentización de la subida exponencial de lactado en sangre a lo largo de la prueba y partidos, gracias a su mejor ritmo de partido, gracias a su mejor condición aeróbica. Como podemos observar en la siguiente tabla obtenida del artículo: “ANÁLISIS DE LOS FACTORES DE RENDIMIENTO EN WATERPOLO MASCULINO ÉLITE” de Gómez-García, J., Cejuela, R., Sellés, S.
Anotados los datos, el tiempo de cada serie y el nivel del lactato, podremos preparar entrenamientos de manera precisa, esto ya es trabajo de entrenadores y preparadores físicos, que nos hagan mejorar estos parámetros de cara al próximo test, pero sobre todo a la competición. Ayudándonos a mantener nuestro rendimiento a un mayor nivel de intensidad, durante un mayor periodo de tiempo y al contrario de lo que se creía, reduciendo nuestra fatiga gracias a la mejora en nuestra velocidad de recuperación, gracias a la ralentización en la producción y mejor tolerancia del lactato, nuestro aliado en el entrenamiento.
Referencias
Ribas, J. (2010). Lactato: De indeseable a valioso metabolito. El papel de la producción de lactato en la regulación de la excitabilidad durante altas demandas de potencia en las fibras musculares. Arch. med. deporte, 211-230.
Gómez-García, J., Cejuela, R. y Sellés, S. (2020). Análisis de los factores de rendimiento en waterpolo masculino élite. Trances, 12(2):49-78.
Peinado Lozano, A. B., Barriopedro Moro, M. I., Benito Peinado, P. J., & Calderon Montero, F. J. (2017). Do the changes in acid-base status and respiratory gas exchange explain the voluntary termination of a test performed above the maximum lactate steady state?=¿ Pueden los cambios del estado ácido-base e intercambio de gases respiratorios explicar el abandono de una prueba realizada por encima del máximo estado estable de lactato?. Archivos de Medicina del Deporte, 34(178), 80-85.
Cupitre Alejo, J. E., & Olarte Ortiz, B. F. (2022). LACTOSOFT-Un software aplicado al test estándar del lactato de la UDEC Extensión Soacha.