AQUAPORINAS
Caterina Periotto Miori y Lucía Real Sánchez.
INTRODUCCIÓN
Si el agua es una molécula imprescindible para la vida, ¿cómo puede atravesar la membrana siendo esta impermeable? Hasta 1990 se pensaba que el agua atravesaba la membrana de forma pasiva. Es cierto, que el agua es capaz de atravesar la membrana gracias al efecto hidrófobo, pero, esta capacidad no explicaba algunos procesos fisiológicos celulares que se habían observado. No fue hasta 1992 que se descubrió la existencia de unos transportadores de agua específicos en la membrana plasmática, las acuaporinas.
Las acuaporinas son una serie de proteínas que regulan el paso de agua a través de la membrana plasmática de determinadas células mediante difusión facilitada.
ESTRUCTURA
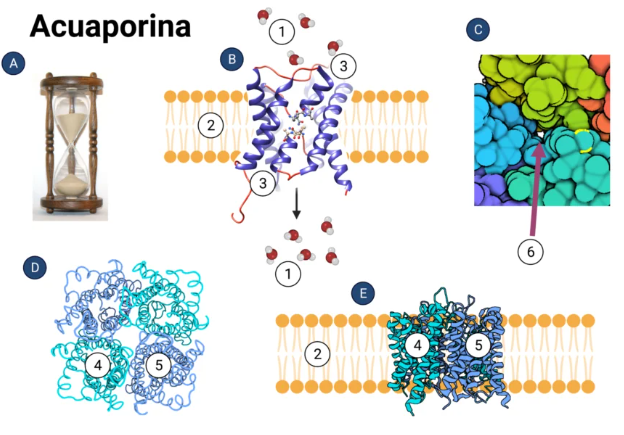
La estructura de las acuaporinas es muy particular, ya que no se asemeja a ninguna proteína transmembrana existente. Está compuesta principalmente por dominios α-hélice, los cuales la permiten atravesar la membrana y facilitar la formación de un poro por el cual pasa el agua.
Las acuaporinas están formadas por 4 monómeros en una configuración de homotetrámero. Este, parece conferir una mayor estabilidad a la estructura en la bicapa lipídica de la membrana.
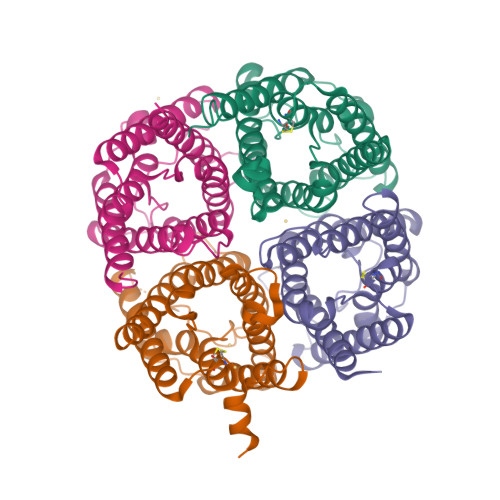
Imagen 1. Estructura de homotetrámero de la acuaporina 2 humana obtenida en Protein Data Bank [1]
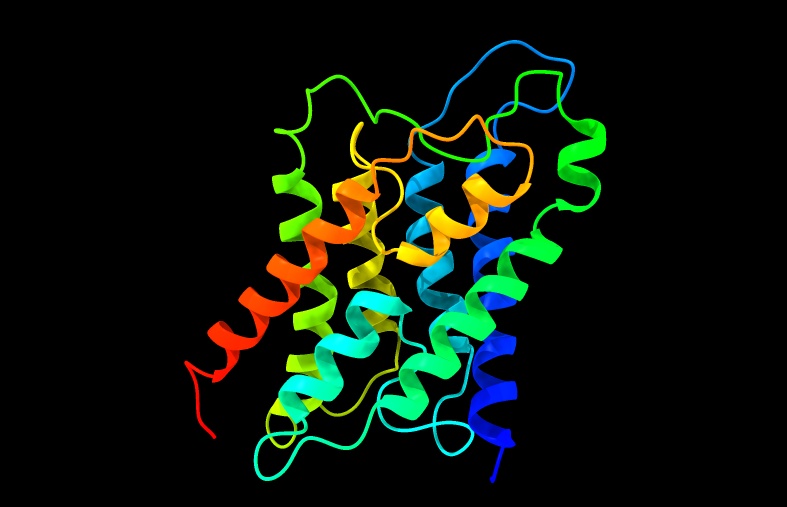
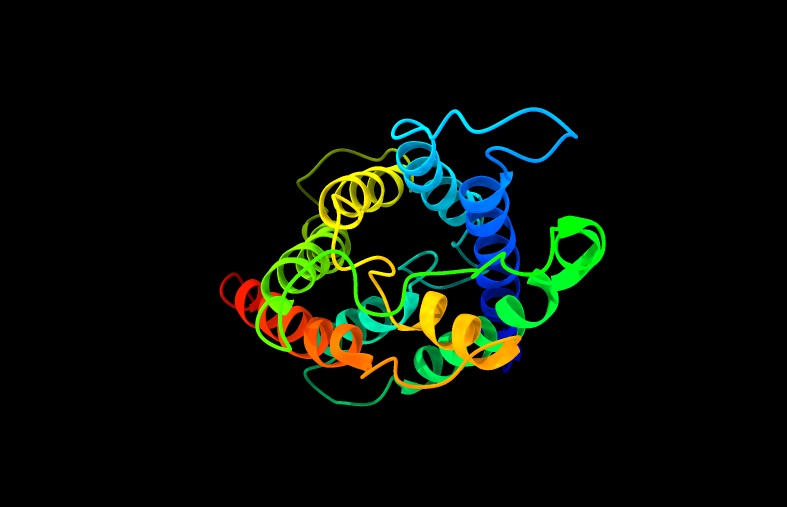
Cada monómero presenta seis segmentos α-hélice con aminoácidos hidrófobos que atraviesan la membrana de lado a lado, unidos por loops. Dos de estos loops portan un triplete compuesto por asparragina, prolina y alanina (NPA), los cuales se ponen en contacto en la zona más estrecha de la acuaporina. Esta duplicación del triplete es característica de todas las acuaporinas.
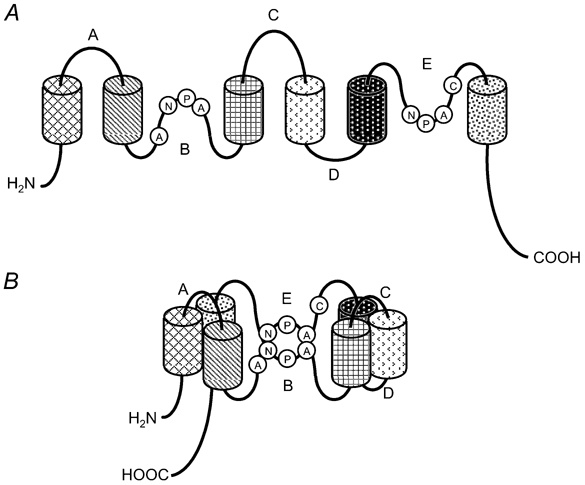
Imagen 4. Dominios de acuaporinas que conforman un monómero, junto con los 2 tripletes NPA localizados en la región estrecha del poro. Fuente: [2].
Los monómeros de la acuaporina se organizan formando una estructura similar a un barril que atraviesa la membrana, donde se encierra una región central estrecha, la cual a su vez se ensancha abriéndose hacia ambos lados de la membrana; uno hacia el citoplasma y el otro hacia el medio externo de la célula. Dos asparraginas que conforman los 2 tripletes NPA característicos de las acuaporinas, convergen para delimitar el sitio más estrecho del canal de la acuaporina, de unos 3 angstrom de diámetro, mientras que el tamaño del agua es inferior, de unos 2,8 angstrom. A esta estructura singular, se la denomina “reloj de arena”.
El número de aminoácidos hidrófobos que componen una acuaporina [3] oscila entre los 250 y 300. Entre los aminoácidos que conforman la región central de la proteína encontramos una isoleucina de la α-hélice 2, una fenilalanina de la α-hélice 1, una leucina de la α-hélice 4 y una valina de la α-hélice 5.
Existen dos aminoácidos cargados en la entrada a la acuaporina que garantizan que solo moléculas de agua, pasen a través del canal.
PAPEL BIOLÓGICO
Las acuaporinas se encargan de regular el paso de agua a través de la membrana, ya que esta es impermeable. El paso de agua a través de las acuaporinas de la membrana se lleva a cabo o bien, modulando el número de acuaporinas presentes en esta, o bien, activando o inactivando las mismas.
Las acuaporinas se descubrieron en mamíferos, pero se han identificado en todos los seres vivos [4] . En humanos, existen 13 tipos de la familia de las acuaporinas, de las cuales, 7 son capaces de transportar agua, mientras que 4 de ellas pueden transportar solutos de bajo peso molecular.
La acción y funcionamiento de las acuaporinas en general, está regulado por diferentes estímulos celulares, las cuales cuando se activan, dejan el poro abierto para que así el agua pase por ella, o bien se cierra para impedir que esta atraviese la membrana.
En plantas, las acuaporinas son muy abundantes y estas, responden a cambios de fosforilación, cambios en la concentración de Ca 2+ o cambios en el pH.
En el caso de humanos, existe una hormona que activa el funcionamiento de las acuaporinas, denominada vasopresina.
Las moléculas de agua se introducen en las acuaporinas, y una vez que estas se encuentran en el poro, se espacian a intervalos para que no se produzcan puentes de hidrógeno entre ellas. No obstante, hay una segunda barrera en el centro del poro, donde una molécula de agua aislada forma puentes de hidrógeno con las cadenas laterales de dos residuos de asparaginas, esto permite que se cree un mecanismo donde el agua se mueva sin resistencia.
IMPLICACIONES BIOMÉDICAS
Según una nueva investigación: “Las acuaporinas desempeñan un papel esencial en la regulación de la ósmosis en muchos tipos de células, por ello, los científicos están buscando formas de bloquear su acción, para crear formas mediante las cuales tratar enfermedades relacionadas con el agua, como el glaucoma. Las acuaporinas fueron descubiertas originalmente por la observación de que el mercurio bloquea el flujo de agua dentro y fuera de los glóbulos rojos, pero desafortunadamente el mercurio es demasiado tóxico para ser utilizado como un medicamento. Actualmente, los científicos están buscando nuevos inhibidores para bloquear tipos particulares de acuaporinas, para su uso como medicamentos. ” (PDB101: Molecule of the Month: Aquaporin, s. f.).
NEUROMIELITIS ÓPTICA
Antes de comenzar a hablar sobre esta enfermedad, veo necesario aportar una simple definición para el lector que no sepa el significado de «mielitis»: inflamación de la médula espinal.
La neuromielitis óptica es una enfermedad autoinmune diesmelizante e inflamatoria del sistema nervioso central en la que la persona que la padece puede sufrir [5] ceguera, de uno o ambos ojos, así como debilitamiento o parálisis de las extremidades anteriores y posteriores. Se puede decir que esta es una enfermedad poco estudiada puesto que gran parte de las veces estaba mal diagnosticada, se pensaba que se trataban de casos de esclerosis múltiple.
Como ya sabemos, existen distintos tipos de acuaporinas, en este caso, la responsable de esta enfermedad es la 4. Estos canales se encuentran en los astrocitos, controlando la entrada y salida de agua.
En esta patología, los linfocitos B producen a gran escala cantidades de anticuerpos IgG1 (NMO-IgG) los cuales van a circulan en contra de estos canales provocando una respuesta inflamatoria como veremos a continuación.
Como se ha explicado anteriormente, la acuaporina es un tetrámero. Los tetrámeros de la AQP4 se juntan en agregados en la membrana plasmática formando lo que recibe el nombre de “matrices de partículas ortogonales” (OPAs). La formación de estos complejos es de gran importancia puesto que es a ellos a los que se van a unir los anticuerpos AQP4 ya que tienen mayor afinidad que a los tetrámeros sueltos. Los monómeros que constituyen el tetrámero de la acuaporina tiene dos isoformas: M1 y M23; según a cual de ellas se una, el complejo tomará diferentes destinos. Si el anticuerpo NMO-IgG se une a tetrámeros de la isoforma M1, actúan los mecanismos de protección lo rodearán formando vesículas para expulsarlo de la célula. Sin embargo, si se unen a los OAPs de isoforma M23 no podrán ser fagocitados por los astrocitos debido a su gran tamaño. Es ahora cuando se activa la respuesta inflamatoria responsable de los daños causados en el nervio óptico y en la médula espinal dando lugar así a la enfermedad. El inicio de la patología es desconocida, se barajan varias opciones, pero ninguna conclusión clara.
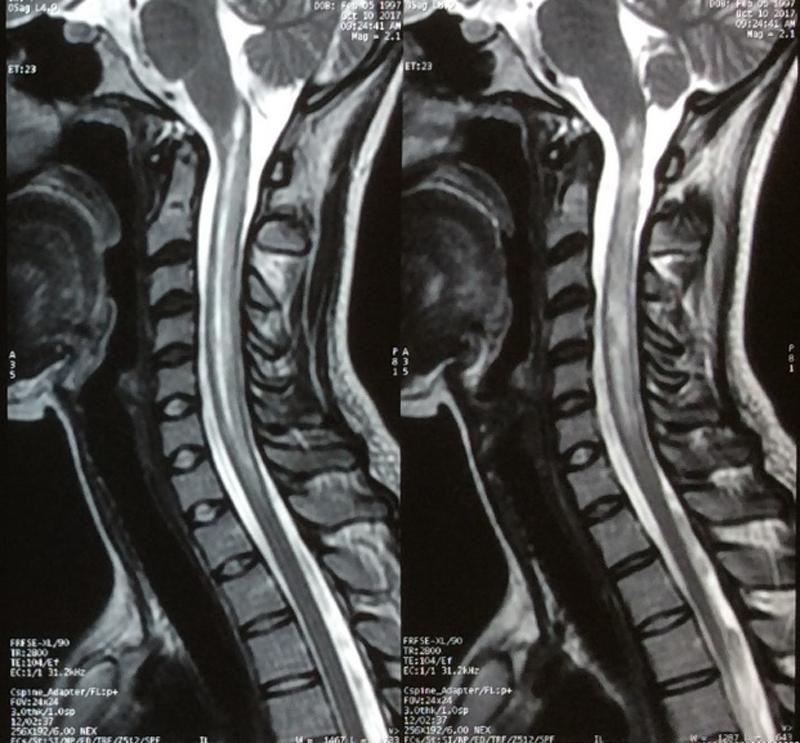
En el ejemplo de fotografía anterior, observamos una radiografía en T2 en la que se observa claramente un ensanchamiento de la médula en la región cervical a la altura de las vértebras C1 a la C4 de la imagen de la izquierda respecto a la de la derecha. Como se ha mencionado antes, esta radiografía es en T2, lo que significa que el tubo negro es la médula (lo que debemos observar) y la parte blanca es el líquido cefalorraquídeo que rodea a éste.
En cuanto a las terapias [8], se utilizan inmunomoduladores ([9] medicamentos que actúan en el sistema inmunitario bien para estimularlo o bien para deprimirlo) e inmunosupresores. Además, según el artículo “Las Aquaporinas Y El Sistema Nervioso Central” de los autores S. López-Hernández y C. A Rodríguez-Arias [8]; pueden utilizar anticuerpos monoclonales altamente específicos contra las AQP4-IgG como podrían ser “Eculizumab” o bien “Aquaporumab”. Éste último tiene la ventaja de que no afecta a la permeabilidad de los canales permitiendo la normal entrada de ésta así como una baja toxicidad al ser altamente específico.
REFERENCIAS
- Lieske, J., Cerv, M., Kreida, S., Barthelmess, M., Fischer, P., Pakendorf, T., Yefanov, O., Mariani, V., Seine, T., Ross, B.H., Crosas, E., Lorbeer, O., Burkhardt, A., Lane, T.J., Guenther, S., Bergtholdt, J., Schoen, S., Tornroth-Horsefield, S., Chapman, H.N., Meents, A. (2019, julio). RCSB PDB – 6QF5: X-Ray structure of human Aquaporin 2 crystallized on a silicon chip. Protein Data Bank. https://www.rcsb.org/structure/6QF5
- Cooper, G. J., Zhou, Y., Bouyer, P., Grichtchenko, I. I., & Boron, W. F. (2002). Transport of volatile solutes through AQP1. The Journal of physiology, 542(Pt 1), 17–29. https://doi.org/10.1113/jphysiol.2002.023218
- INECOL. (2021, agosto 31). LAS ACUAPORINAS: MOLÉCULAS ESENCIALES PARA LA VIDA. Portal Comunicación Veracruzana. https://elportal.mx/princ/las-acuaporinas-moleculas-esenciales-para-la-vida/
- Finn, R. N., & Cerda, J. (2015). Evolution and functional diversity of aquaporins. The Biological Bulletin, 229(1), 6-23. Evolution and Functional Diversity of Aquaporins (uchicago.edu)
- Goodsell, D. (2014, mayo). PDB101: Molecule of the Month: Aquaporin. RCSB: PDB-101. https://pdb101.rcsb.org/motm/173
- Agre P. (2006). The aquaporin water channels. Proceedings of the American Thoracic Society, 3(1), 5–13. https://doi.org/10.1513/pats.200510-109JH
- Edgar Carnero Contentti, Javier Pablo Hryb, Jose Luis Di Pace, Edson Chiganer, Mónica Perassolo,Rol de la detección de los anticuerpos anti-acuaporina 4 (IgG-NMO) en el espectro de la neuromielitis óptica,Neurología Argentina,Volume 5, Issue 2,2013,Pages 108-113,ISSN 1853-0028,https://doi.org/10.1016/j.neuarg.2013.03.002.(https://www.sciencedirect.com/science/article/pii/S1853002813000347)
- Neuromielitis óptica – Síntomas y causas – Mayo Clinic. https://www.mayoclinic.org/es-es/diseases-conditions/neuromyelitis-optica/symptoms-causes/syc-20375652
- Laurens Acevedo,M; , Castañeda C, C; Ruiz de Sánchez,C; Camila Rueda, M; Zarco M, L. A. Neuromielitis óptica en el embarazo: reporte de un caso. Univ. Méd. ISSN 0041-9095. Bogotá (Colombia), 55 (4): 456-465, octubre-diciembre, 2014
- Acuaporinas en diversas patologías neurológicas. (2016). CORE Reader. https://core.ac.uk/reader/51406940
- López-Hernández, Samsara, & Rodríguez-Arias, Carlos Alberto. (2019). Las acuaporinas y el Sistema Nervioso Central. Revista Ecuatoriana de Neurología , 28 (2), 75-82. http://scielo.senescyt.gob.ec/scielo.php?script=sci_arttext&pid=S2631-25812019000200075&lng=es&tlng=es.
- Diccionario de cáncer del NCI. (s. f.). Instituto Nacional del Cáncer. https://www.cancer.gov/espanol/publicaciones/diccionarios/diccionario-cancer/def/inmunomodulador
- Enfermería, M. R. Y. de. (2022, 17 junio). Neuromielitis óptica serie de casos: Hospital Escuela Universitario (HEU) Tegucigalpa M.D.C. Honduras C.A. Ocronos – Editorial Científico-Técnica. https://revistamedica.com/neuromielitis-optica-serie-casos/