ASPARTATO AMINOTRANSFERASA (AST)
Elena González, Marta Guerrero y Nahia Gómez
INTRODUCCIÓN
La Aspartato aminotransferasa (AST) es una enzima que participa y ayuda en el metabolismo de los aminoácidos, es decir, obtención de energía a partir de alimentos. Se encuentra a nivel intracelular en diversos tejidos, principalmente en el hígado, pero también en el corazón, los riñones, el cerebro, sangre, tejido muscular, etc.
PAPEL BIOMÉDICO
Esta enzima se puede utilizar como indicador clínico; normalmente, los niveles de AST en sangre son bajos, por lo que si se detectan altos niveles de ella en suero suele ser por patologías relacionadas con dichos órganos. Sus células dañadas liberan AST a la sangre. Algunas de las razones por las que la AST en sangre aumenta su concentración son: infarto agudo de miocardio (marcador de necrosis miocárdica), hepatopatía aguda, miopatías producidas por determinados medicamentos o enfermedades…
Para asegurarse del motivo de la subida de concentración en sangre, los médicos suelen hacer la prueba de la AST, también conocida como prueba de la SGOT, donde se mide la concentración de AST en sangre. Esta prueba consiste en el método de oxidación del NADH, junto con pruebas de otras enzimas hepáticas.
Deberíamos empezar a preocuparnos si nuestros niveles de AST en sangre son superiores a 66 U/l en menores de un año, superior a 55 U/l en niños de uno a cuatro años , mayores de 50 U/l en niños de 5 a 8 años y superior a 45 U/l en personas de 9 a 18 años.
PAPEL BIOLÓGICO
Como se mencionó anteriormente, la AST ayuda en el metabolismo de los aminoácidos y es que esta enzima se va a encargar de catalizar la reacción entre los aminoácidos Glu (glutamato) y Asp (aspartato) con ayuda de un cofactor denominado pirridoxal 5´fosfato.
ESTRUCTURA Y MECANISMO
Se trata de una enzima dimérica cuyas cadenas constan cada una de 400 residuos. Además, cada una de ellas cuenta con dos dominios, uno grande con un cofactor (pirridoxal 5´fosfato) y uno pequeño que genera una región flexible para la apertura o cierre tras la unión del sustrato. Se sintetiza a partir de un precursor mitocondrial que posee una secuencia señal de 29 aminoácidos para que se pueda llevar a cabo el transporte y adición a la matriz mitocondrial de la misma.
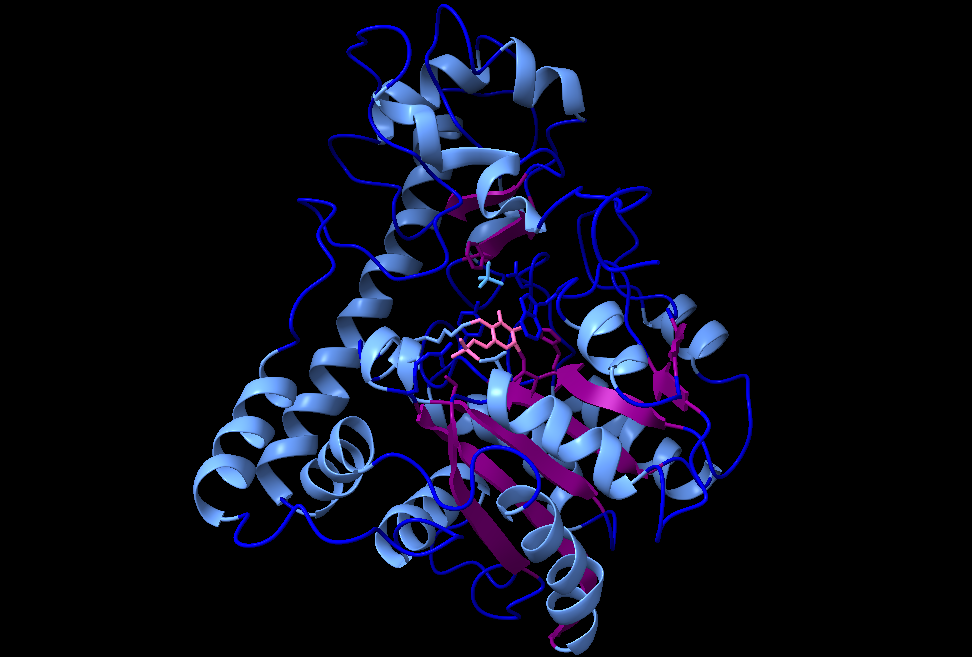
Ilustración que muestra la estructura de la enzima AST que presenta alfa hélices (azul claro); láminas beta (morado) y el cofactor pirridoxal 5´fosfato (rosa). Imagen creada a partir de ChimeraX
Esta reacción consiste en la utilización de los dos aminoácidos como donantes de amino, es decir; transfiere este grupo desde el L-aspartato al 2-oxoglutarato dando lugar al L-glutamato y oxalacetato. Esto es fundamental tanto para la degradación como síntesis de aminoácidos.
La enzima cambia entre sus formas de piridoxal y piridoxamina en un proceso de doble desplazamiento. Propone un mecanismo de acción que describe el papel dinámico de la porción proteica de esta enzima. Se basa en estructuras espaciales determinadas cristalográficamente de isoenzimas mitocondriales (a una resolución de 2,8 A) en sus formas no unidas y en complejos con análogos de sustrato, así como en estudios de modelado. La coenzima está unida al dominio más grande y está ubicada en un bolsillo cerca de la interfaz de la subunidad.
Durante el proceso de degradación de aminoácidos, en la que se ha formado glutamato este de desamina y forma amonio que se eliminarán en forma de urea.
AST – creative enzymes. (s/f). Creative-enzymes.com. Recuperado el 1 de febrero de 2023, de https://www.creative-enzymes.com/similar/ast_83.html
Otto-Ślusarczyk, D., Graboń, W., & Mielczarek-Puta, M. (2016). Aminotransferaza asparaginianowa – kluczowy enzym w metabolizmie ogólnoustrojowym człowieka. Postepy higieny i medycyny doswiadczalnej, 70, 219–230. https://doi.org/10.5604/17322693.1197373
¿Qué hacemos con las transaminasas? Casos clínicos. (s/f). Pap.es. Recuperado el 1 de febrero de 2023, de https://pap.es/articulo/13185/que-hacemos-con-las-transaminasas-casos-clinicos
Reitzer, L. (2014). Amino Acid Synthesis. En Reference Module in Biomedical Sciences. Elsevier.
Wiki, T. (s/f). Aspartato transaminasa. Hmong.es; tok.wiki. Recuperado el 1 de febrero de 2023.
Pérez, V. (2017). Concentración de la enzima AST (Aspartato aminotransferasa) en dientes sometidos a fuerzas ortodónticas intrusivas. Avances en odontoestomatología, 33(1), 19–24.
Bank, R. P. D. (s. f.). RCSB PDB – 1AHY: ASPARTATE AMINOTRANSFERASE HEXAMUTANT