Recientemente se han podido ver excelentes ejemplares del raro mineral formicaíta (formiato de calcio) procedentes del lago Alkali (Oregon, USA). Este lago de aguas alcalinas o soda lake (lago de sosa) forma, por procesos de desecación y redisolución, una serie de minerales de sodio, que incluyen desde los más comunes natrón, trona o gaylussita, hasta el raro mineral quilianshanita. Usualmente, estos minerales son carbonatos y boratos, formando los depósitos salinos que deja el agua al evaporarse; la formicaíta, en cambio, es especial: es un mineral orgánico, concretamente la sal de calcio del ácido fórmico.
Este mineral tiene un origen biológico: deriva del ácido fórmico (HCOOH) generado por el metabolismo bacteriano. ¿por qué se encuentra entre los minerales de éste lago?. Se debe precisamente a su riqueza en sales y su pH alcalino. En éstas condiciones, en el lago prolifera un gran ecosistema de organismos adaptados a medios muy ricos en sales y con pH alto; este sistema es muy productivo y produce lo que denominamos un ciclo de nutrientes: diferentes comunidades cooperan reciclando nutrientes y generando los que otras necesitan.

La clave del origen de la formicaita está en los fermentadores anaerobios. Estos organismos se encuentran en las zonas anóxicas del lago, agua profunda donde no llega suficiente oxígeno atmosférico. Una de las reacciones bioquímicas esenciales de éstos fermentadores anaerobios es la síntesis de acetil-coenzima A a partir de piruvato. Esta reacción es fundamental para la producción de energía por las células de éstos organismos y genera ácido fórmico como subproducto.

Normalmente, los ácidos liberados en la fermentación anaerobia, como el ácido fórmico o el ácido acético, son utilizados como fuente de energía por organismos aerobios o reutilizados. De ahí que los minerales como la formicaíta o los acetatos (hoganita) sean sumamente raros. Además, el formiato juega otro papel fundamental en el ecosistema del lago: es una fuente de hidrógeno (H2, ver esquema anterior). Otros organismos anaerobios recogen el formiato y lo transforman en CO2 e hidrógeno molecular, que contribuye al ambiente reductor de los sedimentos del lago y, a su vez, es utilizado por las bacterias sulfato-reductoras, que convierten el sulfato en azufre o sulfuro. Sin embargo, la desecación del lago Alkali ha favorecido la cristalización y preservación de la formicaíta, gracias a la menor solubilidad de la sal de calcio, antes de que el ácido fórmico sea procesado por el ecosistema.
Piruvato formiato-liasa
El paso bioquímico fundamental en la formación del ácido fórmico lo lleva a cabo la piruvato formiato liasa o formiato acetiltransferasa. Esta enzima cataliza la reacción:
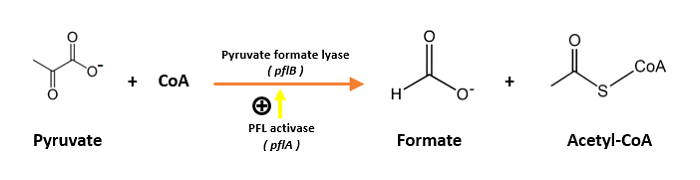
que se integra en el metabolismo central de bacterias como las famosas E. coli, que son anaerobios facultativos (es decir, que pueden trabajar en modo aerobio o modo anaerobio dependiendo de las condiciones) y, en condiciones de baja concentración de oxígeno, producen ácido fórmico:

Otro aspecto interesante de la piruvato-formiato liasa es que nos habla sobre la evolución de la vida. Es probable que ésta enzima sea muy antigua, anterior a la existencia de una atmósfera rica en oxígeno (es decir, más de 2000 millones de años) y, probablemente, estuvo en el arranque del motor central del metabolismo de todos los organismos del planeta, que está en la figura de arriba. Es más, ¡es posible que sea anterior al ADN!. ¿como es ésto posible? Pues porque, anteriormente a la existencia del ADN como almacén de información genética, existió un genoma basado en el ARN. Las moléculas de ARN, mas antiguas que el ADN y posiblemente con más de 4000 millones de años de antigüedad, dieron paso al ADN gracias a que surgió una enzima capaz de convertir los nucleótidos del ARN (ribonucleótidos) en nucleótidos del ADN o desoxirribonucleótidos. Esta enzima se llama ribonucleótido reductasa. Uno de los tipos de ésta enzima, el más antiguo de todos, pudo evolucionar a partir de la piruvato-formiato liasa. De hecho, ambas enzimas, a pesar de su papel bioquímico aparentemente distante, tienen estructuras muy similares y son homólogas, es decir, proceden de un ancestro común.
PFL/Ribonucleotide reductase by cmenorsalvan on Sketchfab
En el sketch tridimensional puede verse la superposición de las estructuras de la ribonucleósido reductasa y la piruvato formiato liasa. La coincidencia, en especial en la zona del centro activo (flechas y hélices unidas a ellas), es significativa y sugiere una preservación estructural debido a que ambas proceden de un ancestro común. Como puede verse, todo está relacionado. Vida, minerales y evolución requieren unos de otros, ya que la vida es otro agente geológico y ambas, vida y ambiente planetario, se modelan uno al otro.
Referencias
Atteia, A., Van Lis, R., Tielens, A. G. M., & Martin, W. F. (2013). Anaerobic energy metabolism in unicellular photosynthetic eukaryotes. Biochimica et Biophysica Acta – Bioenergetics, 1827(2), 210–223. https://doi.org/10.1016/j.bbabio.2012.08.002
Crain, A. V., & Broderick, J. B. (2014). Pyruvate formate-lyase and its activation by pyruvate formate-lyase activating enzyme. Journal of Biological Chemistry, 289(9), 5723–5729. https://doi.org/10.1074/jbc.M113.496877
Torrents, E. (2014). Ribonucleotide reductases: essential enzymes for bacterial life. Frontiers in Cellular and Infection Microbiology, 4(April), 1–9. https://doi.org/10.3389/fcimb.2014.00052





