Ricina
Ricina
Elaborado por Danna Marcos, Carolina Martín y Marcos Moreno
La ricina es una proteína que se encuentra en las semillas de ricino (Ricinus communis L.) y ha sido clasificada como «extremadamente tóxica» por el Centro de control de Enfermedades de EE.UU. (CDC). Es tal su toxicidad que tan solo una molécula es capaz de matar a una célula de un mamífero (Balint 1974).
Esta peculiar enzima atraviesa la membrana plasmática, viaja hasta el aparato de Golgi y desde allí se transfiere al retículo endoplasmático rugoso donde accede a los ribosomas. Una vez accedido a dichos orgánulos produce la inhibición de la síntesis de proteínas al provocar la depurinación del ARNr de su subunidad grande.
Todo este mecanismo es la razón por la que esta enzima es tan dañina, perteneciendo consecuentemente a la familia de proteínas inactivadoras de ribosomas (RIPs). Sin embargo, el ricino es una planta con numerosas aplicaciones tanto en biomedicina como en biotecnología.

HISTORIA
Aunque el auge de esta semilla como arma biológica se alcanzó a finales del siglo XX en la guerra Irán-Irak (1980-1988) y con consecutivos asesinatos como el del escritor búlgaro Georgi Markov (1978) o el intento de asesinato de Vladimir Kostov (quien finalmente sobrevivió), no siempre se ha utilizado con estos fines tan destructivos.
Hay evidencias que demuestran que el aceite de ricino se lleva utilizando desde el antiguo Egipto con propósitos farmacéuticos en niños diabéticos. También se ha utilizado, en la medicina tradicional china como antihelmíntico y como pomada para tratar heridas crónicas o úlceras.
Hoy en día, tanto el aceite de ricino como la ricina en sí tienen una gran variedad de aplicaciones como tratamiento contra el cáncer o trasplante de médula ósea; sin dejar de lado el gran campo de investigación celular que ha abierto.
ESTRUCTURA DE LA RICINA
Para entender la toxicidad de esta proteína es fundamental tener una idea clara sobre su estructura y mecanismo de acción.
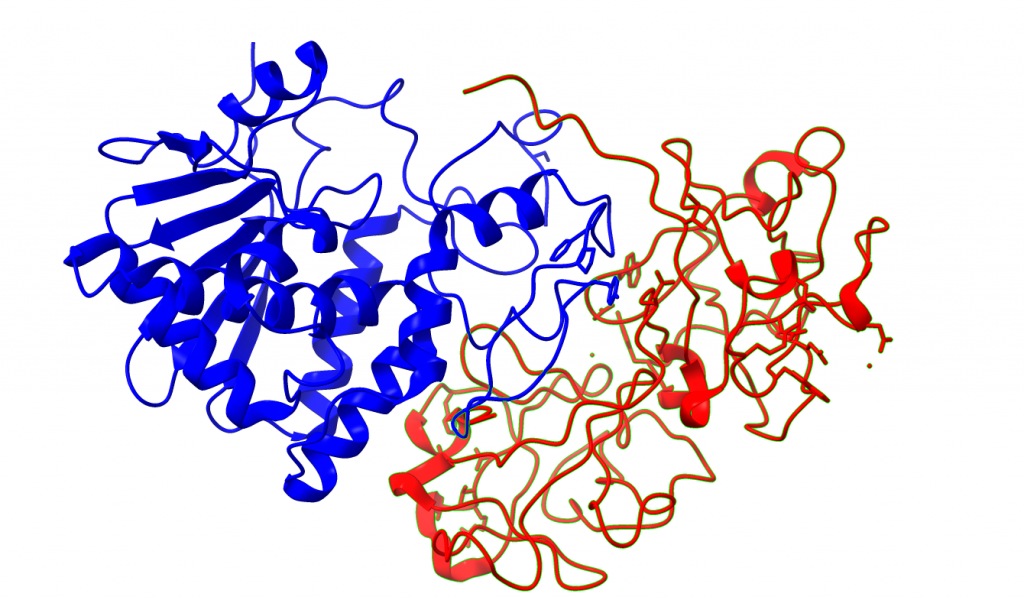
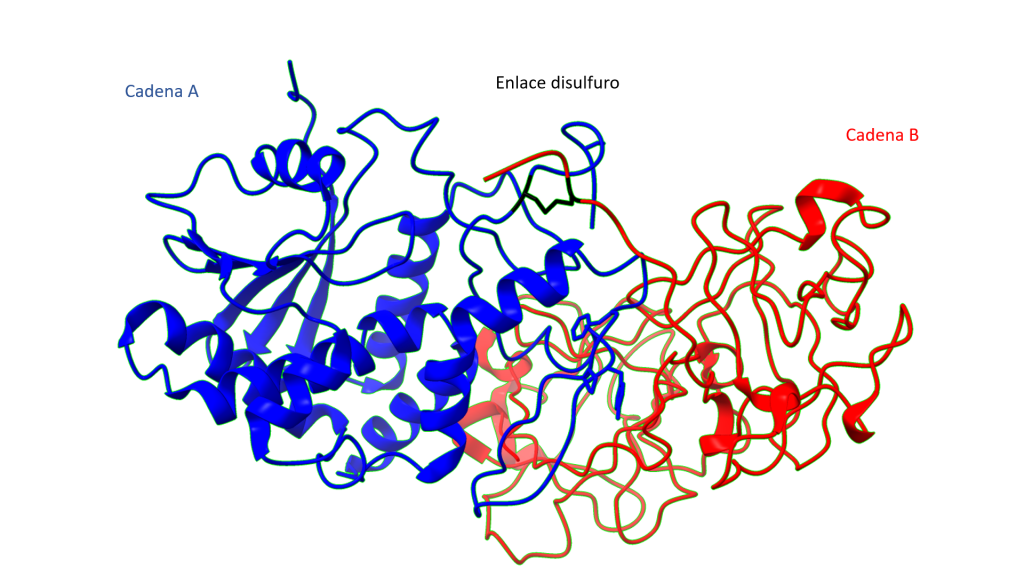
Desde el punto de vista estructural la ricina es un heterodímero formado por dos subunidades o cadenas: La cadena A(RTA) y la cadena B(RTB).
La cadena A posee la función enzimática, por lo que es la encargada de la inhibición de ribosomas en la célula. Es una cadena de 267 aminoácidos en su estructura primaria que se pliega en 3 dominios para finalmente dar lugar a una proteína globular con un centro activo.
La cadena B es una lectina con preferencia de unión a la galactosa. Se compone de 262 aminoácidos que se pliegan formando dos dominios, cada uno de los cuales une una galactosa por puente de hidrógeno. Esta cadena es importante para la unión de la proteína a la superficie celular.
Las cadenas se estabilizan por un puente disulfuro entre el residuo 259 de la cadena A y el residuo 4 de la cadena B, siendo ambos residuos cisteínas. (Montfort et al., 1987)
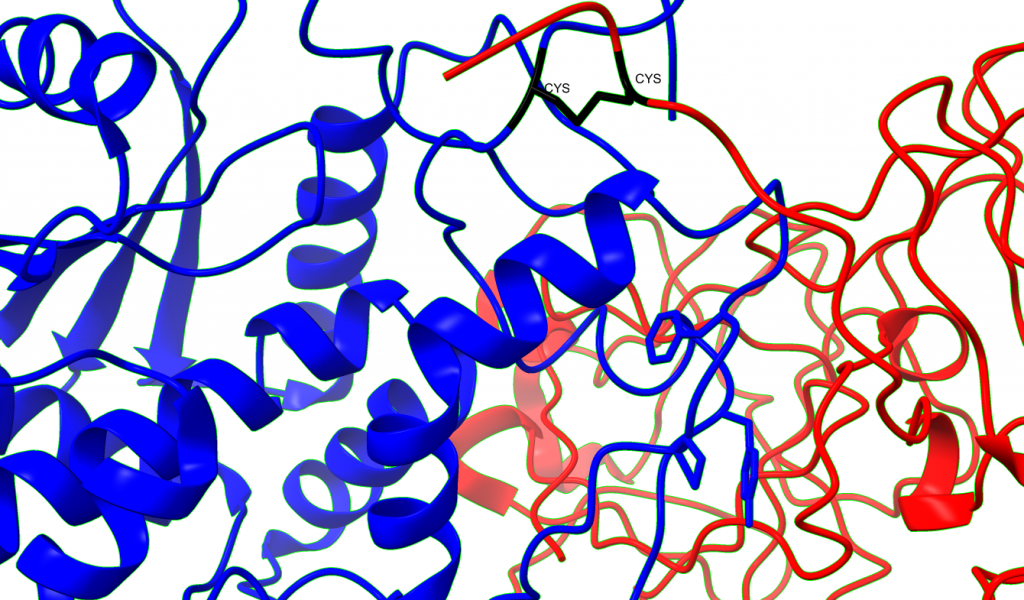
Enlace disulfuro
Centro activo
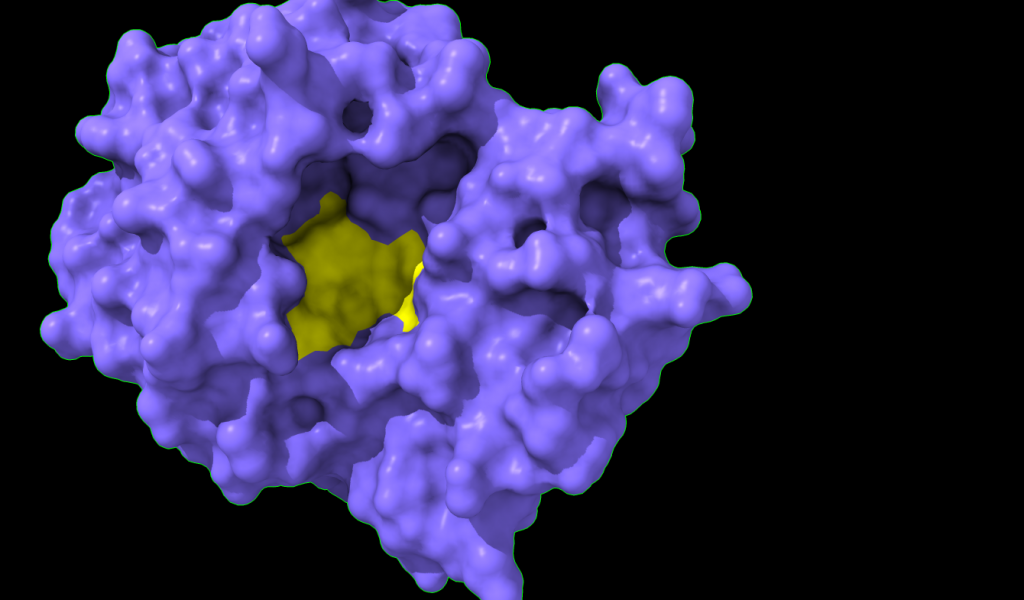
El centro activo posibilita la catálisis y confiere la actividad tóxica a la enzima. Esta cadena tiene poder N-glicosidasa y la reacción ocurre en el centro activo. El centro activo está formado por residuos de aminoácidos de diferente naturaleza que actúan sobre el sustrato: la adenina.
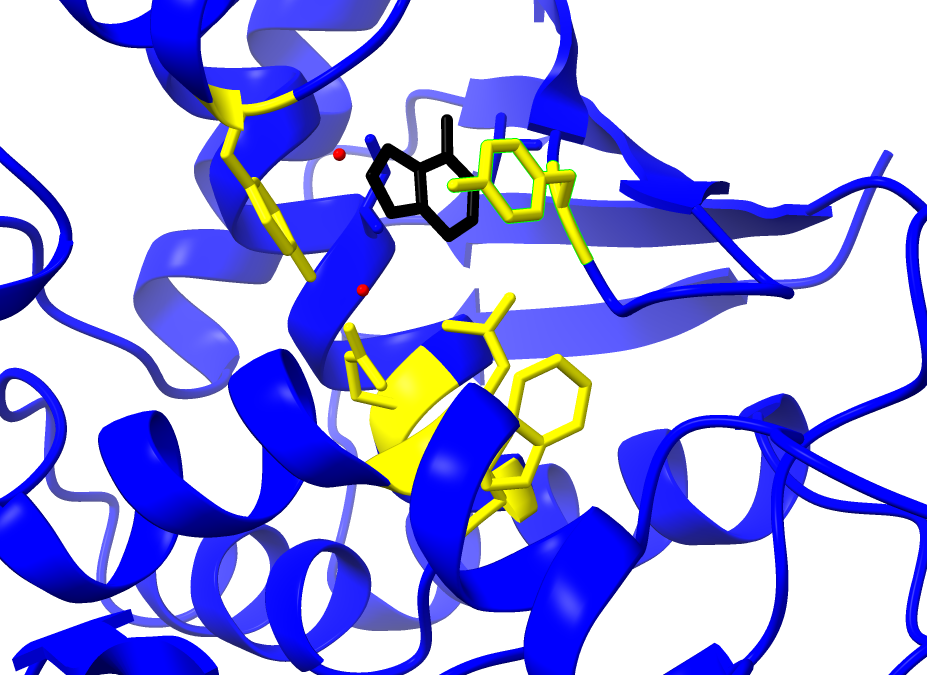
Dentro de los componentes del sitio activo se encuentran los residuos: Tyr 80, Tyr, 123, Glu177, Arg180, Trp211 (Polito et al., 2019)
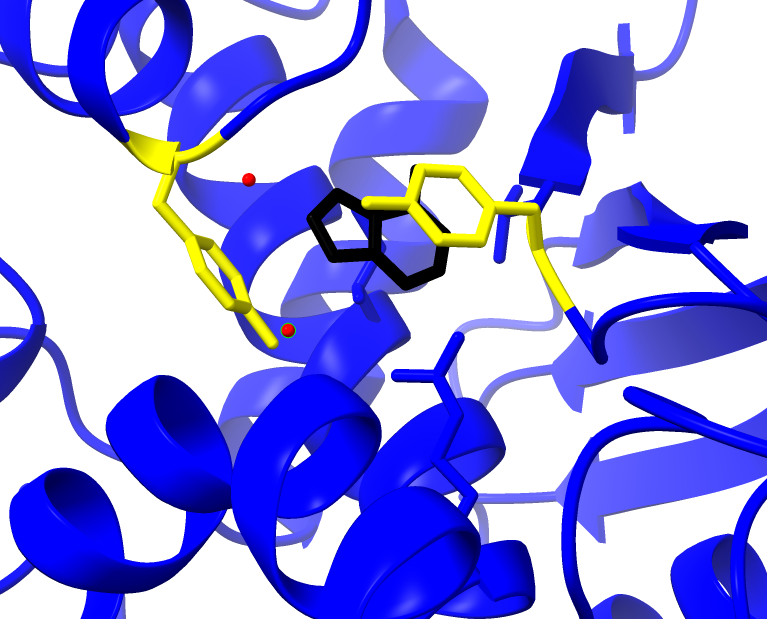
«Stacking»
Centro activo en superficie
Mecanismo de acción
1. Las tirosinas 80 y 123 tienen un papel fundamental al disponerse de forma casi paralela, creando una situación “stacking” entre anillos aromáticos, lo que permite anclar el sustrato.
2. La arginina 180 protona el N-3 de la adenina, y ello promueve la ruptura del enlace N-glicosídico entre el N-9 de adenina y C-1 de la ribosa formando un intermedio de reacción : un catión oxicarbonio.
3. A su vez, el glutámico 177 estabiliza el estado intermedio de la reacción. La estabilización se debe a la diferencia de cargas entre el intermedio de reacción(carga positiva) y el glutámico 177(carga negativa).
4. La reacción se completa por la actuación de una molécula de agua. Esta adquiere un carácter hidróxido al ceder un protón a la arginina 180 neutralizando su carga, y posteriormente uniéndose al C-1 del ión oxicarbonio. (Montfort et al., 1987)
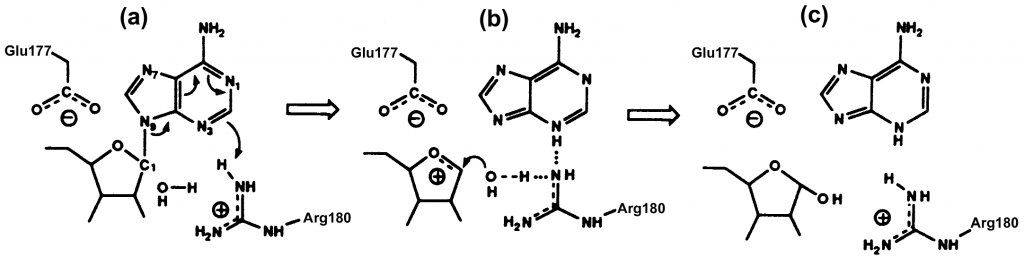
(Pita & Martínez-larrañaga, 2004)
PAPEL BIOMÉDICO Y BIOTECNOLÓGICO
Las distintas propiedades citotóxicas que presenta esta enzima la convierten, por un lado, en una proteína de interés como terapia contra el cáncer en humanos y, por otro, en una mortal arma biológica. Hay distintas maneras de usarla, entre ellas se encuentran: la vía dérmica, que no sería la opción más invasiva; la vía parenteral, utilizada en asesinatos selectivos; y la vía digestiva e inhalatoria, capaces de causar un elevado número de víctimas. (Pita et al., 2004)
Intoxicación por vía digestiva
Intoxicación por vía parenteral
Intoxicación por vía inhalatoria
Los casos que se han dado por vía digestiva provienen de pacientes que han ingerido semillas de ricino y de estudios in vivo con animales. Las semillas se usan en la fabricación de collares (frecuentes ingestas accidentadas en niños), y en medicina natural como anticonceptivo, emético, purgante y como tratamiento contra la sífilis y la lepra. En los casos de intoxicaciones más graves, se ha llegado a dar diarrea intensa produciendo una grave deshidratación, e incluso shock hipovolémico. (Pita et al., 2004)
La intoxicación por esta vía es de las más peligrosas, pudiendo ocasionar síntomas como: fiebre, taquicardia, cefalea, escalofríos, inflamación de los nódulos linfáticos, vértigo, náuseas, hipotensión, acidosis metabólica, etc. Incluso, en dosis más elevadas puede llegar a producir un fallo multiorgánico y, posteriormente, la muerte. Estudios in vivo con distintos animales demuestran que la ricina se distribuye sobre todo en el bazo, en el hígado y en los nódulos linfáticos, produciendo lesiones necróticas y apoptóticas. (Pita et al., 2004)
En humanos, los síntomas por inhalación observados han sido: tos, disnea, artralgia, fiebre, dolor en el pecho y náuseas; y también, se han realizado ensayos con roedores y primates.
Otro de los experimentos más famosos que se han realizado con ricina ocurrió en Estados Unidos, a finales de la Primera Guerra Mundial, donde se decidió sustituir el fosgeno por la ricina como agente neumotóxico de guerra; ya que la ricina era 40 veces más tóxica. Así comenzó el uso de esta fitotoxina como “arma de destrucción masiva”. Aún así se siguió utilizando en asesinatos selectivos y en interrogatorios de presos como “droga de la verdad”, ya que se observó que también actuaba sobre el sistema nervioso central. (Pita et al., 2004)
Una de las principales ventajas de la toxicidad de la ricina es su uso como agente anticancerígeno en terapias experimentales. Su eficacia reside en que las células cancerosas requieren una mayor tasa de proliferación, por lo tanto, de síntesis de proteínas; y la acción de la ricina lo que produciría sería la inhibición de dicha síntesis. (Franke et al., 2019). Pero, existe riesgo de fallo multiorgánico, por ello sigue siendo objeto de investigación. (Pita et al., 2004)
Conclusión
En definitiva, la ricina es capaz de desencadenar múltiples vías de muerte sobre dianas moleculares a las que se une covalentemente (células cancerosas). (Franke et al., 2019). Sin embargo, se ha descubierto que la ricina tiene muchas limitaciones como, por ejemplo, su toxicidad inespecífica. Es por ello que, de momento, no se está utilizando como agente terapéutico, y ya ha llegado a producir casos de intoxicación en animales, pudiendo llegar a ser peligroso para la salud en humanos. (Polito et al., 2019)
Bibliografía
Montfort, W., Villafranca, J. E., Monzingo, A. F., Ernst, S. R., Katzin, B., Rutenber, E., Xuong, N. H., Hamlin, R., & Robertus, J. D. (1987). The three-dimensional structure of ricin at 2.8 A. Journal of Biological Chemistry, 262(11), 5398–5403. https://doi.org/10.1016/S0021-9258(18)61201-3
Juan, T. G. (2009). Mecanismos de acción de las lectinas antinutrientes con actividad antirribosómica ricina, volkensina, nigrina y ebulina y aplicaciones terapéuticas de nigrina y ebulina (Doctoral dissertation, Universidad Complutense de Madrid).
Girbés Juan, T. (2009, December). Proteínas inactivadoras de ribosomas (RIPs) y sus aplicaciones en la construcción de inmunotoxinas para la terapia experimental del cáncer. In Anales de la Real Academia Nacional de Farmacia (Vol. 66, No. 3).
Hernández Díaz, P., Martín González, O., Rodríguez de Pablos Vélez, Y., & Ganem Báez, F. A. (1999). Aplicaciones de las lectinas. Revista Cubana de Hematología, Inmunología y Hemoterapia, 15(2), 91-95.
Franke, H., Scholl, R., & Aigner, A. (2019). Ricin and Ricinus communis in pharmacology and toxicology-from ancient use and “Papyrus Ebers” to modern perspectives and “poisonous plant of the year 2018”. Naunyn-Schmiedeberg’s archives of pharmacology, 392(10), 1181-1208.
Pita, R., & Martínez-larrañaga, A. A. (2004). Ricin: a phytotoxin of potential use as a weapon. Toxicologia, 21(3), 51–63.
Polito, L., Bortolotti, M., Battelli, M., Calafato, G., & Bolognesi, A. (2019). Ricin: An Ancient Story for a Timeless Plant Toxin. Toxins, 11(6), 324. https://doi.org/10.3390/toxins11060324
Lord, J. M., Roberts, L. M., & Robertus, J. D. (1994). Ricin: structure, mode of action, and some current applications. The FASEB journal, 8(2), 201-208.