ATPsintasa: el motor del organismo
Por Adalía Gómez, Lucía Devidé y Nerea Ercoreca
INTRODUCCIÓN
La ATP sintasa, también conocida como F0F1-ATP sintasa, es uno de los complejos enzimáticos más importantes presentes en las células de los seres vivos, ya que lleva a cabo el 90% de la síntesis de ATP en condiciones aerobias (en presencia de O2) de toda la célula. Es el encargado de proporcionar la energía necesaria para desarrollar todos los procesos vitales, y lo hace mediante la síntesis de ATP a partir de la unión de ADP y fosfatos inorgánicos. Su nombre se debe a las dos subunidades que lo componen, que son la F0 y la F1. Ambas están unidas por un tallo central perteneciente a la F1. (Cano-Estrada y González-Halphen, 2011)
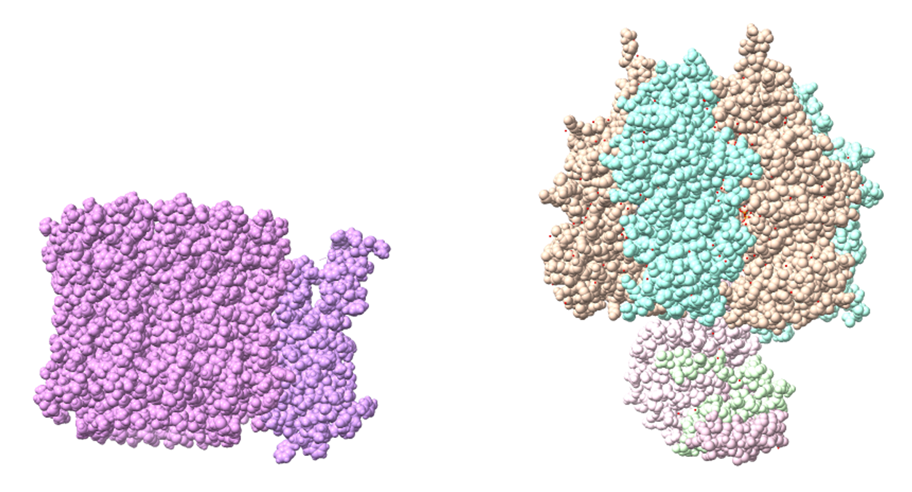
En la imagen de la derecha observamos la subunidad F1 de la ATP-sintasa. Elaboración propia a partir de PDB 1e79
En general, su tamaño ronda los 371 kDa, por lo que se podría considerar bastante grande. La síntesis de ATP es posible gracias al gradiente electroquímico que se genera entre los dos compartimentos que separa la membrana en la que está insertada la proteína. Los protones van pasando desde uno de los espacios hacia otro gracias a los complejos enzimáticos pertenecientes a la cadena de transporte de electrones, de manera que cuando el proceso acaba, en uno de los dos espacios la concentración de iones es mucho mayor, generando la diferencia de potencial necesaria. Los protones, al tener carga, no pueden atravesar las membranas, así que solo pueden pasar por el camino que les deja la ATP sintasa (1).
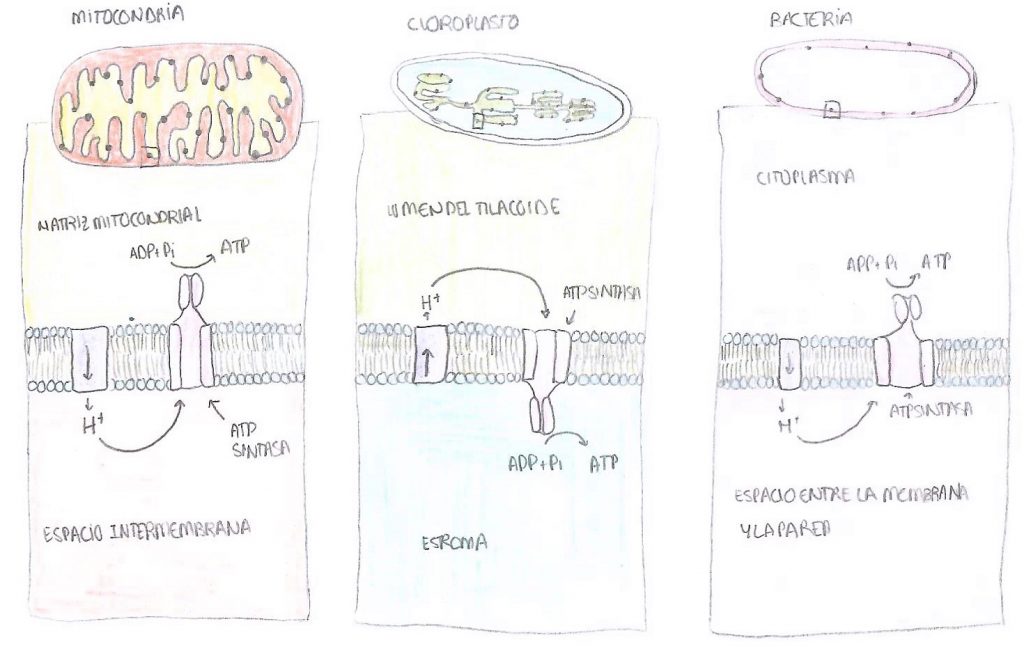
En cuanto a su localización, podemos encontrarla en las mitocondrias, cloroplastos y en bacterias. En las mitocondrias, se encuentra insertada en la membrana interna, en las crestas, de manera que la subunidad catalítica, es decir, la F1, queda en contacto con la matriz mitocondrial. El NADH y del FADH2, que han sido sintetizados durante todas las rutas del catabolismo anteriores, llegan a la mitocondria y ceden tanto sus electrones como los protones, de manera que estos pasan desde la matriz mitocondrial hacia el espacio intermembrana, donde aumenta la concentración de estos iones. Una vez necesitan pasar de nuevo a la matriz, atraviesan la ATP sintasa. Su mecanismo se explicará más adelante.
Además, cabe destacar que en las mitocondrias la ATP sintasa aparece formando un dímero en el que las subunidades aparecen muy pegadas, lo que ayuda a la formación de la membrana interna que está tan replegada en este orgánulo. Hay unas 320.000 ATP sintasas en cada mitocondria.
En el caso de los cloroplastos, los protones pasan del estroma al lumen de los tilacoides, y una vez pasan por la ATP sintasa vuelven al estroma. En las células vegetales, se trata del paso final de la fase luminosa o dependiente de la luz de la fotosíntesis, que culmina con la síntesis del ATP que se empleará más tarde en la fase oscura o no dependiente de la luz. En las bacterias. Los protones pasan desde el citoplasma al espacio entre la membrana y la pared bacteriana, y una vez atraviesan la ATP sintasa vuelven al citoplasma. Esto significa que el ATP, una vez sintetizado, se libera a la matriz mitocondrial, al estroma del cloroplasto y al citoplasma de la bacteria.
En 1997, Paul Boyer y John Walker fueron galardonados con el premio Nobel de Química debido a la explicación que dieron sobre la síntesis de ATP gracias a la ATP sintasa. Boyer y Walker determinaron con precisión el proceso a través del cual el ADP recupera la unión con el fosfato por un enlace covalente, que es rico en energía, para formar nuevamente el ATP, proceso promovido por la presencia de H+.
En la década de los años 70, se creó un modelo para el funcionamiento de esta enzima, que establece su estructura como tres proteínas ensambladas. Una simula una rueda, alojada en la membrana interna de la mitocondria, otra una varilla con un extremo fijo al centro de la rueda, y otra un gran cilindro que envuelve y gira alrededor del otro extremo de la varilla. El ATP se forma en tres sitios sobre el cilindro y la varilla juega un papel fundamental en la actividad catalítica.
Paul Boyer es quien elaboró la teoría sugiriendo que los H+ hacen girar a la rueda, al pasar a través de la membrana interna de la mitocondria hacia la matriz del orgánulo. Esta rotación de la rueda implica cambios conformacionales en la proteína, y altera la conformación de los sitios en los que se produce la unión y la síntesis del ATP. Este bioquímico observó que en el caso de la ATP sintasa, se usa la energía para unir los elementos necesarios a la enzima y soltar las moléculas de ATP una vez han sido formadas.
En 1994, Walker confirmó la teoría y mediante cristalografía se consiguió crear un mapa en escala atómica de la porción catalítica de la enzima. Esta visualización de la estructura tridimensional permitió observar mejor el funcionamiento de la enzima, y propusieron las tres conformaciones por las que pasan las subunidades catalíticas que se explicarán más adelante.
ESTRUCTURA Y MECANISMO
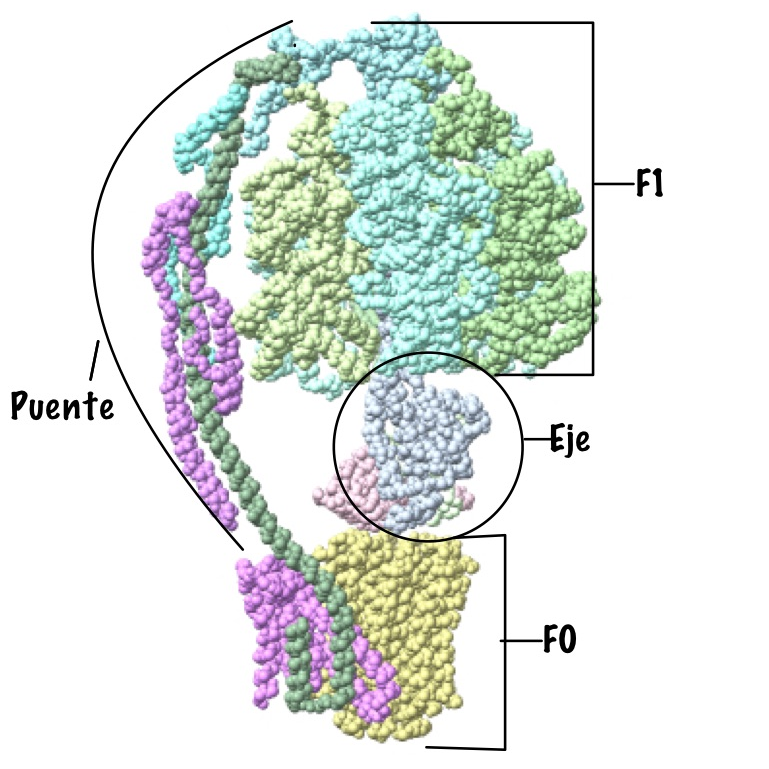
Esta proteína se caracteriza por estar compuesta por dos grandes subunidades, cada una determinada por un dominio estructural distinto. Como su nombre indica, estas subunidades son la F0 y la F1.
La primera de ellas es la subunidad encargada de la translocación de los protones, es decir, la encargada de la rotación de la proteína de manera que los protones pueden atravesarla. Tiene dominio transmembrana, ya que está insertada en las membranas correspondientes que ya se han explicado antes, por lo que está compuesta por moléculas hidrófobas. En función de la especie, se pueden determinar la clase de subunidades que a su vez presenta este dominio, al igual que el número de las mismas que está presente, pero en general tenemos los siguientes.
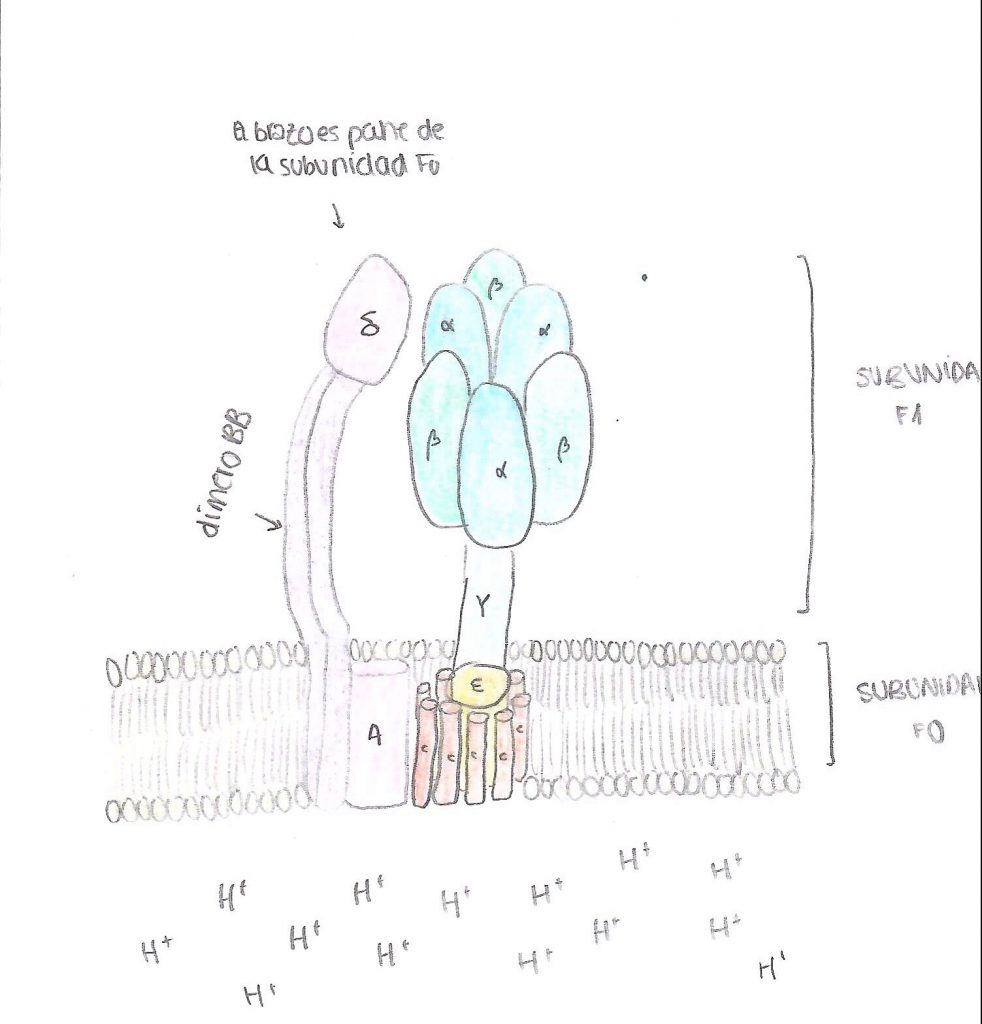
En primer lugar, un anillo con entre 10 y 14 subunidades de tipo C, que son proteolípidos organizados en dos cadenas hélices alfa asociadas. Destaca en su composición la presencia de un aminoácido de tipo aspartato en posición 61, que es imprescindible para el bombeo de protones. Además, encontramos dos subunidades de tipo B, que se organizan formando un puente entre las dos grandes subunidades de la proteína, y dos otras subunidades, una delta y una A, que unen el dímero de subunidades B con el resto de la proteína, la A con la unidad bombeadora y la delta con la unidad sintetizadora. Cabe destacar que los protones pasan a través de la proteína por un conducto formado en este dominio, entre las subunidades C y A. (Domínguez-Ramírez & Gómez Puyou, 2005)
En segundo lugar, la subunidad catalítica es la encargada de la síntesis del ATP propiamente dicho, ya que se encarga de unir el fosfato inorgánico a la ADP. Este dominio está compuesto por cinco tipos distintos de subunidades (alfa, beta, gamma, delta y épsilon), que son solubles e hidrofílicas. Está en contacto con el medio interno de la mitocondria (la matriz mitocondrial), con el estroma del cloroplasto y con el citoplasma en el caso de las bacterias.
El anillo principal está constituido por tres dímeros con subunidades alfa y beta. En el caso de la ATP sintasa, son las subunidades beta las encargadas de llevar a cabo la síntesis del ATP, no las alfa. Las subunidades beta están codificadas cada una de las tres por un gen distinto, pero una vez formadas se puede observar que los aminoácidos que las componen son equivalentes. En cuanto a las otras subunidades, gamma, delta y épsilon son las encargadas de formar el tallo que une las dos subunidades principales, y además gamma interviene en la rotación de la subunidad sintetizadora, por lo que como se explicará más adelante, modifica a las subunidades beta para que acepten el ADP.
La acción catalizadora de esta proteína se debe tanto a un cambio conformacional en los dímeros de alfa y beta como a la rotación de la subunidad sintetizadora. Existen tres conformaciones entre las que se alternan a lo largo del proceso de síntesis de ATP. La primera se denomina E (empty, vacía), aunque también se puede denominar O (open, abierta), y es la primera, ya que todavía no tiene nada unido. Una vez se une el tanto el ADP como el fosfato, se pasa a la conformación DP o L. Cuando se está catalizando la formación de ATP, se pasa a la conformación TP o T. Una vez formado, se libera y se pasa de nuevo a la conformación E, para que pueda volver a comenzar el ciclo. (Sánchez-Vásquez, L., & González-Halphen, D, 2017)
FUNCIÓN
Las ATP sintasas funcionan gracias a la diferencia de potencial eléctrico entre los dos lados de la membrana en la que se encuentran. Encontramos una mayor concentración de protones en el espacio intermembrana y una menor concentración en la matriz mitocondrial. En los cloroplastos, los protones de hidrógeno se acumulan dentro de los tilacoides, en lo denominado espacio mitocondrial espacio tilacoidal o lumen; y hay una menor concentración de protones en el estroma, por lo que pasarán por la atp sintasa, hacia ese espacio. A medida que los protones pasan por la atp sintetasa se produce ATP.
La Atp sintetasa permite el paso de protones del espacio intermembrana a la matriz. Cuando entra un protón en la atp sintetasa se une a una de las proteínas de C12 y saldrá cuando esta haya completado una vuelta entera. Las proteínas gama y espriol tmb giran y se produce la catálisis rotatoria. Esto produce la síntesis de atp
Cuando entra un protón en la ATP sintasa se une a las proteínas C12 (de f0). Cuando el protón atraviesa el anillo c, la F0 gira 120 grados. Las proteínas gama y épsilon también giran y se produce la catálisis rotatoria. Al producirse esta rotación, esto hace que cambie la conformación de la subunidad beta. Como ya se ha mencionado anteriormente en la estructura, la atp sintasa cuenta con 3 estados (el estado L, T y O). En el estado L (libre), en la subunidad beta se encuentran tanto ADP como el P; pero al pasar el protón, se produce la rotación y la atp sintasa pasa al estado T (tensa). En el estado T aumenta la afinidad de la proteína beta con el atp por lo que se produce una fosforilación de ADP y el P. Cuando entra otro protón en la atp sintasa, se produce una rotación, y pasa del estado T al estado O (open, abierto). El estado O o E tiene menos afinidad por el ATP y lo suelta a la matriz mitocondrial en el caso de las mitocondrias; al estroma en el caso de los cloroplastos y al citoplasma en el caso de las bacterias.(García Bermúdez, 2015)
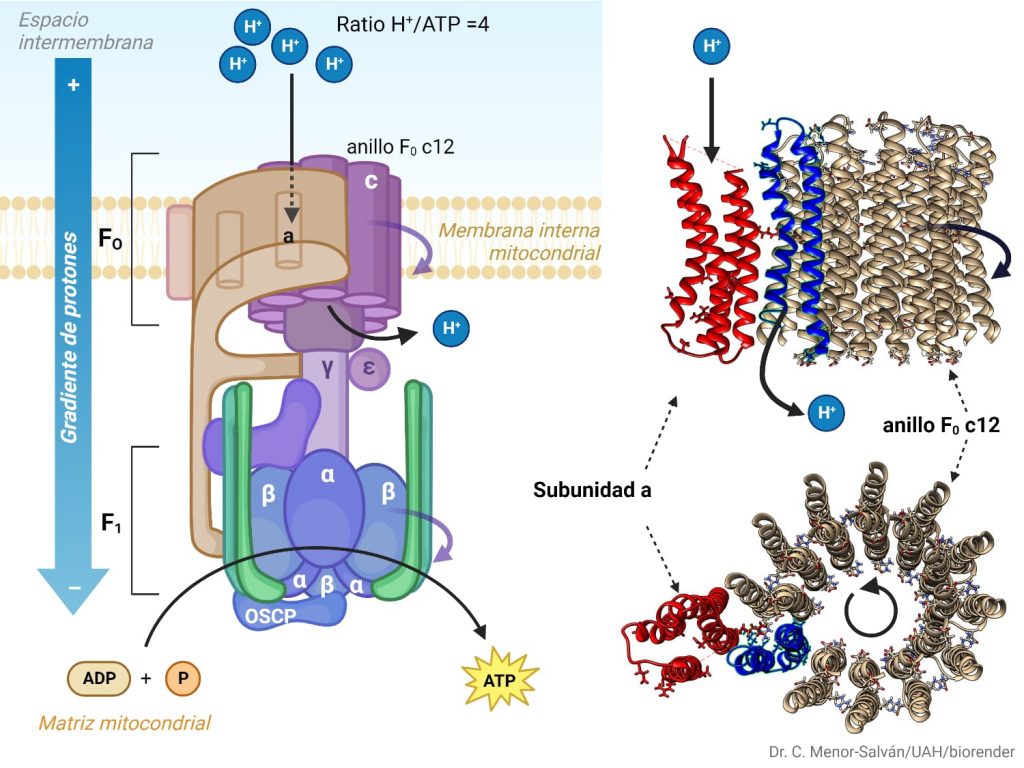
Cuando el estado O libera el ATP, al mismo tiempo se produce la unión de un nuevo ADP y P. En una rotación de 120 grados se produce un ATP y en una rotación entera se producen 3 ATP (120×3=360)
En este proceso se ha podido observar que la ATP sintetasa transforma la energía del gradiente de protones en la energía química que se acumula al formar los enlaces del ATP. La ATP sintetasa permite que se mantenga el equilibrio eléctrico y se obtiene energía.
EL PAPEL BIOMÉDICO DE LA ATP-SINTASA
Como ya se ha mencionado, la ATP-sintasas desempeña un papel fundamental en la producción de ATP. Pero ¿Qué pasaría si su funcionamiento se viera alterado?, lo primero en lo que pensaríamos sería que no produciríamos tanto ATP y ¿esto cómo afectaría a nuestro organismo? Para empezar, se reducirían nuestros niveles de energía y no podríamos realizar funciones básicas, por ejemplo, no podríamos crear nuevas proteínas, el corazón no podría bombear la sangre, tampoco seriamos capaces de caminar o hablar, etc.
Desde un punto de vista bioquímico, una disminución del ATP provoca acidosis láctica, ya que la disminución de ATP hace que la relación de NADH: NAD aumente y, según el principio de Le Châtelier, el equilibrio de la reacción se desplaza hacia el lactato. La acidosis láctica es conocida por provocar una disminución de la tensión arterial y del número de moléculas de O2 que llegan al cuerpo.
Una solución que se han investigado con el objetivo de que los niveles de ATP no se reduzcan es la conocida cómo: ‘la técnica de los tres padres’. Con este mecanismo se busca evitar que se transmitan mutaciones que pueden afectar a la producción de ATP. Su funcionamiento es el siguiente, se mezcla el núcleo del ovulo de una portadora con el óvulo de una donadora sana y se obtendría un hijo sano. Se emplean óvulos y no espermatozoide porque la mitocondria, orgánulo en el que se encuentran las ATP-sintasas, procede del ADN materno.
No obstante, la ATP-sintasas también está relacionada con la medicina de otras maneras que no implican una reducción de los niveles de ATP.Una de ellas es el envejecimiento. Durante la respiración mitocondrial, una parte de los electrones que van desde los sustratos hasta el oxígeno en la cadena respiratoria reacciona con el oxígeno molecular produciendo O2. También se produce NO a partir deóxido nítrico sintetasa, un electrón no apareado y un radical libre de oxígeno y nitrógeno. Una gran acumulación de estos dos radicales es lo que acelera el envejecimiento, pues produce daños en grandes moléculas, ya que estos dos compuestos dan lugar al radical HO, el cual es un oxidante muy reactivo, capaz de extraer un átomo de hidrógeno de los ácidos grasos insaturados de las membranas celulares y de las bases púricas y pirimidínicas de los ácidos nucleicos. Esto da lugar a radicales alquilo y, en el caso de los ácidos nucleicos, estos radicales se dimerizan. No obstante, en el caso de los ácidos grasos, los radicales dan lugar a reacciones que adicionan O2, que originan radicales peroxilo y, cuando hay una nueva extracción de hidrogeno, se produce un hidroperóxido y un nuevo radical alquilo. A este proceso se le conoce como peroxidación lipídica y lleva a una pérdida de función de las membranas. »Envejecimineto mitocondrial» (Boveris et al., 2000)
Otra relación que tiene la ATP-sintasa con las enfermedades es el cáncer, pues estudios recientes confirman que en la gran mayoría de células tumorales se encuentra un compuesto conocido como ALDH1A3 (se trata de un biomarcador de este tipo de células y guarda una relación con la resistencia a quimioterapia y la metástasis).El mismo estudio ha descubierto que al ALDH1A3 está unido el ATP y que este compuesto actúa como un inhibidor reversible de ALDH1A3.De esto deducíamos que una determinada cantidad de ATP sintetizado se relaciona con la cantidad de células neoplásicas. «Structural and biochemical evidence that ATP inhibits the cancer biomarker human aldehyde dehydrogenase 1A3.» (Castellví, Albert, et al. 2022)
Referencias
Atanasio, R. V. (2012). ¿ ATP-sintasas ectópicas?. MoleQla: revista de Ciencias de la Universidad Pablo de Olavide, (7), 40-43.
Boveris, A., Costa, L. E., & Junqueira, V. B. (2000). Envejecimiento mitocondrial. Ciencia e Investigación, 3(1), 13-23.
Cano-Estrada, A., & González-Halphen, D. (2011). F1F0-ATP Sintasa y sus diferencias estructurales. Revista de Educación Bioquímica, 30(3), 98-108.
Castellví, Albert, et al. «Structural and biochemical evidence that ATP inhibits the cancer biomarker human aldehyde dehydrogenase 1A3.» Communications Biology 5.1 (2022): 354.
Domínguez-Ramírez, L., & Gómez-Puyou, M. T. D. (2005). La F 1 F 0 ATP sintasa: un complejo proteico con gran versatilidad estructural y funcional. TIP. Revista especializada en ciencias químico-biológicas, 8(1), 18-27.
García Bermúdez, J. (2015). Regulación de la expresión y actividad de IF1, el inhibidor fisiológico de la H+-ATP sintasa de la mitocondria.
Sánchez-Vásquez, L., & González-Halphen, D. (2017). Topología y función de las subunidades intrínsecas de la membrana de las F 1 FO-ATP sintasa mitocondriales. TIP. Revista especializada en ciencias químico-biológicas, 20(2), 29-47.