CICLOOXIGENASAS, ¿AMIGAS O ENEMIGAS?
Miranda Maceira, Marina López y Patricia Moreno
INTRODUCCIÓN
Las ciclooxigenasas (COXs), también conocidas como prostaglandina-endoperóxido sintasas (PGHSs, por sus siglas en inglés) son enzimas con un papel esencial en la biosíntesis de prostaglandinas a partir de ácido araquidónico. Existen 2 isoformas conocidas de la ciclooxigenasa: COX-1 y COX-2.
Su función es de gran importancia, ya que las prostaglandinas que sintetizan son necesarias para el mantenimiento de condiciones óptimas en nuestro organismo, pero también pueden provocar graves efectos adversos para los cuales se han encontrado diversos tratamientos, como los AINEs.
ESTRUCTURA
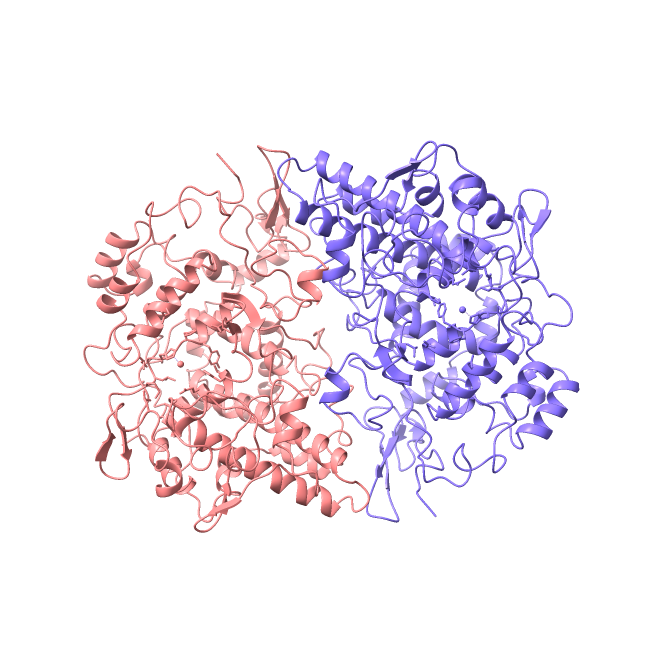
En humanos tanto COX-1 como COX-2 son homodímeros compuestos de 576 (COX-1) y 581 (COX-2) aminoácidos. Al ser isoformas, la cadena de aminoácidos de ambas enzimas coincide en un porcentaje muy alto (alrededor de un 90%) y sus estructuras tridimensionales son muy similares. La principal diferencia entre COX-1 y COX-2 es el sitio de unión para el ácido araquidónico, que es más amplio en COX-2. Esto permite que accedan a la enzima AINEs (medicamentos antiinflamatorios no esteroides) de un tamaño mayor que los que pueden acceder a COX-1.
Cada una de las subunidades que componen el dímero se pueden dividir en tres dominios funcionales. Además, las COXs poseen tres oligosacáridos con alto contenido en manosa; existe un cuarto oligosacárido que se encuentra de manera exclusiva en la COX-2 y actúa en la degradación de dicha proteína.
En cuanto a los tres dominios que componen cada subunidad del dímero, esto son:
- Dominio similar al factor de crecimiento epidérmico, situado entre los residuos 34 y 72.
- Dominio de unión a la membrana, situado entre los residuos 73 y 116; se trata de un
dominio formado por cuatro hélices alfa que constituyen un canal. Este canal permite la entrada del ácido araquidónico de la membrana al sitio en el que se realiza la actividad enzimática de ciclooxigenación. - Dominio catalítico; dominio que ocupa la mayor parte de la proteína, contiene los dos sitios activos (el que cataliza la ciclooxigenación y el que cataliza la peroxidación) a ambos lados de un grupo prostético hemo.
El sitio activo de la peroxidasa consiste en un grupo hemo situado en el fondo de una hendidura poco profunda. Está situado en el lado opuesto del dominio de unión a la membrana. Esta estructura facilita el acceso del sustrato al grupo hemo y explica en parte el carácter promiscuo de la enzima en cuanto a los sustratos a los que se une.
El sitio activo de la ciclooxigenasa se encuentra en el lado opuesto del grupo hemo, en la parte superior de un canal en forma de L que comienza en el dominio de unión a la membrana. Esta estructura es más ancha en el principio y se va estrechando, de modo que debe abrirse para que los sustratos (o los inhibidores) puedan penetrar en ella. Existe una serie de aminoácidos con residuos hidrofóbicos que separan el extremo más estrecho de una zona en curva del canal. Al final de este canal se encuentra el residuo Tyr-385, imprescindible para la actividad enzimática.
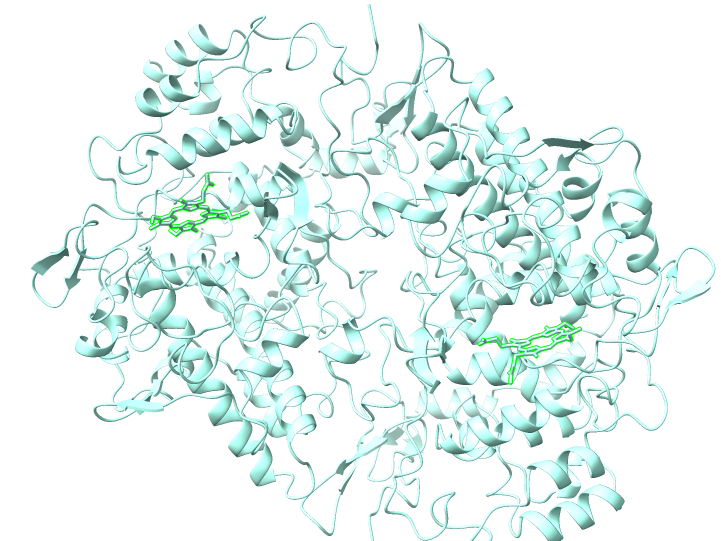
Una manera en la que pueden actuar los inhibidores de esta enzima es impidiendo el paso del sustrato, por ejemplo el ASA acetila un residuo de serina en la superficie del canal, inhibiendo la actuación tanto de la COX-1 como de la COX-2.
FUNCIÓN BIOLÓGICA Y MECANISMO
La función clave de la enzima ciclooxigenasa es catalizar la síntesis de prostaglandinas llevada a cabo por oxidación del ácido araquidónico. Las COX se ensamblan en el retículo endoplásmico y se insertan en la membrana formando homodímeros funcionales. Por su parte, el ácido araquidónico se encuentra en la bicapa lipídica de la membrana celular y, cuando se detecta uno de los estímulos, se libera por hidrólisis gracias a la actuación de la enzima PLA2 (fosfolipasa A2).
Cuando se ha liberado, el ácido araquidónico debe entrar en el canal de acceso de la COX hacia
su sitio catalítico, donde se da la oxigenación. Por tanto, el proceso de síntesis de postaglandinas estará compuesto por la peroxidación del ácido araquidónico (mediante las COX), obteniendo el endoperóxido de prostaglandina G2 (PGG2), pero también por la posterior reducción de esta a prostaglandina H2 o PGH2, compuesto más estable, en el que también actúa la COX.
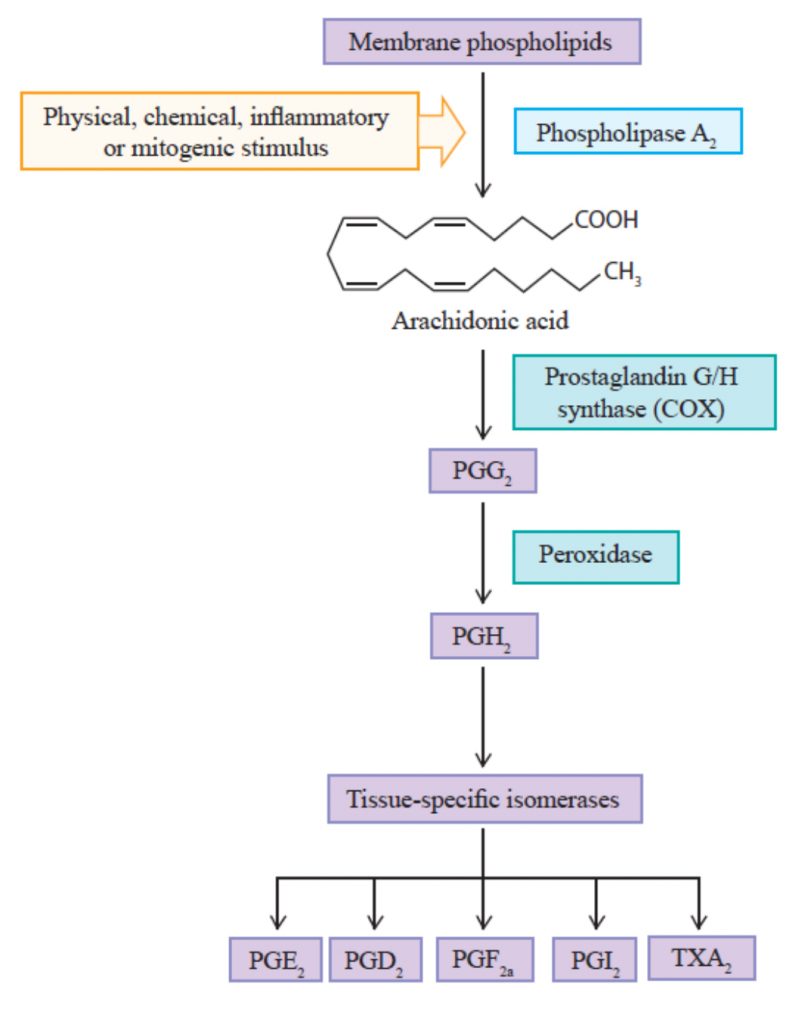
Las prostaglandinas son una familia de lípidos perteneciente al grupo de los eicosanoides. Entre sus funciones biológicas principales en el SNC se encuentra la regulación de la memoria y el sueño y parecen relacionadas con las enfermedades neurodegenerativas.
Sin embargo, su papel en el control del dolor y la fiebre será el que nos interese para este artículo. Esto se debe a que el estudio del tratamiento de pacientes con estos síntomas desembocó tanto en el descubrimiento del ácido acetilsalicílico como fármaco capaz de paliar dichos síntomas (debido a su capacidad de bloqueo de la producción de prostaglandinas) como en el descubrimiento de la existencia de las dos principales isoformas de esta enzima: la COX-1 y la COX-2. Ambas poseen una estructura similar pero el estudio de sus funciones ha reflejado que pueden actuar de maneras diferentes ante distintas situaciones clínicas.
La COX-1 se expresa de manera constante y constitutiva en la mayoría de las células y tejidos. Su función principal se basa en el mantenimiento de la síntesis de prostanoides en nuestro organismo. Se encarga de promover el aumento en su producción de manera rápida y de corta duración.
Sin embargo, la COX-2 resulta patológica en cierta medida ya que, aunque no se encuentra en la mayoría de nuestros tejidos, su síntesis aumenta desmesuradamente ante ciertos estímulos como, por ejemplo, en respuesta a citoquinas, factores de crecimiento, oncogenes, carcinógenos del tabaco o incrementos en la concentración de Ca2+ intracelular… Esto quiere decir que un incremento en la expresión de COX-2 aumentaría la síntesis de prostaglandinas asociadas con la inflamación e incluso la carcinogénesis.
IMPLICACIONES BIOMÉDICAS
Como se ha mencionado anteriormente, la familia de las ciclooxigenasas (COX) tienen como función principal la síntesis de las prostaglandinas encargadas de llevar a cabo la respuesta inflamatoria que desencadena la vasodilatación, el aumento de la permeabilidad de los tejidos, antiagregante plaquetario, etc. Asimismo, las prostaglandinas tambien activan a los tromboxanos encargados de la coagulación sanguínea, por lo que tienen implicaciones en el dolor y provoca el color rojizo que se da cuando hay un aumento de la cantidad de leucocitos.
Cuando se produce alguno de estos síntomas en nuestro cuerpo, se pueden utilizar diversos fármacos para inhibir su acción, siendo los más conocidos la aspirina y el ibuprofeno. Ambos son antiinflamatorios no esteroideos (AINEs) y actúan como inhibidores, en el caso de la aspirina, se trata de un inhibidor suicida que, al unirse a la ciclooxigenasa y bloquear su acción, desaparece; por otro lado, el ibuprofeno actúa como un un inhibidor no selectivo de la COX-1. Los dos se aplican en varias dosis diarias y tienen una gran efectividad. No obstante, un uso frecuente del ibuprofeno puede desencadenar en enfermedades como úlceras gástricas o complicaciones cardiovasculares.
Los AINEs son medicamentos utilizados frecuentemente como medio para aliviar dolores y síntomas de inflamación, pero un uso excesivo o un mal uso de estos puede desencadenar diferentes síntomas y enfermedades fisiológicas.
En cuanto a las 2 isoformas de ciclooxigenasas; COX-1 tiene un papel importante en la protección de la mucosa gástrica y prostaglandinas, está relacionada por tanto con los tromboxanos mencionados anteriormente; por su parte COX-2 promueve la inflamación y el dolor. Como se puede observar, tienen efectos adversos por lo que la acción de AINEs sobre COX-2 inhibe la hinchazón mientras que la inhibición de COX-1 promueve la tumefacción gástrica.
Uno de los casos mas frecuentes por inhibición de COX-1 se encuentran en el estómago. En este órgano, se encuentran una gran cantidad de prostaglandinas (PGE2 y PGI2) que se encargan de estimular la secreción de mucosa, jugos gástricos y bicarbonato para el mantenimiento del pH del estómago, protegiéndole de cualquier sustancia extraña que pudiese entrar en él o de algún desequilibrio homeostático corporal. La ingesta alta de cualquier fármaco, en este caso el ibuprofeno, altera los niveles de las prostaglandinas ya que inhibe la síntesis de la COX-1, produciendo daños a nivel estomacal y provocando una úlcera gástrica. Como consecuencia, se reduce la secreción de moco, jugos y agregación plaquetaria. Tiene lugar ahora la acción de la COX-2 que “respalda” los daños provocados por la inhibición de la COX-1, pues se encarga de contrarrestar el daño producido cuando se han visto alterados los niveles de aquellas moléculas encargadas de la protección del estómago.
Como efecto adverso, la COX-2 se encarga de la cicatrización de esta gastro-lesividad. En condiciones normales, la presencia de esta COX en el estómago esta en bajos niveles, pero al producirse tal daño por la inhibición de la COX-1, se aumenta su producción desencadenando la proliferación de células para la renovación del epitelio gastrovascular.
Asimismo, la inhibición de las COX se encuentra altamente regulada, pues al tener efectos contarios y al trabajar de forma independiente, se aseguran que se mantenga un equilibrio homeostático del cuerpo, evitando daños a largo plazo.
Otro caso destacable de inhibición de las ciclooxigenasas es mediante la acción del diclorofeno. Se trata de un medicamento que tiene efectos analgésicos yantinflamatorios que se utiliza para la enfermedades como esofagitis, hipercoagulabilidad dolores de cabeza, vómitos… Se suele tomar cuando se comienza teniendo un leve dolor y tanto como éste como sus síntomas aumentan.Este fármaco tiene un uso de aproximadamente de 3-5 días debido a las graves consecuencias que podría causar en el caso de un uso excesivo. No obstante, la prescripción de este varía entre las personas y la seriedad de sus síntomas.
El diclorofeno, en un uso desmesurado, podría causar desde problemas gastro-intestinales y hepáticos hasta el posible desarrollo de accidentes cerebros vasculares y hemorragias gástricas. Existen enfermedades graves por inhibición de las ciclooxigenasas ,por culpa de este medicamento, como por ejemplo el síndrome de Steven-Johnson que provoca una reacción de hipersensibilidad en el cuerpo afectando a la piel y a las muscosas, y por tanto, causando problemas en los órganos internos.
REFERENCIAS
- Arenas, O. F., Lunar, E. L., García, M. G., Correas, F. H., & García, B. (2012). Síndrome de Stevens-Johnson inducido por levofloxacino. Farmacia Hospitalaria, 36(n01).
- Desmonts, J. ¿Para qué sirve el ibuprofeno?. https://www.dosfarma.com/blog/para-que-sirve-el-ibuprofeno/ Consultado el 20/01/2023.
- Díaz Prado, S., Gallego Guadalupe, A., López-Cedrún, J.L., Ferreras Granado, J., & Antón Aparicio, L. (2009). La ciclooxigenasa-2 (COX-2) y el factor de crecimiento epidérmico (EFG) en lesiones epiteliales orales premalignas. Revista Española de Cirugía Oral y Maxilofacial, 31(3), 170-181.
- Fitzpatrick F. A. (2004). Cyclooxygenase enzymes: regulation and function. Current pharmaceutical design, 10(6), 577–588.
- Galán Martínez, L., Osorio Acevedo, A., López Medina, A. I., Álvarez Collazo, J., & Álvarez, J. L. (2010). Acciones cardiovasculares del ibuprofeno. Revista Cubana de Investigaciones Biomédicas, 29(3), 331-338.
- García Meijide, J. A., & Gómez-Reino Carnota, J. J. (2000). Fisiopatología de la ciclooxigenasa-1 y ciclooxigenasa-2. Rev Esp Reumatol, 27(1), 33-5.
- Lagos Quezada, D. V., Morales Reyes, M. J., Sánchez Hernández, S. A., Nieto Durón, C. A., Lanza Euceda, E. A., Donaire Núnez, J. C., García Ramírez, L. F., & Andrade Avila, L. A. (2019). Reacciones sistémicas causadas por la toxicidad del diclofenaco. Revista Científica De La Escuela Universitaria De Las Ciencias De La Salud, 5(1), 41–49.
- Martínez-Canabal A, Rivas-Arancibia S. Funciones de las prostaglandinas en el sistema nervioso central. Rev Fac Med UNAM. 2005;48(5):210-216.
- Meneses, L., Pilaquinga, M. F., & Cuesta, S. (2014). Modelamiento molecular de la interacción de ibuprofeno con las enzimas Ciclooxigenasa 1, 2 y el Citocromo P450 2C9. Revista Ecuatoriana de Medicina y Ciencias Biológicas, 35(1-2), 21-29.
- Molecular graphics and analyses performed with UCSF ChimeraX, developed by the Resource for Biocomputing, Visualization, and Informatics at the University of California, San Francisco, with support from National Institutes of Health R01-GM129325 and the Office of Cyber Infrastructure and Computational Biology, National Institute of Allergy and Infectious Diseases. UCSF ChimeraX: Structure visualization for researchers, educators, and developers. Pettersen EF, Goddard TD, Huang CC, Meng EC, Couch GS, Croll TI, Morris JH, Ferrin TE. Protein Sci. 2021 Jan;30(1):70-82.
- Monga, K. AINE (Medicamentos Antiinflamatorios No Esteroides), https://www.rheumatology.org/I-Am-A/Patient-Caregiver/Tratamientos/AINEs . Consultado el 29/01/2023.
- Moro, M. G., Sanchez, P. K. V., Lupepsa, A. C., Baller, E. M., & Franco, G. C. N. (2017). Biología de la ciclooxigenasa en la función renal–Revisión de la literatura. Revista Colombiana de Nefrología, 4(1), 27-37.
- Oscanoa-Espinoza, T., & Lizaraso-Soto, F. (2015). Antiinflamatorios no esteroides: seguridad gastrointestinal, cardiovascular y renal. Revista de Gastroenterología del Perú, 35(1), 63-71.
- Rouzer, C. A., & Marnett, L. J. (2009). Cyclooxygenases: structural and functional insights. Journal of lipid research, 50, S29-S34.
- Sebastián, S., Vela, C., & Meneses, L. (2017). Modelación molecular de la interacción del paracetamol y el 4-aminofenol con las enzimas Ciclooxigenasa 1 y 2. Revista Ecuatoriana de Medicina y Ciencias Biológicas: REMCB, 38(2), 97-105.