EL ESCORPIÓN AZUL: ESPERANZA EN LA LUCHA CONTRA EL CÁNCER
Susana Priego Gutiérrez y Lorena Sánchez Alfonso, 3º de Biología Sanitaria, Universidad de Alcalá (UAH)
1. INTRODUCCIÓN
Cuando se habla de venenos, probablemente, lo primero que se le viene a uno a la cabeza es la palabra muerte; no pensamos en ningún momento que un veneno pueda ser a su vez, sinónimo de vida. Sin embargo, es posible que dentro de unos cuantos años, los venenos se relacionen con esta segunda palabra.
Existe la posibilidad de que en ellos se encuentre la clave para la cura de distintas enfermedades, entre ellas, una que está muy presente en nuestro día a día, el cáncer. Esta entrada contiene las razones por las cuales el veneno de Rhodapalurus junceus es un potencial anticancerígeno.
2. DESCRIPCIÓN DE RHODAPALURUS JUNCEUS
Antes de hablar del veneno, conviene dedicar parte de esta entrada a este arácnido tan interesante. Rhodapalurus junceus es un escorpión que pertenece a la familia Buthidae y, dentro de esta familia, se incluyen a las especies más peligrosas de escorpiones. Este escorpión es conocido comúnmente con el nombre de “Escorpión azul” o «Alacrán colorado«.
La distribución geográfica de esta especie no es muy amplia, ya que se encuentra solamente en el archipiélago cubano. Sin embargo, dentro de este endemismo no tiene problema en qué tipo de hábitat vivir, ya que pueden habitar desde cualquier tipo de bosque, zonas áridas hasta incluso zonas pantanosas, como ciénagas.
Por otro lado, esta especie tiene la suerte de no figurar en el menú de muchas otras, solo algún sapo o alguna serpiente concreta disfrutan de este escorpión como manjar. Además, se conocen casos de canibalismo; de hecho, se cree que su mayor depredador es otro individuo de su misma especie.
Existen diferencias genómicas entre poblaciones de escorpiones de esta especie; pudiendo encontrar diferentes patrones cromáticos: amarillos, colorados y negros. Debido a este último fenotipo es por lo que se le conoce con el nombre de «Escorpión azul».


(Imagen de Teruel R, de Armas LF.)
Estas variaciones en su material genético no solo están directamente relacionadas con su apariencia, sino que también afectan a los péptidos que forman parte del veneno. Existen diferencias intraespecíficas entre los péptidos del veneno de escorpiones de la misma especie. Podríamos pensar que, al ser la misma especie, la composición del veneno debería ser la misma. Sin embargo, este hecho no es nada raro en la naturaleza, basta con observarnos a nosotros mismos, los humanos. Todos somos la misma especie, pero nadie es exactamente igual a nadie (a excepción de los gemelos claro).
Es muy probable que estas diferencias genéticas sean un factor clave en las propiedades anticancerígenas del veneno, ya que su mecanismo de acción radica en los componentes de este. ¿Se encontrará algún día el escorpión azul cuyo veneno tenga los mejores componentes anticancerígenos? Para descubrirlo, primero hay que saber cuáles son estos componentes y cómo actúan, así que vamos a ello.
3. COMPOSICIÓN DEL VENENO
El veneno de este escorpión es una mezcla de varias sustancias activas y en su forma soluble, se conocen al menos 50 componentes, que incluyen enzimas, péptidos, nucleótidos y otras sustancias desconocidas.
ENZIMAS
Las enzimas son un tipo de proteínas que catalizan distintos tipos de reacciones químicas. Se sabe que estas son un componente fundamental en el veneno de distintos animales.
Una de las enzimas que aparece frecuentemente en los venenos es la PLA2 o fosfolipasa A2. Esta enzima destruye los fosfolípidos, causando la liberación del ácido araquidónico de las membranas celulares atacadas por el veneno. Uno de los efectos directos de esta liberación es provocar una respuesta inflamatoria y dolorosa. Sin embargo, el veneno soluble del escorpión azul carece de esta actividad PLA2.
Asimismo, este veneno tampoco posee actividad proteolítica, es decir, no tiene actividad degradadora de proteínas. Las proteínas que forman parte de todos y cada uno de los organismos poseen una función determinada e importante, la ausencia de enzimas proteolíticas tiene como resultado el mantenimiento de estas funciones, ya que las proteínas no van a ser degradadas por la acción del veneno.
Hemos comenzado diciendo qué enzimas NO TIENE el veneno porque la ausencia de estas probablemente esté relacionada con su baja toxicidad, así como con su potencial anticancerígeno.
Sin embargo, sí que se ha identificado una enzima en el veneno de R. junceus, y esta es la hialuronidasa, encargada de destruir el ácido hialurónico. La destrucción del ácido hialurónico tiene como consecuencia una mayor diseminación del veneno por el torrente sanguíneo y también daña el tejido conjuntivo que rodea la zona de la picadura. Pero esta enzima en la picadura tan solo se manifiesta como dolor o molestia local, habones y enrojecimiento no más que la de una abeja.
PÉPTIDOS
Un péptido es una molécula formada por la unión de dos o más aminoácidos, que cumple funciones muy importantes dentro de las células. Por ejemplo, existen hormonas peptídicas, neurotransmisores peptídicos, o incluso, pueden actuar como antibióticos.
En el veneno del escorpión azul se han descrito distintos péptidos, y algunos de ellos son letales para los saltamontes, pero no lo son para los mamíferos. Estos péptidos se clasifican en:
- Péptidos de cadena pequeña (20 a 43 aa), que son normalmente los que bloquean los canales K+.
- Péptidos de cadena larga (58 a 76 aa), que modifican los canales de Na+.
Algunos de estos péptidos han sido aislados, y tanto su peso molecular como su secuencia de aminoácidos N-terminal, han sido determinados. Sin embargo, otros péptidos todavía no han sido secuenciados. La figura de abajo muestra la secuencia de aminoácidos de cuatro péptidos componentes del veneno. Las letras hacen referencia al aminoácido en concreto, por ejemplo, K es el aminoácido lisina y A es la alanina. Si comparamos la secuencia aminoacídica de estos cuatro péptidos, veremos que apenas hay diferencias entre entre sus aminoácidos.
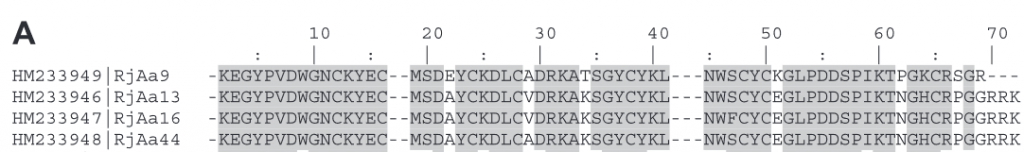
Se sabe que el péptido que aparece en mayor proporción en el veneno (25% del total), es el péptido de cadena larga RjAa12f, que fue completamente secuenciado. Contiene 64 residuos de aminoácidos y 4 puentes disulfuro, y es similar a las toxinas de otros escorpiones.
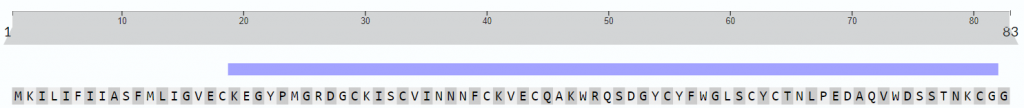
Se hipotetiza que el péptido posee una estructura formada por dos hélices alfa y por dos láminas beta.
4. MECANISMO DE ACCIÓN Y USO ANTICANCERÍGENO
CARACTERÍSTICAS DEL CÁNCER
Una neoplasia o tumor es una patología de etiología genética que se caracteriza por la presencia de un tipo de células que tienen un fenotipo diferente al de las células del tejido del que proceden. Las
células tumorales han perdido la regulación de la división celular y escapan de la muerte celular.
Además, en 2011, Douglas Hanahan y Robert A. Weinberg resumieron todas las características del cáncer, y estas pueden ser observadas en la siguiente imagen:
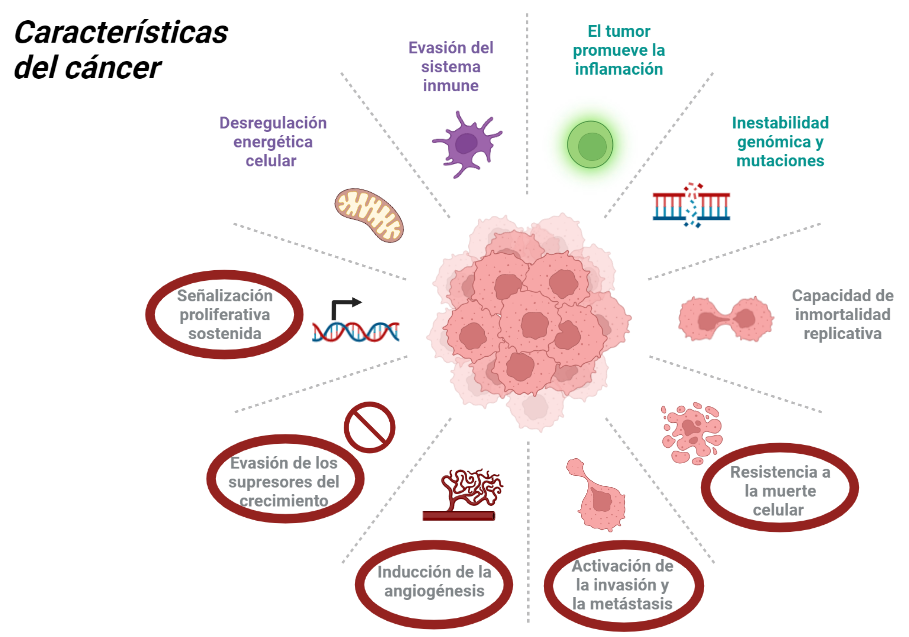
En realidad, todas estas características están interrelacionadas, sin embargo, las que aparecen redondeadas de color rojo son sobre las que va a actuar directamente el veneno del R. junceus. El fundamento del mecanismo de acción de este veneno es la destrucción de las células cancerígenas. Destruye estas células debido a que actúa sobre las vías de transducción que permiten su supervivencia, acabando así con su resistencia a la muerte celular. Además, actúa sobre p53, que es un gen supresor de tumores, y parece ser que también actúa inhibiendo la angiogénesis, reduciendo así la invasión tisular.
MECANISMO DE ACCIÓN DEL VENENO
Es cierto que no se conoce qué compuesto exacto del veneno es el que tiene capacidad antitumoral, pero distintos estudios in vitro han demostrado que el veneno de Rhodapalurus junceus es citotóxico frente a líneas celulares cancerígenas epiteliales (carcinomas y adenocarcinomas). Por el contrario, parece ser que no afecta a cánceres hematopoyéticos ni a las células sanas. In vitro ha demostrado tener un gran potencial anticancerígeno contra carcinomas de útero, de mama o pulmonar, sin dañar a las células sanas, por lo que podría ser buena alternativa a las quimioterapias actuales las cuales tienen gran cantidad de efectos adversos.
La visualización histológica de los tumores estudiados en modelos animales resaltó cómo el veneno de este escorpión inducía necrosis u apoptosis en comparación con el tejido control.
El mecanismo de acción del veneno del Rhopalurus junceus sobre las células tumorales se resume en:
- Activación de la vía apoptótica mitocondrial (intrínseca), con el incremento de la expresión de p53 y el incremento del radio bax-BCL-2.
- Activación de la vía necrótica, con la disminución de la expresión de p53 y el aumento de BCL-2.
- El bloqueo de la acción de los canales de Na+, K+ y Cl–.
- Reducción de la expresión de CD31 y Ki-67, que median la neo-angiogénesis.
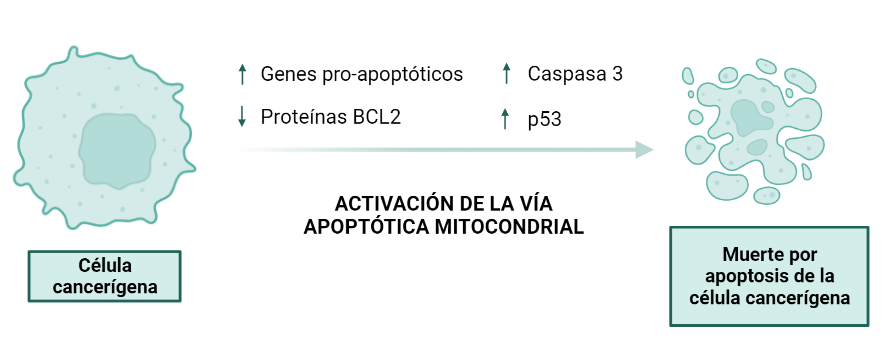
Activación de la vía apoptótica mitocondrial:
La apoptosis se define como muerte celular programada. Es decir, nuestras células están destinadas a morirse, no son inmortales. Una de las características más importantes de las células tumorales es que escapan de la apoptosis, y es por eso que se convierten en células inmortales. La apoptosis se encuentra favorecida por genes y proteínas pro-apoptóticas, mientras que se encuentra inhibida por genes y proteínas anti-apoptóticas. Parece ser, que uno de los lugares de acción del veneno del escorpión azul se encuentra sobre la vía intrínseca de la apoptosis, así que vamos a verlo más en detalle.
Cuando se tratan líneas celulares de cáncer de cuello uterino y de mama con el veneno de Rhopalurus junceus, se observa un incremento de la expresión de genes pro-apoptóticos. Se observa un incremento en el mecanismo de acción encargado de la regulación positiva de Bax (gen pro-apoptótico), de p53 y de la caspasa 3, así como la regulación negativa de BCL-2.
La regulación negativa los genes BCL-2 tiene como resultado la regulación positiva de p53, ya que las proteínas BCL-2 son anti-apoptóticas mientras que p53 favorece la vía mitocondrial de apoptosis, en la que están implicadas proteínas pro-apoptóticas. Estas proteínas están implicadas en vías de transducción que tienen como resultado la liberación del citocromo c y la activación de la cascada de caspasas. La consecuencia final de esta vía es la formación de cuerpos apoptóticos; es decir, la muerte de la célula tumoral.
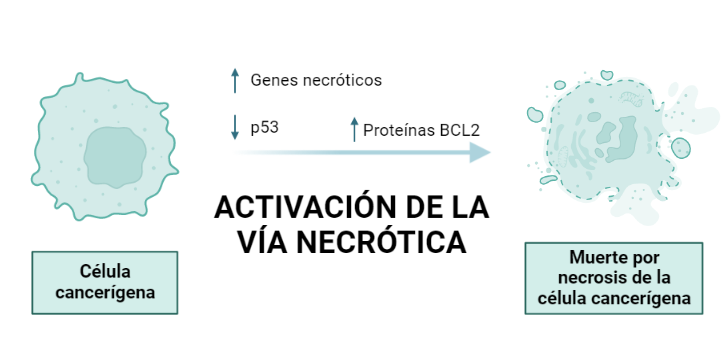
Activación de la vía necrótica:
La necrosis es otro tipo de muerte celular caracterizada por el hinchamiento celular y la ruptura de las membranas celulares y de los orgánulos.
Se ha observado que en el carcinoma de pulmón tras el tratamiento con el veneno de R. junceus se reduce la expresión de p53 y por el contrario, la expresión de BCL-2 aumenta. Distintos estudios han mostrado que BCL-2 no solo es un mediador de la apoptosis, sino que también lo es de la necrosis programada, por lo tanto, el aumento de BCL-2 activaría la expresión de los genes necróticos así como la vía necrótica en este tipo de cáncer.
Es decir, el veneno es capaz de inducir una vía u otra de muerte celular según el tipo de célula cancerosa que se trate. Esta propiedad no es exclusiva del veneno de R. junceus, sino que se ha observado en distintas especies de escorpiones.
Bloqueo de los canales de Na+, K+ y Cl-:
Nuestras células poseen canales iónicos, que son proteínas que permiten el paso de iones específicos a través de las membranas celulares.
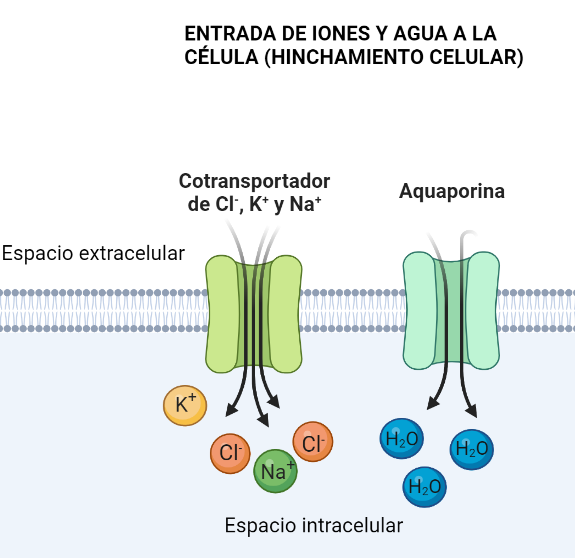
Se sabe que la interacción de estos canales es fundamental en el proceso de cambio en el volumen y forma de las células tumorales. De hecho, este es el mecanismo de invasión en algunos tumores como el glioma (en el cerebro). Para migrar, las células deben agrandarse y encogerse, deben encogerse porque los espacios intercelulares son muy pequeños.
Para agrandarse, deben conseguir que entre agua en las células. Para ello, deben entrar primero iones de Cl–, K+ y Na+ por canales iónicos, como el cotransportador NKCC1, ya que si aumenta su concentración intracelular, el agua entrará también para igualar el equilibrio osmótico. De esta manera, la célula se agranda.
Para encogerse, deben eliminar agua. Esto se consigue por el aumento del flujo de iones de Cl– y de K+ al exterior celular. Como hay gran cantidad de iones en el exterior, el agua tiende a salir para igualar el equilibrio osmótico, quedando así la célula encogida. Sin embargo, para que estos iones salgan, sus respectivos canales iónicos deben ser activados por Ca2+, por lo que existen canales iónicos que introducen Ca2+ en el interior celular, incrementando la concentración de este ion y promoviendo la salida de Cl– y K+, y consecuentemente, la salida de agua.
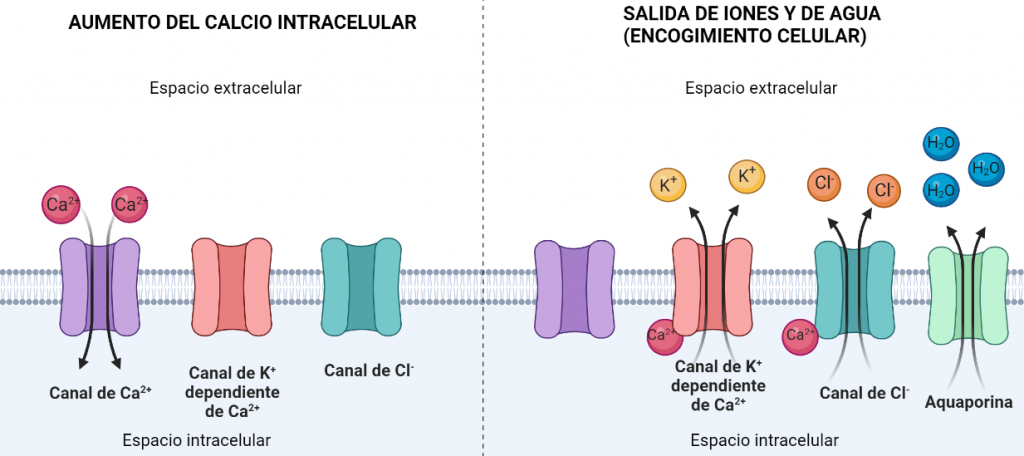
Algunos componentes del veneno, actúan bloqueando los canales de Na+, de K+ y de Cl–. Como consecuencia, se produce una reducción en la capacidad de la variación de la forma y el volumen (la célula ya no se hincha porque no entra agua) y, por lo tanto, se produce una disminución de la invasión tisular por parte de las células cancerígenas.
Reducción de la expresión de CD31 y KI-67:
Los tumores malignos, al crecer, segregan unas sustancias que favorecen la ramificación de los vasos sanguíneos de su alrededor, este proceso es conocido como angiogénesis tumoral.
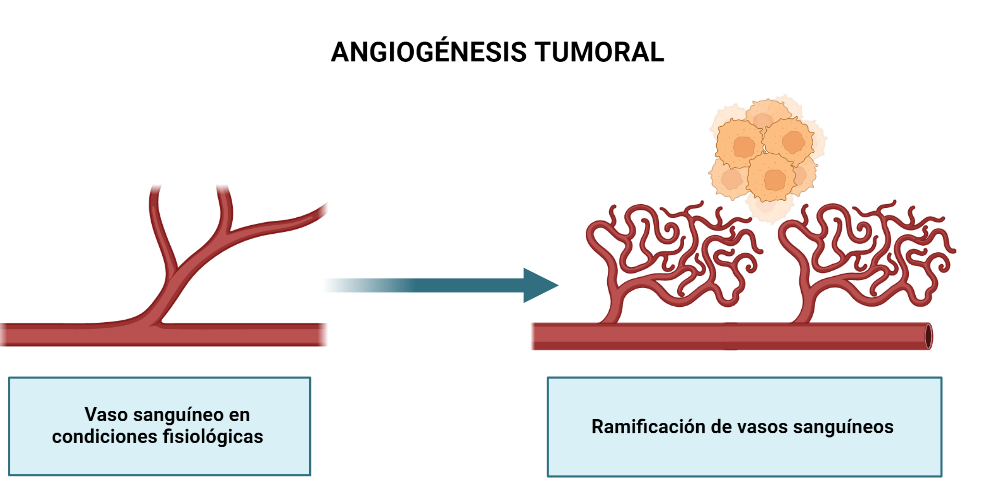
CD31, también conocida como PECAM-1 o EndoCAM, es un miembro de la superfamilia de genes de las inmunoglobulinas (Ig). La función de esta molécula es de adhesión, es capaz de adherirse a muchos tipos celulares, como plaquetas, células epiteliales, endoteliales, monocitos, linfocitos… CD31 es un marcador altamente específico y sensible para las células endoteliales vasculares y debido a ello, es un marcador de la neo-angiogénesis.
Ki-67 es una proteína nuclear (no histónica) que se expresa en las células durante las fases activas del ciclo celular (G1, S, G2 y M), mientras que está ausente en células en reposo (G0). Ki-67 es un biomarcador del índice de proliferación celular, que se emplea para medir la fracción de crecimiento en las neoplasias malignas. La concentración de Ki-67 se puede expresar en porcentaje, y cuanto mayor sea este, a mayor velocidad crece el tumor en un período de tiempo concreto.
El veneno del escorpión azul llevó a la reducción de la expresión de ki-67 y CD31, y, como resultado, la disminución de la angiogénesis tumoral.
5. CONCLUSIÓN
En conclusión, el veneno de R. junceus actúa a varios niveles sobre las células tumorales. Asimismo, su mecanismo de acción difiere en función del tipo de cáncer.
El objetivo principal de los investigadores es dar con el escorpión cuyo veneno posea la combinación perfecta para el tratamiento del cáncer: citotóxico para todos los tipos de célula cancerígena; compatible con la viabilidad de las células sanas y con el menor número de efectos secundarios posibles.
BIBLIOGRAFÍA
Diaz-Garcia, A.; Morier-Diaz, L.; Frion-Herrera, Y.; Rodriguez-Sanchez, H.; Caballero-Lorenzo, Y.; Mendoza-Llanes, D.; Riquenes-Garlobo, Y.; Fraga-Castro, J.A. In vitro anticancer effect of venom from Cuban scorpion Rhopalurus junceus against a panel of human cancer cell lines. J. Venom. Res. 4, 5–12 (2013).
Díaz-García, A. et al. Enzymatic analysis of venom from Cuban scorpion Rhopalurus junceus. J Venom Res 6, 11–18 (2015).
Diaz-Garcia, A.; Ruiz-Fuentes, J.L.; Rodriguez-Sanchez, H.; Fraga Castro, J.A. Rhopalurus junceus scorpion venom induces apoptosis in the triple negative human breast cancer cell line MDA-MB-231. J. Venom. Res. 8, 9–13 (2017).
Dioguardi, M. et al. Therapeutic Anticancer Uses of the Active Principles of ‘Rhopalurus junceus’ Venom. Biomedicines 8, 382 (2020).
García García, V., González-Moles, M. & Bascones Martínez, A. Expresión de bcl-2, ki-67 y caspasa-3 en lesiones cancerosas de la mucosa oral: Resultados preliminares. Av Odontoestomatol 22, (2006)
Garcia-Gomez, B. I., Coronas, F. I. V., Restano-Cassulini, R., Rodriguez, R. R. & Possani, L. D. Biochemical and molecular characterization of the venom from the Cuban scorpion Rhopalurus junceus. Toxicon 58, 18–27 (2011).
Hanahan, D. & Weinberg, R. A. Hallmarks of Cancer: The Next Generation. Cell 144, 646–674 (2011)
Rodriguez-Ravelo, R. et al. Variation of cytochrome oxidase-I gene and venom proteins of Rhopalurus junceus populations in the Moanicum sector: Pharmacological implications. J. Pharm. Pharmacogn. Res. 9, 1–12 (2021).
Teruel R, de Armas LF. Redescripción de Rhopalurus junceus (Herbst 1800)(Scorpiones: Buthidae). Bol Soc Entomológica Aragon; 50:153-74 (2012).
Turner, K. L. & Sontheimer, H. Cl − and K + channels and their role in primary brain tumour biology. Phil. Trans. R. Soc. B 369, 20130095 (2014).
Zehnder, J. et al. Involvement of CD31 in lymphocyte-mediated immune responses: importance of the membrane-proximal immunoglobulin domain and identification of an inhibiting CD31 peptide. Blood 85, 1282–1288 (1995).
Dicciomed: https://dicciomed.usal.es/palabra/peptido
Ki-67: https://enfermera.io/ki-67/
Uniprot: https://www.uniprot.org/uniprotkb/E7CLP2/entry
Venenos, el arma bioquímica. El caso de la avispa esmeralda: https://chemevol.web.uah.es/wp/venenos-el-arma-bioquimica-el-caso-de-la-avispa-esmeralda/