El grupo hemo y la electricidad de las bacterias
C. Menor-Salván. Ver 1.0 Enero 2022.
La vida no se puede entender sin la interacción con los minerales. Desde el inicio de la vida, los organismos procarióticos han interaccionado con diversos minerales, utilizándolos como fuente de energía (es decir, como fuente de electrones, oxidándolos) y como aceptores de electrones en el proceso de respiración. Nosotros, los organismos aerobios, respiramos oxígeno; es decir, el oxígeno es el aceptor final de electrones en todo el proceso de generación de energía celular: partiendo de la glucosa como nutriente metabólico esencial, ésta cede sus electrones (generando CO2) hacia el oxígeno.
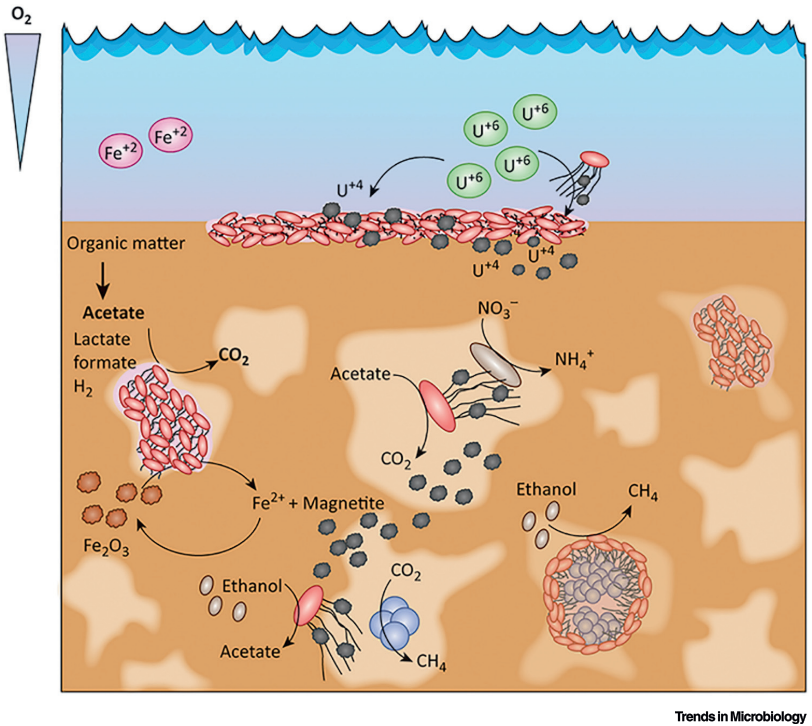
Muchos organismos anaerobios, es decir, organismos que no utilizan oxígeno como aceptor de electrones, requieren una serie de minerales para ‘cerrar el circuito’ de la producción de energía. El papel de estos organismos en la Naturaleza es enorme, pues están implicados en los ciclos geoquímicos del hierro y del azufre en sedimentos y entornos anaerobios. Bacterias como Geobacter son capaces de reducir minerales de óxido de hierro (como hematites o goethita) produciendo magnetita y siderita. También son esenciales en la geoquímica del uranio, pues reducen el uranio móvil (sales de uranilo) a minerales mas reducidos de uranio, como uraninita. Muchos depósitos de uraninita y coffinita sedimentaria han sido generados por la actividad de bacterias que utilizan sales oxidadas como aceptor de electrones.

Bacterias como Geobacter usan el mineral como aceptor o sumidero de electrones, utilizando la materia orgánica como fuente de energía. Pueden consumir cualquier tipo de materia orgánica como donadora de electrones. Pero, ¿como transfieren los electrones al mineral?. Aquí es donde la versatilidad funcional y estructural de las proteínas adquiere tintes de ciencia ficción: utilizando nanocables o mejor, nanofilamentos conductores de la electricidad.
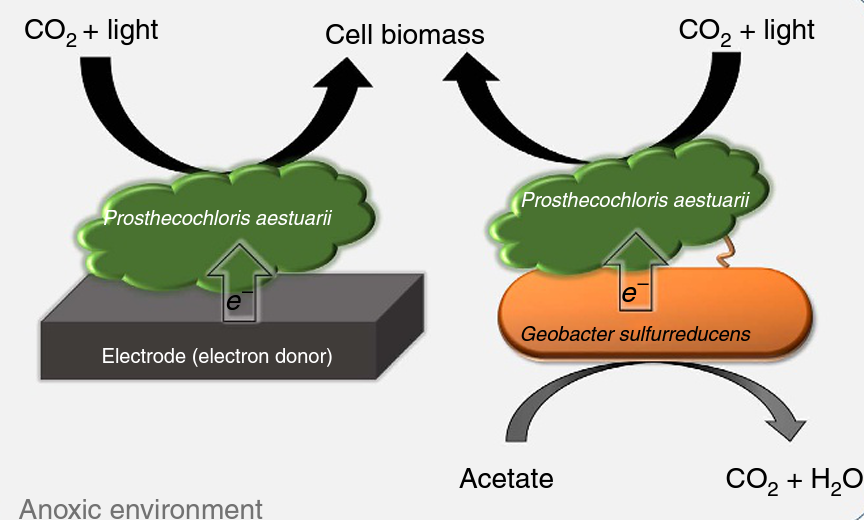
Las bacterias del género Geobacter utilizan los nanocables no sólo para modificar los minerales, sino también para conectarse eléctricamente con otras bacterias, a veces creando relaciones simbióticas, como la que se da entre Geobacter sulforreducens y el organismo fotosintético anaerobio Prosthecochloris aestuarii
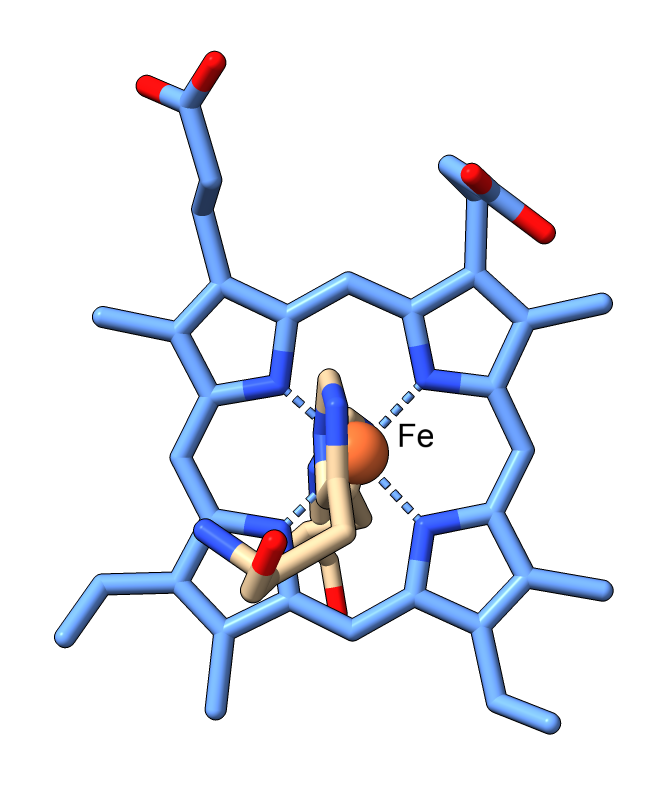
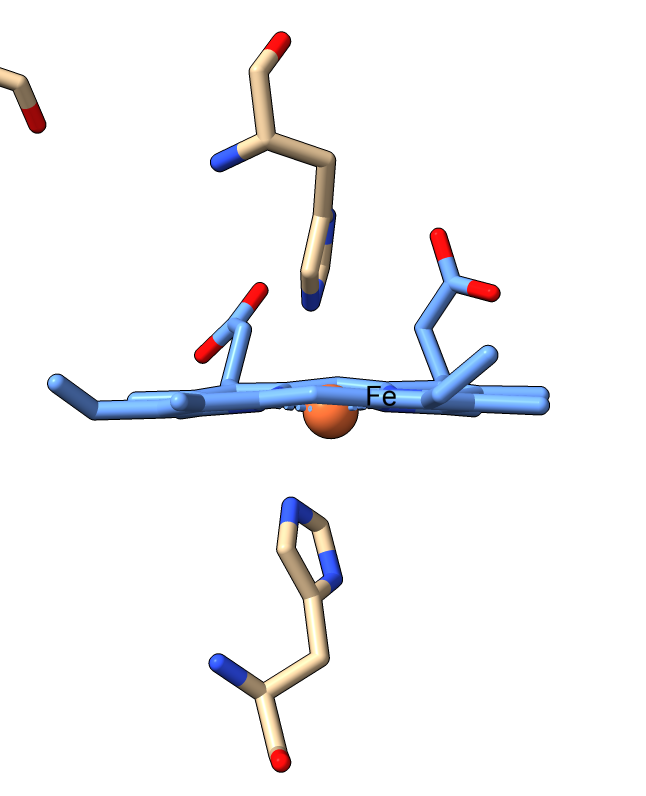
Pero, ¿En qué consisten los nanocables que utilizan las bacterias para transferir electrones?. Son cadenas de un tipo de citocromo c. El citocromo c es una proteína pequeña, esencial en los procesos redox de todas las células. En bacterias como Geobacter, el citrocromo c se encadena formando pequeños filamentos:

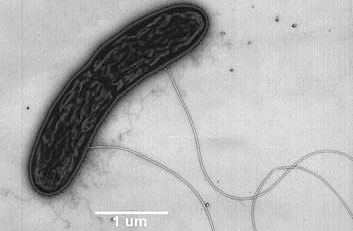
La clave de la conducción de electricidad es que el nanofilamento de citocromo tiene muchos grupos hemo situados a corta distancia (menos de 4 angstroms), de modo que los electrones van saltando de átomo de hierro en átomo de hierro, hasta liberarse en el mineral, que actúa como electrodo.
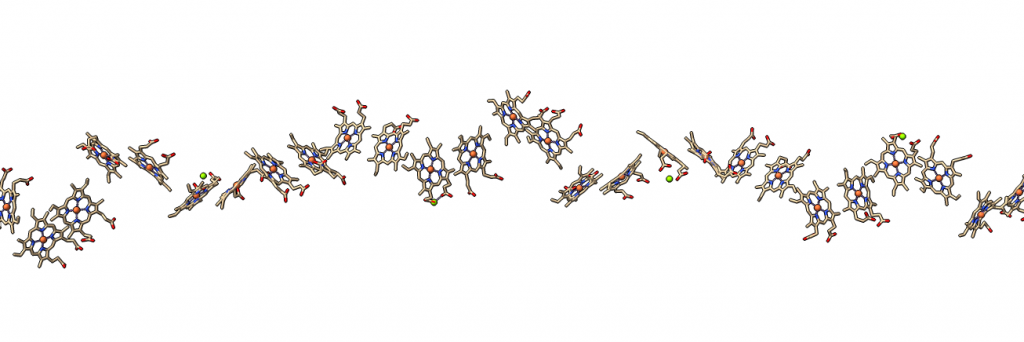

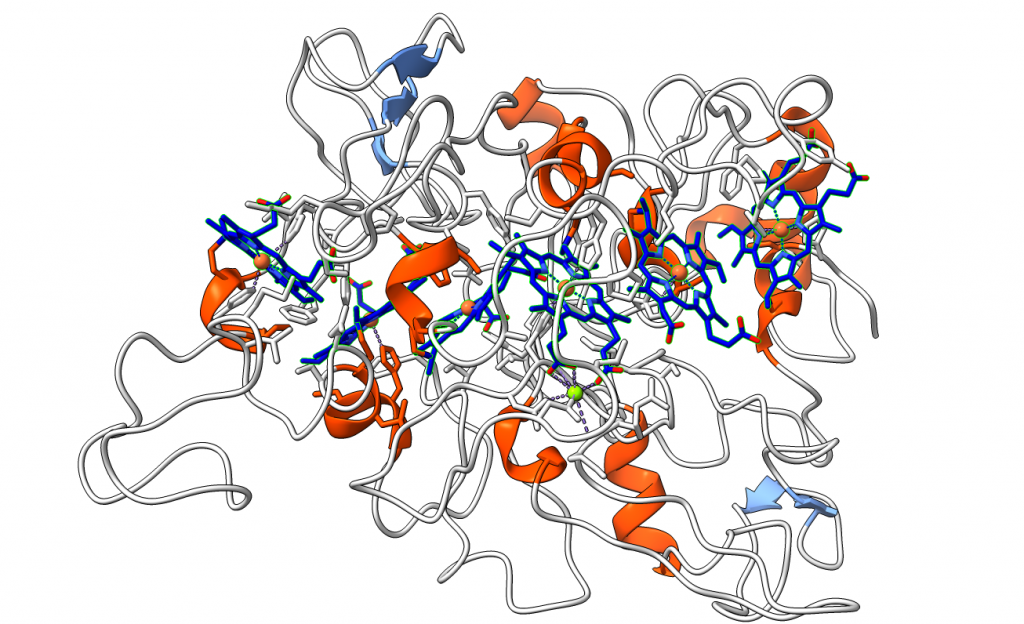
Los nanofilamentos bacterianos se pueden acoplar con electrodos sintéticos, con lo que este tipo de bacterias tienen un gran potencial como ‘baterías’: a partir del consumo de materia orgánica en condiciones aerobias (como por ejemplo, materia orgánica de aguas residuales) podría producir electricidad. Además, estos nanofilamentos podrían tener aplicaciones biotecnológicas como conectores de nanoelectrodos en bioelectrónica.
Referencias
Filman, D. J., Marino, S. F., Ward, J. E., Yang, L., Mester, Z., Bullitt, E., Lovley, D. R. & Strauss, M. (2019) ‘Cryo-EM reveals the structural basis of long-range electron transport in a cytochrome-based bacterial nanowire’, Communications Biology, 2(1), pp. 19–24. doi: 10.1038/s42003-019-0448-9.
Ha, P. T., Lindemann, S. R., Shi, L., Dohnalkova, A. C., Fredrickson, J. K., Madigan, M. T. & Beyenal, H. (2017) ‘Syntrophic anaerobic photosynthesis via direct interspecies electron transfer’, Nature Communications, 8, pp. 1–7. doi: 10.1038/ncomms13924.
Tabares, M., Dulay, H. & Reguera, G. (2020) ‘Geobacter sulfurreducens’, Trends in Microbiology, 28(4), pp. 327–328. doi: 10.1016/j.tim.2019.11.004.