El poder de Magneto y la sorprendente relación entre el magnetismo y la respiración
Por C. Menor-Salván. Nov. 2023
En una de las películas de Marvel sobre la ‘Patrulla X’ (no recuerdo cual), el gran antagonista, Magneto, escapa de una prisión usando sus poderes magnéticos con el hierro de la sangre de su víctima.

Pero, ¿podría Magneto haber hecho esto realmente? (asumiendo que es capaz de generar un campo magnético tan grande).
Un cuerpo humano promedio contiene unos 4 a 6 gramos de hierro. La mayor parte (2 a 4 gramos) se encuentra en la sangre, en forma del complejo hierro-protoporfirina IX, el grupo hemo, unido a hemoglobina. El resto se distribuye en forma de varias proteínas, como mioglobina, ferritina, hemosiderina y complejos de hierro con múltiples proteínas. En cualquier caso, es poca cantidad. Teniendo en cuenta la densidad del hierro, Magneto no podría haber obtenido las esferas de metal que se ven en la escena, que suponen al menos 10 veces más masa. Aparte de eso, ¿podría haber atraído el hierro contenido en el cuerpo de la víctima de esa forma? Spoiler: no.
Propiedades magnéticas de la materia
La materia tiene varias clases de magnetismo, esto es, el modo en que responden a la presencia de un campo magnético. Las principales (no las únicas) son:
- Paramagnetismo: Son atraídas por un campo magnético con una fuerza proporcional al campo, pero esta fuerza es, generalmente, débil y sólo puede medirse usando instrumentación o detectarse usando algunos «trucos» (lo veremos en un experimento). El paramagnetismo se presenta cuando una molécula presenta un momento magnético permanente, producido por al menos un electrón desapareado, que actúa como si fuera un pequeño ‘imán’. Cuando la sustancia paramagnética se somete al campo magnético, los momentos magnéticos del material se orientan. Un sustancia paramagnética tiene una susceptibilidad magnética positiva.
- Diamagnetismo: En sustancias que no tienen un momento magnético permanente, al no tener electrones desapareados. Tienen una susceptibilidad magnética negativa. Al someterse al campo, se produce un momento magnético inducido y opuesto al campo, resultando en una repulsión entre débil y muy débil. Tan solo algunas sustancias diamagnéticas manifiestan un efecto más intenso, como el bismuto o el grafito, lo que tiene aplicaciones tecnológicas importantes.
- Ferromagnetismo: Es la propiedad que observamos cuando un imán atrae un objeto de hierro. Es, también, la propiedad que se observa en Magneto en las películas de la Patrulla-X. Este tercer fenómeno se caracteriza por una susceptibilidad magnética positiva muy elevada. Cuando estas sustancias se someten a un campo magnético, los momentos magnéticos tienden a alinearse y orientarse en dominios, lo que incrementa la fuerza de atracción. Estas fuerzas son, desde comparables a la de los materiales paramagnéticos hasta ¡8 órdenes de magnitud superiores!. Los dominios y la magnetización de la sustancia depende de la estructura cristalina. Por ello el ferromagnetismo se da en materiales sólidos cristalinos como el hierro metálico o la magnetita. El ferromagnetismo depende de las estructuras cristalinas de los sólidos, por lo que, controlándolas, podemos fabricar aleaciones de hierro o aceros con ferromagnetismo débil. Entonces, la famosa escena en la que Magneto fabrica una bola de hierro usando el cuerpo de un guardia, es de todo punto imposible, sea cual sea el campo, ya que la mayor parte del hierro en el cuerpo humano se encuentra en forma de complejos diamagnéticos. Pero no todo. Por ejemplo, en la sangre, parte de la hemoglobina es paramagnética y parte diamagnética. Y ahí esta la clave de la respiración.
Magnetismo y hemoglobina: El experimento
En 1845, Michael Faraday se llevó una curiosa sorpresa: contrariamente a lo que él esperaba, la hemoglobina, que fue aislada en 1840 y se descubrió que contenía hierro, no era magnética, al contrario que el hierro metálico y otros compuestos de hierro.
Un siglo después, en 1936, el gran químico Linus Pauling y su colaborador Charles Coryell realizaron un experimento fundamental, que abrió todo un nuevo campo de investigación: la química bioinorgánica. Este experimento y todo el trabajo posterior, en especial los trabajos de Max Perutz, J. Lynn Hoard y J.J. Weiss, permitieron entender el origen del alosterismo de la hemoglobina y su relación con las propiedades magnéticas del grupo hemo.
Gracias a los modernos y potentes imanes de neodimio, podemos reproducir de modo muy sencillo los experimentos de Pauling y Coryell, simplemente usando un imán y una balanza analítica. Con este montaje, podemos detectar las débiles fuerzas atractivas o repulsivas provocadas por el paramagnetismo o diagmagnetismo de diferentes compuestos químicos.
A diferencia del ferromagnetismo, para detectar un material paramagnético, necesitamos un campo magnético potente, como el creado por un imán de neodimio. El imán se pone sobre un soporte (en este caso, totalmente improvisado) en la balanza. Lo hemos ubicado a cierta distancia, para que el campo magnético no perturbe el circuito de la balanza. Este montaje es una versión muy sencilla de la balanza de Gouy e incluso nos podría permitir medir la susceptibilidad magnética del material.
Al acercar (sin tocar) la muestra al imán, si la sustancia es paramagnética, la débil fuerza de atracción reducirá el peso aparente del imán, apareciendo una medida negativa. Si la sustancia es diamagnética, el momento magnético inducido por el imán creará una débil repulsión que aumentará levemente el peso aparente del imán. El efecto a veces es muy débil, por ello usamos una balanza que pueda medir hasta décimas de miligramo.
El resultado del video es que:
- La oxihemoglobina es diamagnética. Si elimináramos el oxígeno de la hemoglobina, esta cambiaría a paramagnética.
- La metahemoglobina (el hierro se ha oxidado) o la hemina, el complejo hemo-Fe(III), es paramagnética
- El complejo ferricianuro, que contiene electrones desapareados, es un control de paramagnetismo
- El complejo ferrocianuro, que no contiene electrones desapareados, es un control de diamagnetismo
- Este experimento tiene una profunda relación con el papel de la hemoglobina como transportador de oxígeno.
El magnetismo de la hemoglobina, alosterismo y transporte de oxígeno
Tras los experimentos de Pauling y Coryell se necesitaron 80 años para entender cómo se une el oxígeno al grupo hemo, las características electrónicas de los complejos hemo con diversos ligandos, y la influencia en el alosterismo de la proteína. Aún sigue siendo un problema objeto de estudio por los químicos inorgánicos, pero podemos dar unas notas simplificadas.
La idea es que al aproximarse la molécula al complejo hemo, se producen una serie de transiciones de spin de los electrones:
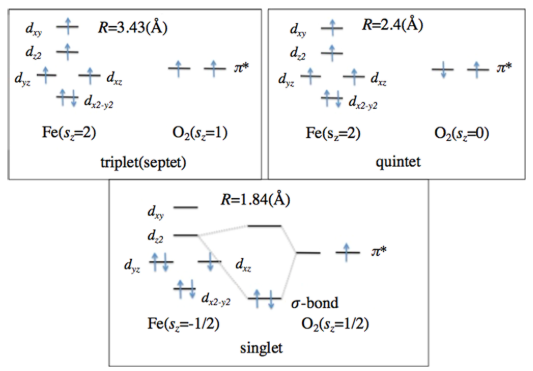
En el estado desoxihemoglobina (arriba a la izquierda), el hierro se encuentra formando un complejo hemo-Fe(II) de alto spin, con dos electrones desapareados (sz=2), paramagnético. En este estado se encuentra cuando la molécula de oxígeno está a mas de 7.21 angstroms. Al acercarse el oxígeno, se producen una serie de inversiones de spin y acoplamientos magnéticos entre el hierro y el oxígeno, que dan lugar a varios estados intermedios. Finalmente (abajo), cuando el oxígeno se ha unido al hierro, tenemos el estado de oxihemoglobina; se forma un complejo de transferencia de carga, el electrón siguado en el orbital dxy invierte su spin y se desplaza al orbital dyz de menor energía, pasando a una configuración de bajo spin. Los orbitales resultantes tienen dos electrones desapareados, con spines antiparalelos, lo que resulta en un momento magnético nulo, y el complejo pasa a ser diamagnético.
Este cambio de spines tiene una consecuencia fundamental en las distancias de la molécula.
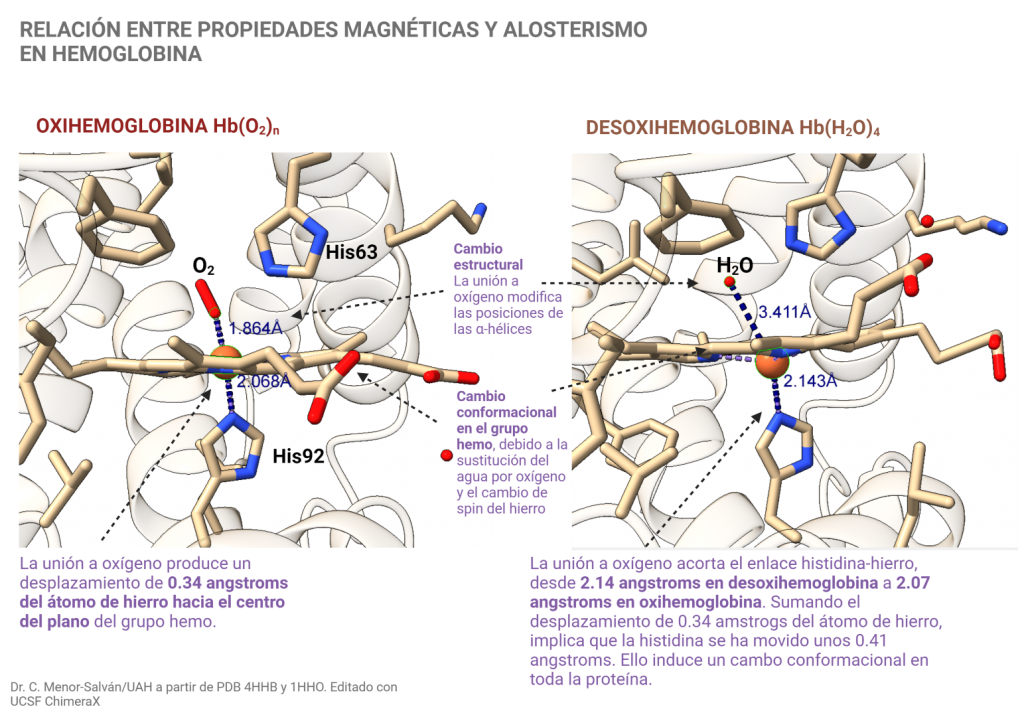
El cambio en los orbitales y el spin del complejo, con el cambio de sus características magnéticas de para a diamagnético, induce un cambio estructural en la proteína.
- Primero, el átomo de hierro se desplaza al centro del plano de la porfirina. Ello, junto con la salida del agua y la pérdida de puentes de hidrógeno que formaba ésta, provoca un cambio de conformación en el grupo hemo.
- Segundo, el cambio conformacional en el hemo provoca un desplazamiento de la histidina por el acortamiento del enlace entre el imidazol de la histidina y el átomo de hierro.
- El desplazamiento de la histidina y los cambios en las interacciones del grupo hemo con las hélices del péptido, inducidos por el cambio de conformación de éste, provocan el movimiento de toda la estructura de la subunidad proteica.
- Este movimiento modifica las subunidades proteicas que están en contacto con ella, pues la hemoglobina es una proteína tetramérica. Este movimiento induce un incremento de la afinidad del oxígeno tras la unión del primer oxígeno a la estructura. Este fenómeno de unión cooperativa, en la que la unión del primer ligando favorece la unión del siguiente debido al cambio estructural inducido, es una de las formas de alosterismo.
¿y en el caso de la metahemoglobina?
En el experimento veíamos el paramagnetismo de la hemina, un complejo de porfirina férrica obtenido a partir de hemoglobina. El hierro de la hemoglobina puede ser oxidado por diversos agentes oxidantes, que la convierten en metahemoglobina. Esto puede ocurrir en vivo, produciéndose metahemoglobinemia.
Como explico en clase, el hierro ferroso, Fe(II), tiende a oxidarse a Fe(III). Nosotros tenemos toda una batería de sistemas antioxidantes que mantienen el hierro en estado ferroso, que es el biológicamente funcional. En el caso de los eritrocitos, tenemos la enzima citocromo b5 reductasa, que se encarga de mantener la hemoglobina reducida y minimizar el contenido de metahemoglobina.
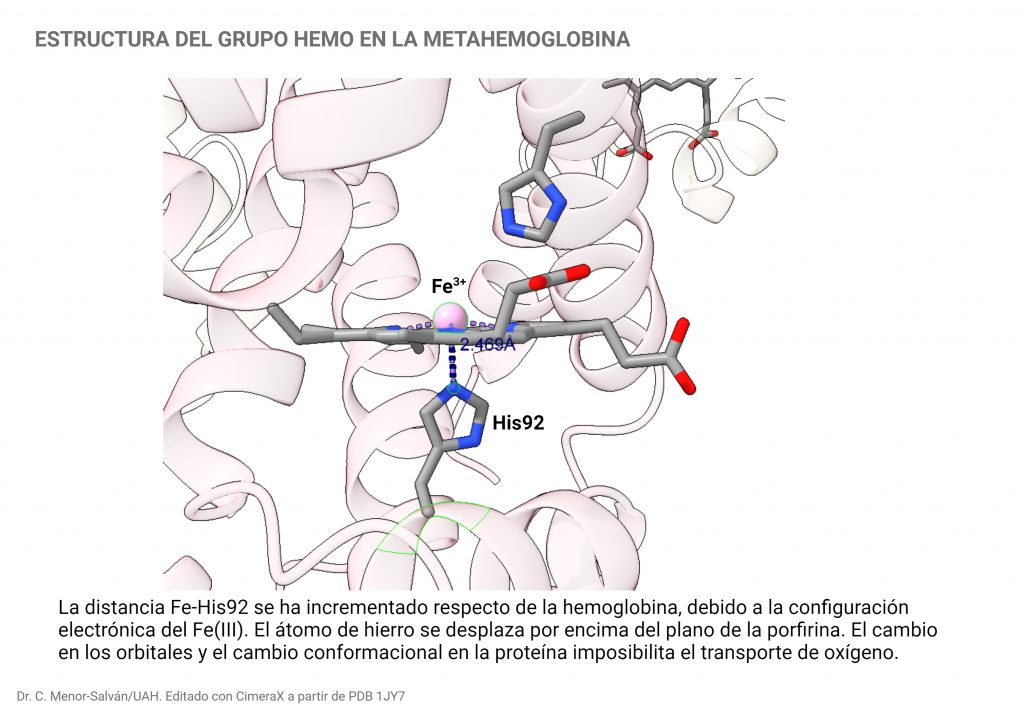
Algunos oxidantes, como los nitritos o el ferricianuro, pueden oxidar el hierro de la hemoglobina y transformarlo en metahemoglobina. La oxidación cambia la configuración electrónica y el spin del hierro. En la oxidación se pierde un electron, y el resto se reconfigura en la capa 3d, resultando que la metahemoglobina, el hierro tiene tres electrones desapareados y un comportamiento paramagnético. Este cambio induce también un cambio estructural en la proteína, que se vuelve incapaz de transportar oxígeno.
Así, aquel primer experimento de Pauling y Coryell en 1936 sentó las bases para entender cómo la hemoglobina transporta el oxígeno a los tejidos. Y, dado que la oxihemoglobina es diamagnética, Magneto no tiene ninguna posibilidad para capturar el hierro que contiene con sus poderes ferromagnéticos. ¡Si los guionistas hubieran estudiado bioquímica, el guardia de la película se habría salvado!

Referencias
Bren, K. L., Eisenberg, R. & Gray, H. B. (2015) ‘Discovery of the magnetic behavior of hemoglobin: A beginning of bioinorganic chemistry’, Proceedings of the National Academy of Sciences, 112(43), pp. 13123–13127. doi: 10.1073/pnas.1515704112.
Hensley, P., Edelstein, S. J., Wharton, D. C. & Gibson, Q. H. (1975) ‘Conformation and spin state in methemoglobin’, Journal of Biological Chemistry, 250(3), pp. 952–960.
Jensen, K. P. & Ryde, U. (2004) ‘How O2 binds to heme. Reasons for rapid binding and spin inversion’, Journal of Biological Chemistry, 279(15), pp. 14561–14569. doi: 10.1074/jbc.M314007200.
Kurokawa, D., Gueriba, J. S. & Diño, W. A. (2018) ‘Spin-Dependent O 2 Binding to Hemoglobin’, ACS Omega, 3(8), pp. 9241–9245. doi: 10.1021/acsomega.8b00879.
Scheidt, W. R. & Reed, C. A. (1981) ‘Spin-State/Stereochemical Relationships in Iron Porphyrins: Implications for the Hemoproteins’, Chemical Reviews, 81(6), pp. 543–555. doi: 10.1021/cr00046a002.