El tratamiento de la celiaquía: ¿Realidad o utopía?
Alba del Río Ropero y Noa Sánchez Gordo
¿En qué consiste la celiaquía?
La enfermedad celíaca o celiaquía, es una enteropatía que afecta en torno al 1% de la población global. Se desarrolla en individuos con predisposición genética por una respuesta autoinmune causada por la ingesta de gluten. Esta patología se manifiesta con síntomas gastrointestinales como diarrea, malabsorción intestinal, flatulencias, cólicos y dolor abdominal, pero también se ha relacionado con otras afecciones extraintestinales como dermatitis herpetiforme, cirrosis, anemia, osteoporosis, infertilidad en mujeres y alteraciones endocrinas y neurológicas. En niños, provoca retraso en el crecimiento, anorexia y pérdida de peso. (Biesiekierski, 2017)
¿Cómo se produce?
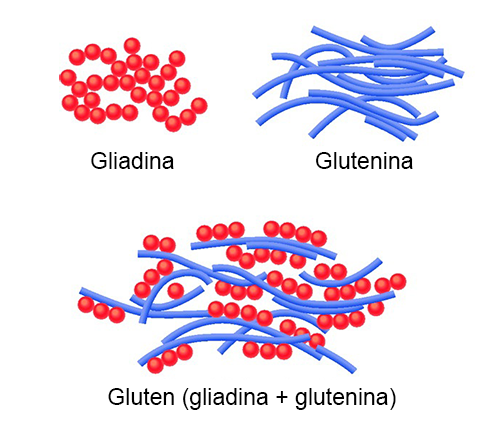
El gluten está formado por dos proteínas de reserva, gliadina y glutenina, abundantes en las semillas de cereales, especialmente trigo, centeno y cebada. Al llegar al intestino, las gliadinas se degradan con proteasas pancreáticas, dando lugar a péptidos de menor tamaño. Entre ellos, la región α-gliadina 33-mero es resistente a la degradación enzimática debido a su alto contenido en prolina y glutamina. Este péptido entra a los enterocitos, donde se desamina por transglutaminasas intestinales, y se forman agregados que, en personas sanas, son eliminados. Sin embargo, en individuos celíacos, los agregados desencadenan una respuesta inmunológica. (Lebwohl, Sanders and Green, 2018)
Ante la ingesta de gluten, se empieza a sintetizar en exceso zonulina, una proteína que degrada las uniones entre enterocitos, aumentando la permeabilidad intestinal. Los fragmentos de gluten sin degradar alcanzan la lámina propia, donde son reconocidos como antígenos, y activan la respuesta inmune innata, mediada por citoquinas e interleucina-15. Su acción daña el epitelio intestinal, lo que sirve de señal para activar la transglutaminasa tisular 2, cuya función es desaminar las gliadinas. La modificación de las gliadinas favorece su interacción con las HLA DQ2/DQ8, presentes en la superficie de las células presentadoras de antígeno (APC). Esta interacción activa las células T helper, que atacan a los enterocitos, produciendo la inflamación y los síntomas gastrointestinales característicos de la celiaquía. Además, las células T killer pueden dirigirse a otros tejidos produciendo las afecciones extraintestinales nombradas anteriormente. (Leffler, Green and Fasano, 2015)
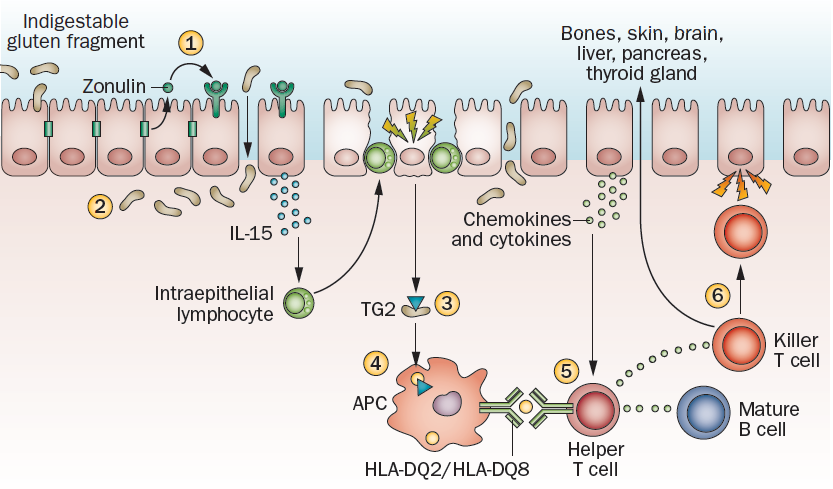
Leffler, D.A., Green, P.H.R. and Fasano, A. (2015) ‘Extraintestinal manifestations of coeliac disease’, Nature Reviews Gastroenterology and Hepatology, 12(10), pp. 561–571. Available at: https://doi.org/10.1038/nrgastro.2015.131.
Actualmente, el único tratamiento para la enfermedad celíaca es la eliminación total del gluten de la dieta. El complicado proceso molecular de esta patología se ha convertido en un objetivo de estudio, dando lugar a la identificación de diferentes dianas terapéuticas. Entre ellas, destacan la degradación enzimática, la sensibilización al gluten, la modulación de la permeabilidad intestinal y la restauración del equilibrio bacteriano de la microbiota intestinal. Estas dianas sirven como base para diseñar nuevos tratamientos de la enfermedad, que se mencionan a continuación.
Nuevos tratamientos en estudio
Degradación enzimática
Anteriormente, se ha explicado que algunos péptidos derivados de la gliadina son altamente resistentes a la degradación enzimática, debido a la presencia de residuos de prolina y glutamina. Las proteasas gastrointestinales de mamíferos no tienen la capacidad de escindir e impedir las propiedades inmunogénicas de estos péptidos. Por ello, se han buscado otras enzimas exógenas que puedan facilitar la digestión de esta proteína y evitar así la formación de agregados que desencadenan la respuesta inmune de la enfermedad celíaca. (Varma and Krishnareddy, 2022)
Principalmente, destacan las prolil-endopeptidasas (PEPs), que tienen como diana regiones ricas en prolina y están producidas por bacterias y hongos. Por un lado, las endopeptidasas de Flavobacterium meningosepticum (FM-PEP), Sphingomonas capsulata (SC-PEP) y Myxococcus xanthus (MX-PEP) tienen un pH óptimo entre 6 y 7, pero son inactivadas por pepsina. Por otro lado, Aspergillus niger produce AN-PEP, que se activa a un pH ácido entre 4 y 5, por lo que puede actuar a nivel del estómago, es decir, degradaría la gliadina antes de su llegada al intestino. Sin embargo, algunos ensayos clínicos recientes han demostrado que la degradación de esta endopeptidasa sería todavía insuficiente. (Wei et al., 2020)
La endopeptidasa TAK-062, formada a partir de la kumamolisina-As de Alicyclobacillus sendaiensis. Tiene como diana los motivos ricos en prolina y glutamina localizados en la región inmunogénica de la gliadina. Tiene una gran especificidad por la gliadina, por lo que se espera obtener una alta degradación de la proteína a nivel del estómago, y ha demostrado una gran eficacia en la degradación de grandes fragmentos de gluten. (Varma and Krishnareddy, 2022)
Una de las formas de tratamiento más prometedoras se basa en una endopeptidasa aislada por primera vez de la planta carnívora Nepenthes x ventrata, conocida como neprosina (NvNpr). Contiene dos residuos de glutamina en su centro activo, que facilitan su unión con α-gliadina, por lo que se han determinado como peptidasas glutámicas con actividad prolil-endopeptidasa. Se activa a pH gástrico y se ha confirmado su capacidad de degradación de escindir el residuo C-terminal de prolina de la gliadina y de la región 33-mero in vitro. (Ting et al., 2022)
Ting, T.Y. et al. (2022) ‘Neprosin belongs to a new family of glutamic peptidase based on in silico evidence’, Plant Physiology and Biochemistry, 183, pp. 23–35. Available at: https://doi.org/10.1016/j.plaphy.2022.04.027.
Además, se ha estudiado la actividad proteolítica de cistein-endoproteasas específicas de glutamina (EP-B2) que se encuentran en semillas de cebada en germinación. Han demostrado mayor efectividad en combinación con las PEPs mencionadas, ya que ambos tipos de enzimas tienen como diana residuos de glutamina y prolina, respectivamente. Entre ellas, destaca la latiglutenasa (IMGX003), un suplemento enzimático formado por dos proteasas específicas de gluten recombinantes, AN-PEP y ALV003, formada a su vez por SC-PEP y una cistein-endoproteasa específica de glutamina. Resultados de ensayos clínicos de este fármaco de administración oral han demostrado una disminución de síntomas como el dolor abdominal o la hinchazón en pacientes enfermos, así como una mejora de la calidad de vida de los mismos. (Murray et al., 2022; Rey et al., 2016)
Por último, se han encontrado enzimas que degradan gluten en la saliva humana. En concreto, se trata de endoproteasas de glutamina producidas por bacterias de la placa dental y salival, Rothia aeria y Rothia mucilaginosa. La enzima producida por R. mucilaginosa es capaz de escindir epítopos en fragmentos de α-gliadina y ω-gliadina. (Wei et al, 2020)
Probióticos y microbiota intestinal
La celiaquía se relaciona con una alteración de la microbiota intestinal (disbiosis), donde se observa un aumento de Bacteroides spp., E. coli, Proteobacteria, Clostridium spp., Enterobacteriaceae, Firmicutes y Staphylococcus, pero una disminución de Bifidobacterium spp., Streptococcus, y Lactobacillus, que afecta a la permeabilidad intestinal. Estas especies favorecen la degradación de los fragmentos de gliadina, por lo que al disminuir en número, se acumulan más fragmentos de esta, que se unen a receptores de citoquinas CXCR3. Los receptores están asociados con un incremento de producción de zonulina, y por lo tanto, varía la permeabilidad intestinal, activándose a su vez la respuesta inmune. (Cristofori et al., 2018; Chibbar and Dieleman, 2019)

Para combatir estas modificaciones, se ha estudiado el uso de probióticos como tratamiento alternativo a la dieta libre de gluten frente a la celiaquía, ya que se ha visto que retirar el gluten de la dieta, además de revertir algunas variaciones de las bacterias comensales intestinales ocasionadas por la enfermedad, puede suponer también un desequilibrio de la microbiota por sí solo. (Sanz, 2010; Caio et al., 2020)
Los probióticos, con algunas especies de Bifidobacterium y Lactobacillus principalmente, son capaces de recuperar el equilibrio bacteriano de la microbiota intestinal, inducir la regeneración del tejido endotelial y la mucosa dañados, evitar el aumento de permeabilidad intestinal, disminuir la producción de citoquinas proinflamatorias e hidrolizar los fragmentos inmunogénicos del gluten sin digerir, lo que impide la respuesta inmune excesiva que destruye las células endoteliales del intestino. Por otro lado, también tienen un papel fundamental en el mantenimiento de la homeostasis de la microbiota y la regulación del sistema inmune innato y adquirido.

Por todo esto, suponen una gran alternativa como tratamiento de la celiaquía, pero todavía está en desarrollo y se sigue investigando sobre ella, ya que, a pesar de que su uso, resulta eficaz para combatir y prevenir los daños intestinales producidos por la enfermedad, no se han determinado algunos aspectos como las especies, las dosis o el tiempo de empleo óptimos para resultar beneficiosos y poder considerarse como tratamiento aceptado y eficaz. (Pecora et al., 2020; Seiler et al., 2020)
Sensibilización al gluten
Como se conoce el mecanismo de activación de la respuesta inmune que provoca la sintomatología de la celiaquía, se conocen las posibles dianas a las que se pueden atacar para diseñar diversos tratamientos para la celiaquía. Uno de estos tratamientos, es el proceso de sensibilización al gluten, que consiste en la recuperación de la tolerancia a la ingesta de gluten en personas celíacas. Se han estudiado dos mecanismos para llevarlo a cabo:
- Inducción de muerte celular programada en células del epitelio intestinal patogénicas
- Activación de vías de generación de células T reguladoras, que inhiben a las células T que actúan ante la presencia de gluten, inactivando la respuesta inmune generada en personas celíacas.
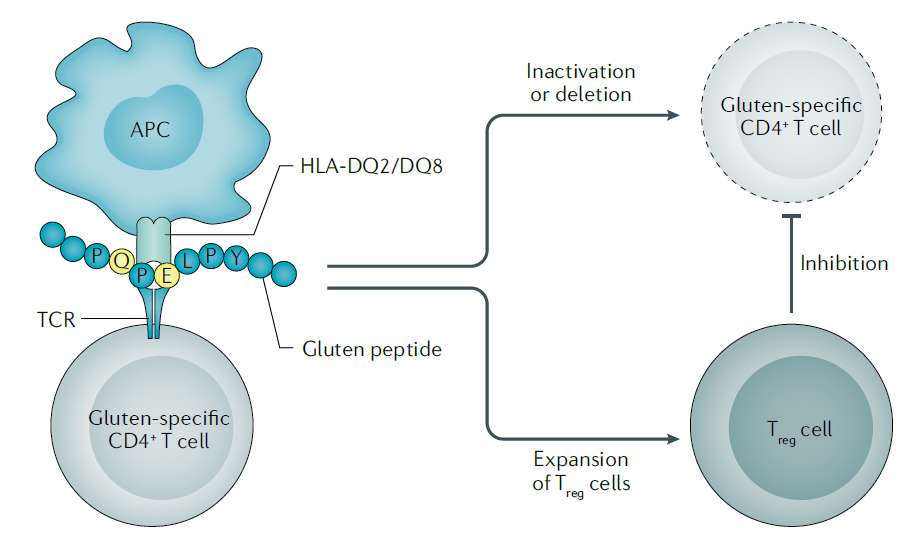
Kivelä, L. et al. (2021) ‘Current and emerging therapies for coeliac disease’, Nature Reviews Gastroenterology and Hepatology. Nature Research, pp. 181–195. Available at: https://doi.org/10.1038/s41575-020-00378-1.
Se han diseñado diversos tratamientos basándose en los dos mecanismos nombrados anteriormente. (Kivelä et al., 2021)
Se intentó diseñar una vacuna, denominada Nexvax2, que consistía en una inmunoterapia antígeno-específica que introducía 5 epítopos HLA-DQ2 específicos de células T del gluten, que se unían a estos y bloqueaban su función. Tras varios ensayos de la vacuna se vió que no daba resultados significativos en comparación con el grupo tratado con placebo. (Vaquero et al., 2018; Varma and Krishnareddy, 2022)
También se probó la administración de partículas tolerantes modificadas inmunológicamente que contenían gliadina encapsulada en nanopartículas (TIMP-GLIA). Con este tratamiento, se observaba la supresión de la respuesta inflamatoria de las células T y B y la enteropatía que aparecían con la ingesta de gluten. Se mantiene el estudio de este método, ya que ha mostrado eficacia en diversas pruebas que se han realizado con él. (Varma and Krishnareddy, 2022; Kivelä et al., 2021)
Además, se ha visto, que algunos parásitos humanos como Necator americanus podrían tener relación con la modulación de la inflamación de la mucosa. Se descubrió que lo que hacían estos parásitos era mantener el equilibrio de la microbiota intestinal y favorecer el crecimiento de bacterias, que como vimos en el apartado de los probióticos, sí que cumplían un papel relevante como tratamiento de la celiaquía. (Varma and Krishnareddy, 2022)
Estos tratamientos de momento son experimentales, pero la base de diseño parece dar algún resultado interesante, por lo que se debe continuar en esta línea para concluir un resultado eficaz oficial.
Modulación de las uniones ocluyentes
Como se ha mencionado anteriormente, una de las consecuencias de la ingesta de gluten es el aumento de la permeabilidad intestinal, que se debe a la secreción de zonulina por los enterocitos, tras el reconocimiento de gliadina por el receptor CXCR3. Así, otra posible diana terapéutica ante la enfermedad celíaca es el mantenimiento de las uniones ocluyentes de las células del epitelio intestinal.
El larazotide (LA) es un péptido sintético de ocho aminoácidos, que deriva de la toxina de zónula occludens de Vibrio cholerae. Se está probando su uso farmacológico y se ha observado que mejora la integridad de las uniones ocluyentes, previene la permeabilidad intestinal inducida por gliadina y, en consecuencia, reduce la inflamación intestinal. Además, un ensayo clínico en fase II ha determinado que el larazotide tiene buena tolerancia a nivel intestinal y que previene el empeoramiento de los síntomas causados por el gluten, convirtiéndolo así en una opción prometedora como tratamiento de la enfermedad celíaca. (Slifer et al., 2021)
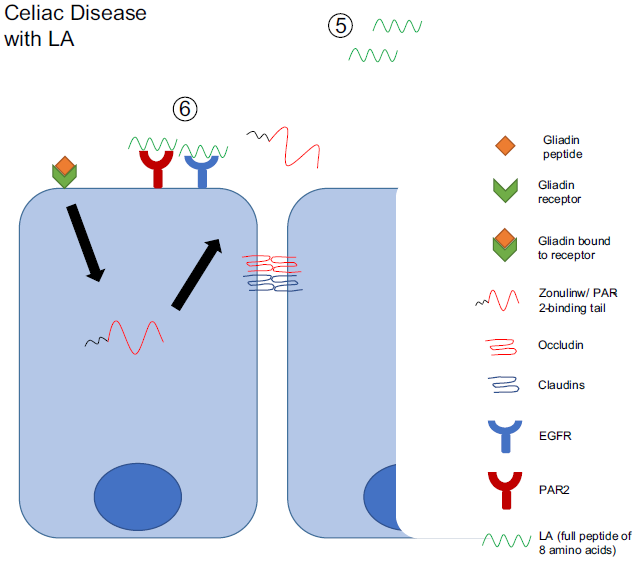
Slifer, Z.M. et al. (2021) ‘Larazotide acetate: A pharmacological peptide approach to tight junction regulation’, American Journal of Physiology – Gastrointestinal and Liver Physiology. American Physiological Society, pp. G983–G989. Available at: https://doi.org/10.1152/AJPGI.00386.2020.
Desaminación
La transglutaminasa 2 desamina un residuo de glutamina de los péptidos derivados de la gliadina. Esto favorece la expresión de HLA-DQ2 y HLA-DQ8 en las APC, que activan las células T helper, desencadenando la respuesta inflamatoria característica de la enfermedad celíaca. Evitando la reacción de desaminación, se podría inhibir la respuesta inmune de esta patología, por lo que esta enzima supone otra diana terapéutica.
Una de las opciones es el inhibidor de transglutaminasa 2 ZED122, que impide la formación de gluten desaminado. Se ha observado que, tras su administración, acompañada de una ingesta diaria de 3 gramos de gluten, se atenúa el daño de la mucosa del duodeno.
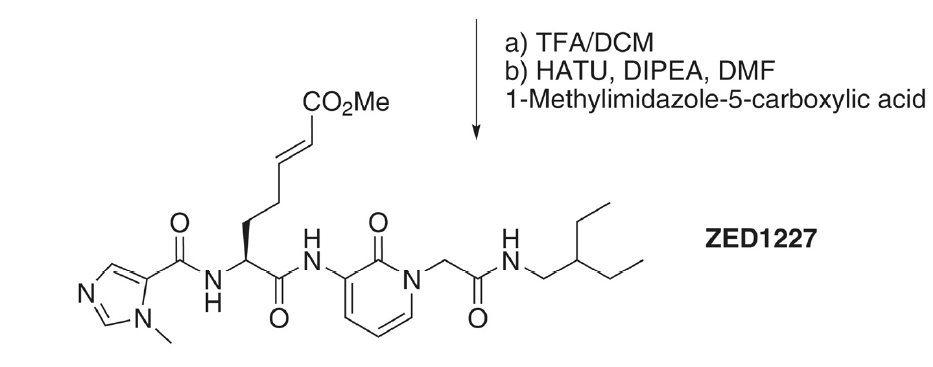
Büchold, C. et al. (2022) ‘Features of ZED1227: The First-in-Class Tissue Transglutaminase Inhibitor Undergoing Clinical Evaluation for the Treatment of Celiac Disease’, Cells, 11(10). Available at: https://doi.org/10.3390/cells11101667.
Además, el polímero BL-7010 se une a la gliadina y la protege de la degradación enzimática, por lo que evita la inflamación causada por los péptidos derivados de la gliadina. Se ha empezado a estudiar su función en cultivos celulares in vitro y en ratones transgénicos, en los que se ha determinado una disminución de la patogenia asociada al gluten. (Varma and Krishnareddy, 2022)
Referencias
[1] Biesiekierski, J.R. (2017) ‘What is gluten?’, Journal of Gastroenterology and Hepatology (Australia). Blackwell Publishing, pp. 78–81. Available at: https://doi.org/10.1111/jgh.13703.
[2] Lebwohl, B., Sanders, D.S. and Green, P.H.R. (2018) ‘Coeliac disease’, The Lancet. Lancet Publishing Group, pp. 70–81. Available at: https://doi.org/10.1016/S0140-6736(17)31796-8.
[3] Glissen Brown, J.R. and Singh, P. (2019) ‘Coeliac disease’, Paediatrics and International Child Health. Taylor and Francis Ltd., pp. 23–31. Available at: https://doi.org/10.1080/20469047.2018.1504431.
[4] Leffler, D.A., Green, P.H.R. and Fasano, A. (2015) ‘Extraintestinal manifestations of coeliac disease’, Nature Reviews Gastroenterology and Hepatology, 12(10), pp. 561–571. Available at: https://doi.org/10.1038/nrgastro.2015.131.
[5] Varma, S. and Krishnareddy, S. (2022) ‘Novel Drug Therapeutics in Celiac Disease: A Pipeline Review’, Drugs [Preprint]. Adis. Available at: https://doi.org/10.1007/s40265-022-01784-2.
[6] Wei, G., Helmerhorst, E.J., Darwish, G., Blumenkranz, G. and Schuppan, D., 2020. Gluten Degrading Enzymes for Treatment of Celiac Disease. Nutrients, [online] 12(7), p.2095. https://doi.org/10.3390/nu12072095.
[7] Ting, T.Y. et al. (2022) ‘Neprosin belongs to a new family of glutamic peptidase based on in silico evidence’, Plant Physiology and Biochemistry, 183, pp. 23–35. Available at: https://doi.org/10.1016/j.plaphy.2022.04.027.
[8] Murray, J.A. et al. (2022) ‘Latiglutenase Protects the Mucosa and Attenuates Symptom Severity in Patients With Celiac Disease Exposed to a Gluten Challenge’, Gastroenterology [Preprint]. Available at: https://doi.org/10.1053/j.gastro.2022.07.071.
[9] Rey, M. et al. (2016) ‘Addressing proteolytic efficiency in enzymatic degradation therapy for celiac disease’, Scientific Reports, 6. Available at: https://doi.org/10.1038/srep30980.
[10] Cristofori, F. et al. (2018) ‘Probiotics in celiac disease’, Nutrients. MDPI AG. Available at: https://doi.org/10.3390/nu10121824.
[11] Chibbar, R. and Dieleman, L.A. (2019) ‘The gut microbiota in celiac disease and probiotics’, Nutrients. MDPI AG. Available at: https://doi.org/10.3390/nu11102375.
[12] Sanz, Y. (2010) ‘Effects of a gluten-free diet on gut microbiota and immune function in healthy adult humans’, Gut Microbes, 1(3), pp. 135–137. Available at: https://doi.org/10.4161/gmic.1.3.11868.
[13] Caio, G. et al. (2020) ‘Effect of gluten-free diet on gut microbiota composition in patients with celiac disease and non-celiac gluten/wheat sensitivity’, Nutrients. MDPI AG, pp. 1–23. Available at: https://doi.org/10.3390/nu12061832.
[14] Pecora, F. et al. (2020) ‘Gut Microbiota in Celiac Disease: Is There Any Role for Probiotics?’, Frontiers in Immunology. Frontiers Media S.A. Available at: https://doi.org/10.3389/fimmu.2020.00957.
[15] Seiler, C.L. et al. (2020) ‘Probiotics for Celiac Disease: A Systematic Review and Meta-Analysis of Randomized Controlled Trials’, American Journal of Gastroenterology. Wolters Kluwer Health, pp. 1584–1595. Available at: https://doi.org/10.14309/ajg.0000000000000749.
[16] Kivelä, L. et al. (2021) ‘Current and emerging therapies for coeliac disease’, Nature Reviews Gastroenterology and Hepatology. Nature Research, pp. 181–195. Available at: https://doi.org/10.1038/s41575-020-00378-1.
[17] Vaquero, L. et al. (2018) ‘New coeliac disease treatments and their complications’, Gastroenterologia y Hepatologia. Ediciones Doyma, S.L., pp. 191–204. Available at: https://doi.org/10.1016/j.gastrohep.2017.12.002.