C. Menor-Salvan. V.2 oct 2020/sep 2022
Comienzo a escribir aquí en el momento en el que los árboles nos regalan los preciosos y nostálgicos colores del otoño. El verdor veraniego da paso a toda una gama de amarillos, anaranjados y rojos; mientras, el olor de la lluvia de otoño, los atardeceres dorados, y las setas creciendo gracias a la humedad y el suelo cubierto de hojas completan una escena mágica.



¿cual es el origen de los colores otoñales de los árboles a punto de comenzar su descanso invernal? ¿qué papel biológico fundamental juegan las moléculas que dan ésta coloración a las hojas?
Vamos a desvelar este secreto a través de la descripción de una estructura molecular fundamental: el fotosistema I de plantas vasculares, cuya estructura ya se conoce bien, y es uno de los centros de reacción fotoquímicos en la fotosíntesis y una maravilla evolutiva.
El fotosistema I es un complejo proteico formado por 16 proteínas, situado en el tilacoide de los cloroplastos; su función es recoger los electrones desde el fotosistema II y, con ayuda de la energía de la luz, generar un complejo molecular extremadamente reductor; este complejo, a través de una cascada de aceptores-donadores de electrones intermedios, reducirá el NADP+ para formar NADPH. La síntesis de NADPH no es mas que otro paso intermedio hasta que los electrones, tomados de su fuente inicial, la oxidación del agua a oxígeno molecular, llegarán a su aceptor final, el CO2.
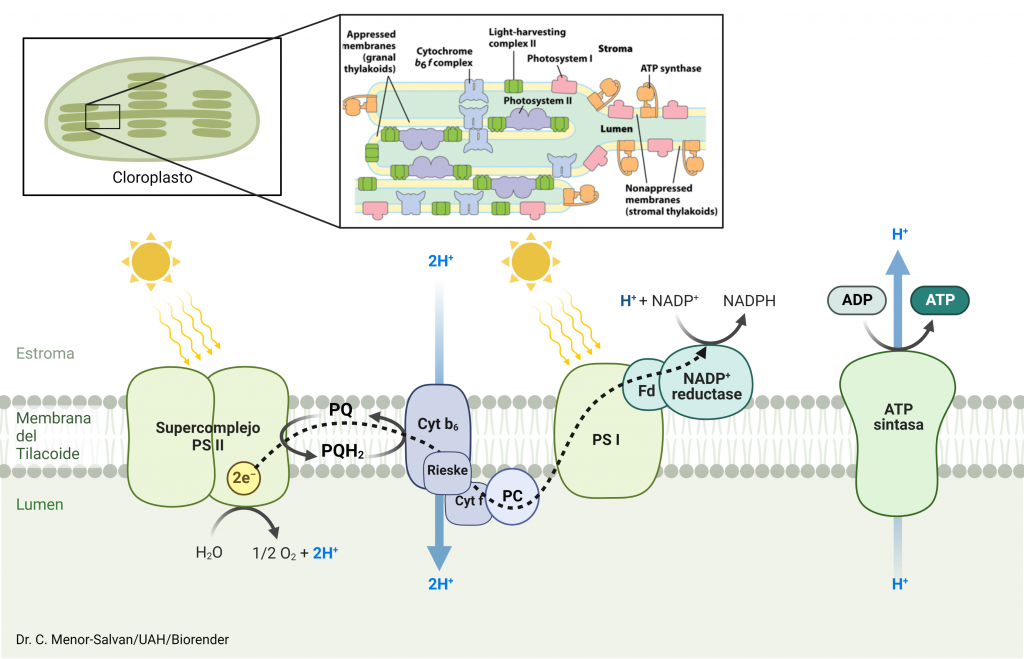
Para entender bien este proceso, voy a describirlo en detalle, a través de la estructura de los cofactores que componen el fotosistema I. La parte proteica vamos a dejarla de lado, pues el propósito de ésta entrada es la descripción del mecanismo del fotosistema I.
Basándonos en la reciente publicación de la estructura del fotosistema I y su supercomplejo con ferredoxina (la enzima que cataliza la reducción de NADP+) y plastocianina (el transportador de electrones desde el fotosistema II), vamos a editar su estructura con el software chimera y revelar su mecanismo de acción.
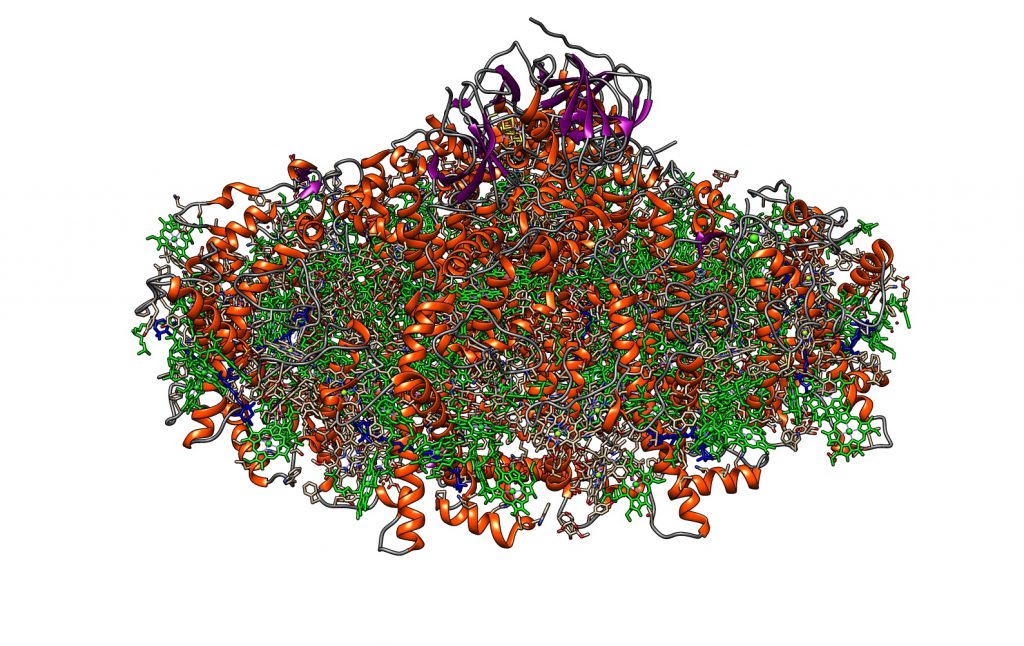
Cuando observamos la proteína completa, lo primero que debe llamarnos la atención es que es muy rica en cofactores. En color verde se observan las moléculas de clorofila, de las cuales el fotosistema contiene decenas. Además de clorofila, contiene otros pigmentos de la familia de los carotenoides: luteína o xantofila (en azul en la molécula), zeaxantina y beta-caroteno, como los pigmentos más significativos, de los cuales contiene 35 moléculas. La clorofila es un pigmento de color verde, por lo que, dado que es mayoritario, da su color a las hojas en plena función, durante la primavera y el verano.
Si en la estructura retiramos la parte proteica, podremos ver la compleja estructura que forman los pigmentos:
Estos pigmentos son cromóforos, es decir, moléculas que absorben luz visible a ciertas longitudes de onda, reflejando las otras. Los pigmentos del fotosistema, por tanto, absorben luz; la energía luminosa provoca una excitación desde el estado fundamental del cromóforo a un estado excitado, muy inestable, en el que un electrón ha aumentado su energía, saltando a un orbital molecular desocupado. Antes de que la molécula del cromóforo se relaje a su estado fundamental, emitiendo la energía en forma de luz o de fonones, debe transferirla para que llegue al centro de reacción. Para realizar esta transferencia de energía de modo eficiente es donde el diseño del fotosistema adquiere su belleza y complejidad.
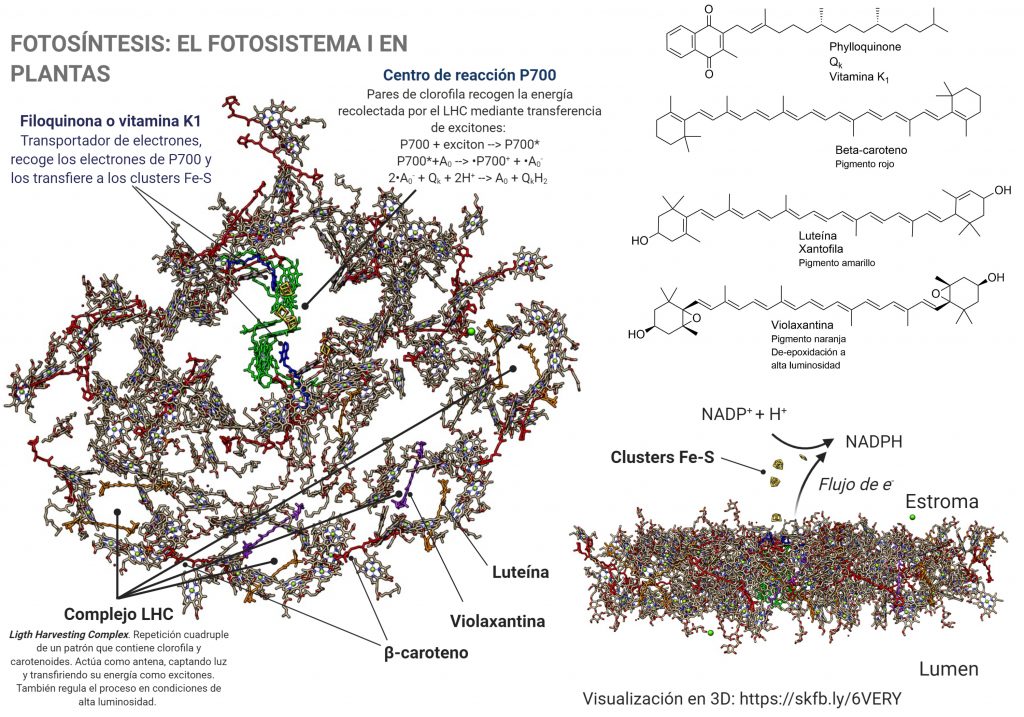
Una vez desnudo de su parte proteica, vemos la intrincada red de pigmentos que lo forman. Estos pigmentos son, fundamentalmente, las clorofilas a y b, y los carotenoides beta-caroteno, luteína y violaxantina, además de algunos otros pigmentos que se encuentran en menor cantidad. Todos ellos participan en la recolección de la energía de la luz, siendo moléculas antena.
El complejo LHC
En la estructura podemos distinguir un dominio bien diferenciado, que es el complejo LHC (light harvesting complex), formado por cuatro subunidades que se repiten y que contienen los cinco pigmentos. Como dice su nombre, su función es la recolección de la energía luminosa. Vamos a verlo más de cerca:
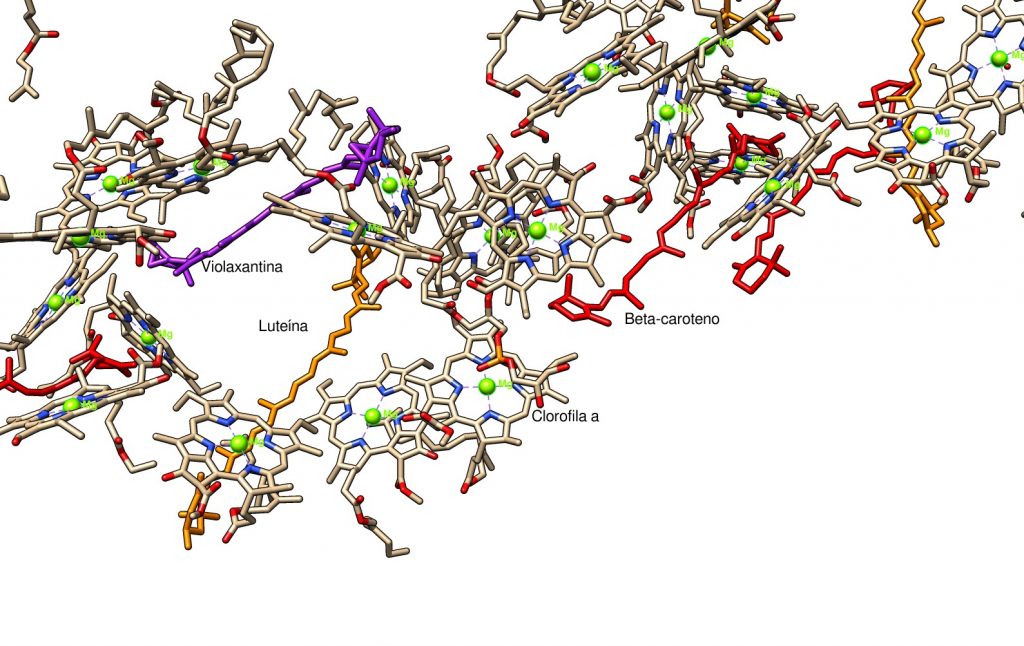
Vemos una red de moléculas de clorofila muy próximas unas a otras, y, uniendo las subunidades del LHC, largas moléculas de carotenos. Esta ordenación y proximidad de los pigmentos hace posible la transferencia de energía en forma de excitones moleculares. Cuando una molécula se excita por la luz y se encuentra en la proximidad de otra molécula de propiedades energéticas similares (como es el caso de las clorofilas próximas unas a otras en la imagen de arriba), se forma un excitón molecular y tiene lugar la transferencia de energía por un mecanismo llamado transferencia de energía de resonancia de Förster (abreviado FRET). Las moléculas de pigmento en la antena del LHC se encuentran acopladas, de modo que los estados excitados se deslocalizan entre ellas (no se preocupe el lector si no entiende bien el proceso, pues el fundamento físico es complejo). Mediante los excitones moleculares, la red de pigmentos recogen la energía de la luz y la transportan hacia el centro de reacción. Esta red de pigmentos y el diseño del fotosistema lo hacen tremendamente eficiente, tanto que los intentos de elaborar un sistema artificial similar no alcanzan ni se acercan a la eficiencia del fotosistema.

Si tomamos la imagen de los pigmentos del LHC y retiramos el cromóforo mayoritario, la clorofila a, usando las posibilidades de edición de Chimera, vemos esta estructura:
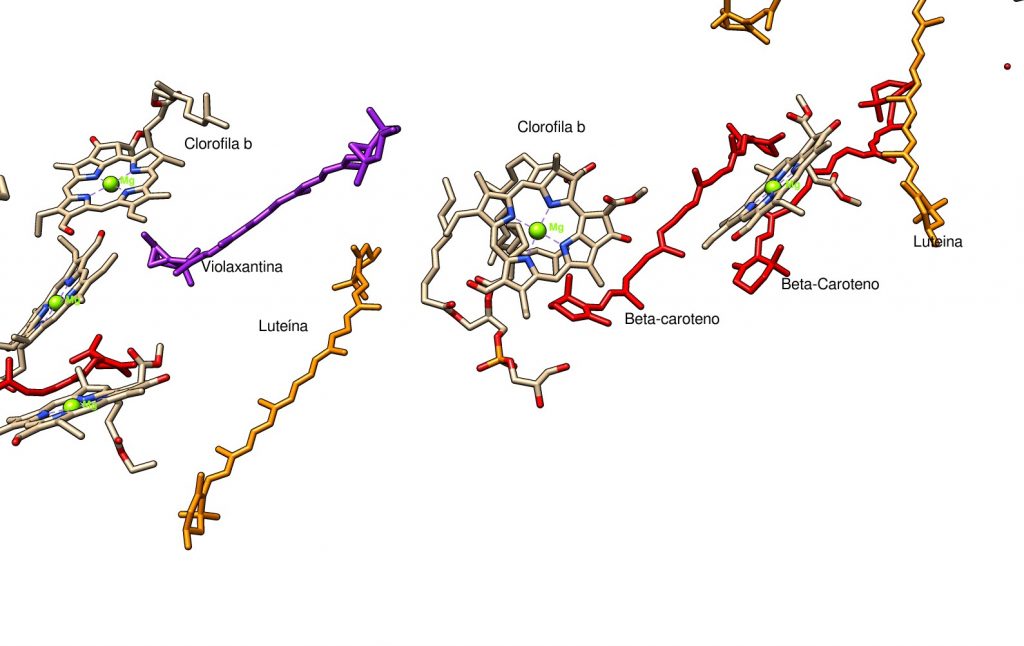
La clorofila b y los otros cromóforos extienden la respuesta espectral de la planta, aumentando el rango de energía luminosa que puede captar y, por tanto, su eficiencia. La clorofila b también tiene color verde, aunque con otro tono; las clorofilas absorben luz en las regiones del ultravioleta cercano, azul y roja, de ahí que aparezcan con color verde. Los carotenos manifiestan un color que se extiende entre el amarillo y el rojo, aumentando, por tanto, la capacidad de la planta para absorber los colores azules y verdes. Es decir, el cromóforo aparece con el color correspondiente a las energías de la luz que no absorbe. El conjunto de pigmentos de la planta se correlaciona muy bien con el espectro solar total, estando por tanto bien adaptadas a la luminosidad de nuestra estrella. Si hubiera organismos fotosintéticos en otros planetas, sus pigmentos tendrían las diferencias justas para cubrir el espectro de su estrella, por lo que esos organismos podrían tener otros colores.

El centro de reacción P700
La energía recolectada por las moléculas antena se transfiere al centro de reacción. Allí es donde la fotoquímica y la electroquímica se unen.
-una curiosidad: el nombre de P700 viene de la longitud de onda, 700 nm, a la cual si se irradia fuertemente el fotosistema, tiene lugar un fenómeno llamado «bleaching» o blanqueamiento, esto es, la pérdida temporal de su capacidad para absorber luz-
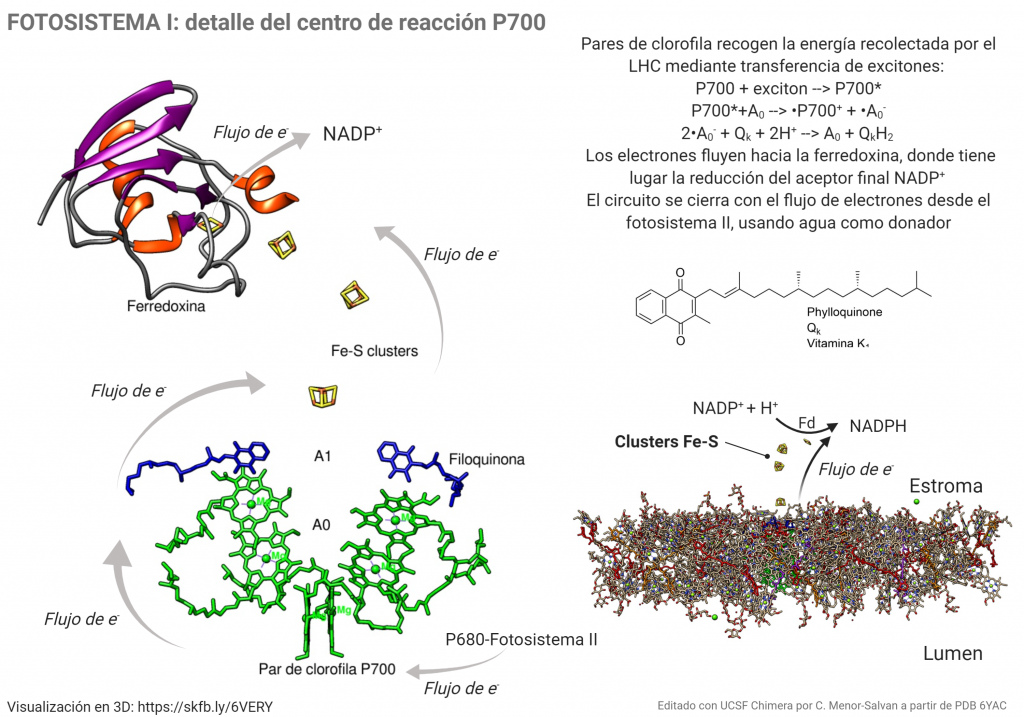
Cuando la energía de los excitones alcanzan el par de moléculas de clorofila que forman el centro P700, tiene lugar la formación de un estado excitado extremadamente reductor, P700*. Al tener un potencial electroquímico tan negativo (aprox. -1.4 V), es capaz de transferir electrones a través de una cadena de transportadores: primero un par de clorofilas Ao, que transfieren cada una un electrón a una molécula de filoquinona, Qk o vitamina K1; la quinona puede reducirse adquiriendo los dos electrones, para dar la forma quinol, que se reoxida transfiriendo los electrones a través de una cadena de clusters Fe4-S4, «nanocristales» de sulfuro de hierro que pueden conducir los electrones hasta el cluster plano Fe2-S2 de la ferredoxina; este proceso es similar al que tienen lugar en minerales de sulfuro ferroso que ses transforman por oxidación parcial en pirita. La ferredoxina cataliza el paso final del proceso: la reducción del NADP+ a NADPH, que después intervendrá en la fijación del carbono por reducción del CO2.

Si el lector ha seguido el mecanismo se habrá dado cuenta de que el centro P700 recogió los excitones con la energía recolectada por el complejo LHC, y cedió sus electrones a la cadena de transporte hasta llegar al NADP+. ¿qué pasó con él? Si ha quedado con defecto de electrones, ¿como repetimos el ciclo?. El catión radical que quedó tras el proceso, .P700+, es una especie inestable y extremadamente oxidante. Está «deseando» captar un electrón, que recoge desde el fotosistema II, que a su vez lo obtiene de la oxidación del agua para formar O2. Es decir, visto en conjunto y perspectiva, tenemos un proceso electroquímico en el que el NADP+ oxida el agua, reduciéndose a NADPH (siempre que una especie se oxida, otra debe reducirse) dando lugar a la siguiente reacción global:
2H2O + 2NADP+ + 8 fotones ——> O2 + 2NADPH + H+
Como este proceso no es favorable energéticamente, se utiliza la energía de la luz para impulsarlo.
¿…y las hojas en otoño?
Durante la primavera y el verano, en plena actividad fotosintética, las hojas de los árboles tienen el verdor que les da las clorofilas, que, como hemos visto, son los cromóforos mayoritarios. Cuando comienza la senescencia de las hojas en los árboles de hoja caduca, primero tiene lugar una inhibición de la expresión de genes implicados en la fotosíntesis y un aumento de genes relacionados con respuesta al estrés oxidativo, acorde con un aumento de actividad mitocondrial, aumento de la generación de especies reactivas por el desacoplamiento de la fotosíntesis, y aumento de la expresión de genes implicados en rutas degradativas. Entonces, comienza la degradación de las clorofilas, con liberación del magnesio y formación de una molécula lineal incolora de tetrapirrol.
Los otros cromóforos que hemos visto no sufren una degradación tan rápida, por lo que, al desaparecer las clorofilas, comienzan a manifestarse los fantásticos colores otoñales.
Según cada especie, tenemos una combinación de proporciones de diversos colorantes amarillos y anaranjados, que dan lugar a la gama bien conocida de colores. La degradación de clorofila tiene una función esencial: la removilización del nitrógeno y el magnesio, y su uso en las semillas y sistemas de almacenamiento, que serán esenciales durante la siguiente primavera.

Otro proceso paralelo a la degradación del sistema fotosintético es la síntesis de antocianinas. Estas sustancias confieren un intenso color rojo a las hojas. Se piensa que estas sustancias tienen un papel antioxidante y fotoprotector. La síntesis de antocianinas es variable, dependiendo de la especie, y, dentro de cada especie, de las condiciones que se dieron durante el verano, la disponibilidad de azúcares (precursores de las antocianinas) y la humedad.

Ahora que el lector conoce los secretos de los colores de las hojas, espero que disfrute especialmente de la magia del otoño y la belleza de sus colores.
Referencias
Caspy, I., Borovikova-Sheinker, A., Klaiman, D., Shkolnisky, Y. and Nelson, N. (2020) ‘The structure of a triple complex of plant photosystem I with ferredoxin and plastocyanin’, Nature Plants. Springer US, 6(10), pp. 1300–1305. doi: 10.1038/s41477-020-00779-9.
Fassioli, F., Dinshaw, R., Arpin, P. C. and Scholes, G. D. (2014) ‘Photosynthetic light harvesting: Excitons and coherence’, Journal of the Royal Society Interface, 11(92). doi: 10.1098/rsif.2013.0901.
Hörtensteiner, S. and Kräutler, B. (2011) ‘Chlorophyll breakdown in higher plants’, Biochimica et Biophysica Acta – Bioenergetics. Elsevier B.V., 1807(8), pp. 977–988. doi: 10.1016/j.bbabio.2010.12.007.
Mattila, H., Valev, D., Havurinne, V., Khorobrykh, S., Virtanen, O., Antinluoma, M., Mishra, K. B. and Tyystjärvi, E. (2018) ‘Degradation of chlorophyll and synthesis of flavonols during autumn senescence-the story told by individual leaves’, AoB PLANTS, 10(3), pp. 1–13. doi: 10.1093/aobpla/ply028.




