FACTOR INDUCIBLE POR HIPOXIA (HIF)
Por Marina Fanega Fernández y Pablo García Alén. Grado en Biología Sanitaria, Universidad de Alcalá.
INTRODUCCIÓN
El oxígeno es fundamental para el mantenimiento y buen funcionamiento de las células, siendo, por ejemplo, el último aceptor de electrones en la respiración celular y esencial para la hidroxilación de las prolil-hidroxilasa y síntesis del colesterol. Por ello se han desarrollado una serie de mecanismos ayudan a sobrevivir a las células cuando la presión de oxigeno es baja.
La privación de oxígeno o hipoxia desencadena una serie de procesos cuya respuesta se divide en tres sistemas: de detección de oxígeno, de regulación y efector. El sistema regulador, está controlado genéticamente mediante un factor de transcripción específico denominado factor inducible por hipoxia 1 (HIF-1). Su mayor o menor presencia en tejidos y órganos depende del tipo o tipos celulares de los que estén compuestos, ya que obedece a la presencia de genes específicos en ellas.
La actuación del HIF-1 en el organismo no es exclusivamente la producción de una respuesta fisiológica a la hipoxia; sino que también está involucrado en otros procesos, principalmente en los mecanismos de reparación celular. Además está implicado en algunas alteraciones fisiopatologías como la enfermedad pulmonar crónica, la anemia/hemorragia, la isquemia/reperfusión, hiper o hipovascularización retiniana y vascularización y resistencia celular de los tumores entre otras.
PAPEL BIOLOGICO
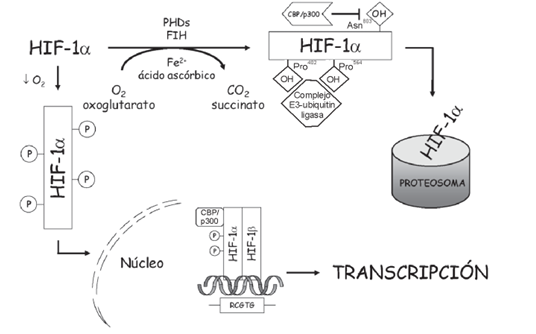
Los factores introducidos por hipoxia (HIF) son una serie de proteínas cuya función es clave en la regulación de la homeostasis oxigénica, regulando la respuesta celular a la hipoxia (situación en la cual la presión y concentración de oxígeno en los tejidos se reduce a niveles críticos durante un periodo de tiempo prolongado. La presión normal, o Normoxia, de oxígeno se considera con la concentración al 21% a presión atmosférica a nivel del mar). Cuando la presión de oxígeno en la sangre es normal, la subunidad HIF-1α se encuentra hidroxiladas por enzimas PHD (Prolyn-Hidroxylase Domain), lo que provoca la ubiquitinación y degradación de las HIF-1. Las enzimas PHD hidroxilan dos prolinas del HIF-1α uniendo dos moléculas de oxígeno gracias a un ion metálico y a α-ketoglutarato. No obstante, cuando la cantidad de oxigeno es insuficiente, no se degrada HIF-1α, provocando su unión a HIF-1β, lo que da lugar a una activación de la proteína, y a una cascada de activaciones proteicas que desemboca en la activación de genes activados por HIF-1. [1][2]
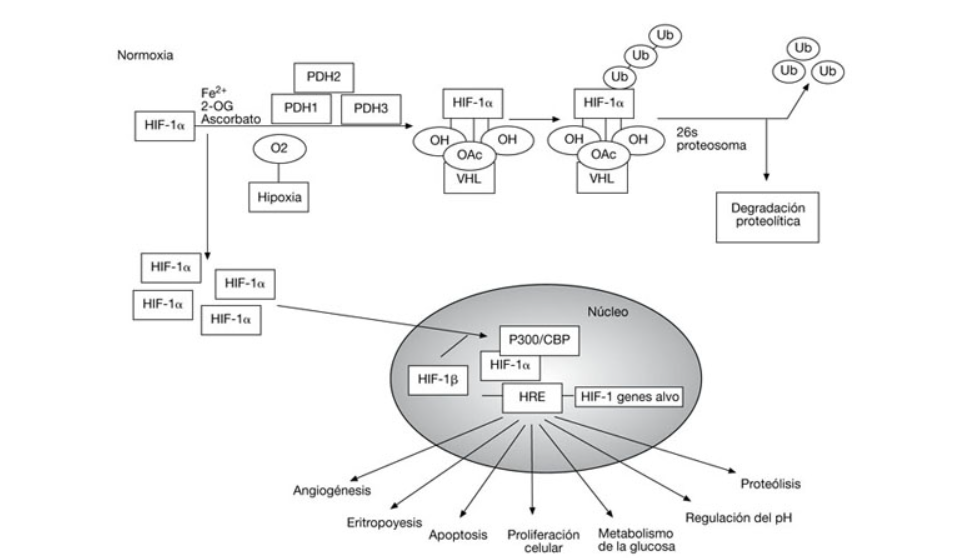
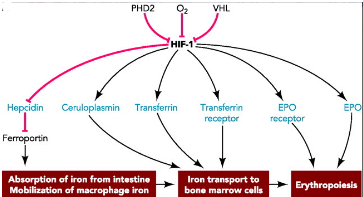
Los primeros genes en ser activados son los genes de la eritropoyesis, o genes encargados de la formación de glóbulos rojos en sangre. Ante una situación de hipoxia, HIF activa células en todo el cuerpo, incluyendo aquellas que producen eritropoyetina (EPO), una glucoproteína que se une a un receptor en las células progenitores de los eritrocitos, provocando su diferenciación y aumentando sus posibilidades de supervivencia. También estimula la absorción del hierro y su transporte, uniéndose y activando genes que responden a hipoxia (HRE, hypoxia-responsive genes) que estimulan la producción de transferrina y receptores de transferrina, que transportan el hierro a la medula ósea para aumentar la producción de eritrocitos. Las proteínas HIF activan a su vez los receptores de EPO en las células progenitoras de eritrocitos. [3][4][5]
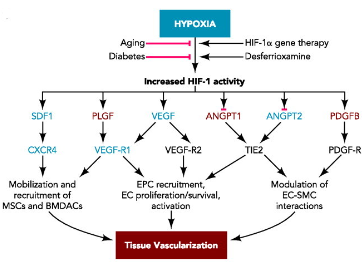
Otra de las respuestas que provoca la activación de las proteínas HIF es la angiogénesis, o formación de nuevos vasos sanguíneos y capilares. Bien sea por hipoxia ante el crecimiento del tejido, o activado de forma preventiva al crecimiento, el HIF-1 activa genes que se encargan de la secreción de factores de crecimiento y citoquinas, incluyendo VEGF (Vascular Endothelial Growth Factor), SDF-1 (Stromal-Derived Factor 1), angiopoetina 1 y 2 y PGF (Placental Growth Factor). Además, regula la producción de CXCR4, un receptor de SDF-1 y VEGF. Estos factores de crecimiento se unen a células progenitoras endoteliales, musculares lisas y vasculares, produciendo una vascularización de los tejidos. El HIF actúa como regulador de la vascularización y oxigenación tisular. Un aumento en la capilarización de los tejidos supone una mejoría en la difusión del oxigeno en los tejidos, resultando en una mejora del rendimiento metabólico en las células, así como una mejora en la regulación de la temperatura corporal, al poder distribuir la sangre el calor excedente producido por las células. [3][2][6]
La respuesta a nivel celular ante estado de hipoxia consiste en varias alteraciones relacionadas con el metabolismo celular, y el transporte y consumo de glucosa. A nivel mitocondrial, el HIF-1 estimula la transcripción de LON, una proteasa mitocondrial que se encarga de la degradación del COX4-1 (Citocromo Oxidasa 4 de la mitocondria, que actúa en situación de Normoxia), y la transcripción de COX4-2 (Citocromo Oxidasa 4 de la mitocondria que actúa en condiciones de Hipoxia) que optimiza la transferencia de electrones en la mitocondria en situaciones de Hipoxia. Otra alteración de importancia consiste en la activación de PDK-1 (pyruvate dehydrogenase kinase 1), que fosforila una de las subunidades de la PHD (Piruvato DesHidrogenasa), evitando que esta transforme el piruvato en Acetil Coenzima A (AcetilCoA), deteniendo así la entrada al Ciclo de Krebs y la cadena de transporte de electrones, paralizando el metabolismo de glucosa. Esto provoca un metabolismo de menor gasto de oxígeno, pero menor producción de ATP, lo que se compensa con un aumento de la cantidad de glucosa en la célula, que entra gracias a transportadores de glucosa (también transcritos y activados por genes diana del HIF-1), y la transformación de dicha glucosa en lactato vía Lactato Deshidrogenasa A, también transcrito por los genes activados por HIF. Este proceso no obstante no detiene la entrada en el Ciclo de Krebs del AcetilCoA proveniente de ácidos grasos. En casos más extremos, la HIF-1 puede llevar a una autofagia selectiva de las mitocondrias dentro de las células. Todas estas reacciones refuerzan la percepción de que el HIF-1 actúa como regulador del oxígeno en el sistema celular, manteniendo un balance entre consumo de oxígeno y producción de ATP sin producir un exceso de deshechos de oxígeno, otorgando a la célula una respuesta activa ante las situaciones de Hipoxia. [3][6][8][2]
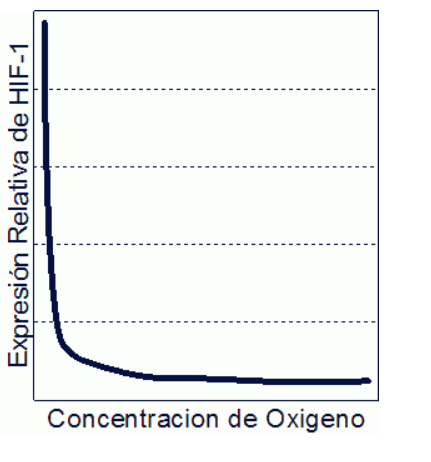
Los niveles de concentración de HIF-1 varían de forma inversamente proporcional a la concentración de oxígeno con respecto al estado normal como se observa en el grafico inferior.
ESTRUCTURA Y MECANISMO
El factor inducible por hipoxia es un heterodímero que está formado por dos subunidades:
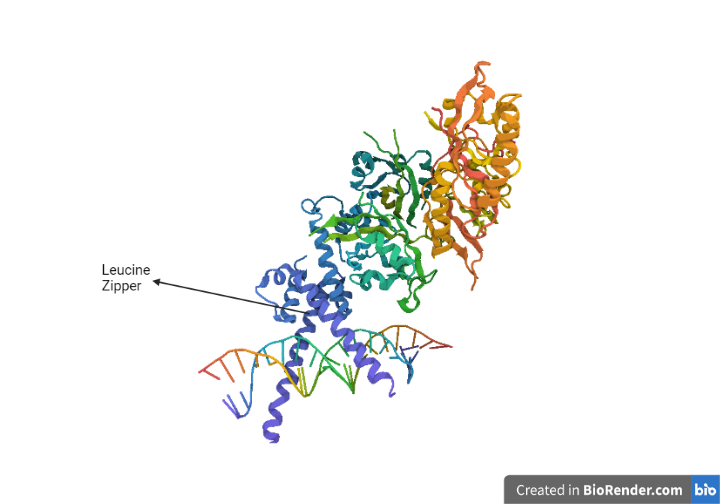
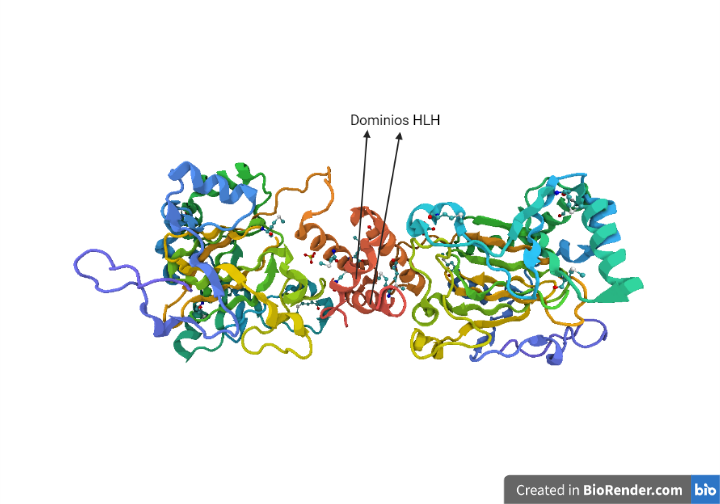
HIF-α y HIF-β. Ambas en su extremo N-terminal presentan un motivo HLH (hélix-loop-helix) y un dominio PAS (que detecta la señal específica a traves de un cofactor, el grupo hemo), con un motivo estructural supersecundario llamado Leucine Zipper. Gracias a su presencia se produce la dimerización y la unión al ADN.[9]
Subunidad HIF- α
En su extremo C-terminal posee dos dominios de transactivación (TADs) responsables de la función de transactivación, es decir, en el incremento de la expresión génica del factor. [10]. Además contienen el dominio de degradación dependiente de oxígeno (ODD), participando en la función reguladora del factor. [11]
En condiciones de presión de oxigeno normal, se hidrolizan residuos de prolina y asparagina de los dominios TAD y ODD y por tanto la subunidad α es ubiquitinizada por E3 y degradada en los proteosomas. En condiciones hipoxícas, HIF- α se fosforila y es trasnlocada al núcleo, gracias a las señales de localización nucleares (NLSs) tanto en N como en C-terminal. Se ha descubierto recientemente que el la NLS del extremo carboxílico tiene una mayor implicación en la translocación de HIF-α al núcleo. .[9]
Subunidad HIF- β
Ésta subunidad es exactamente igual al ARNT o translocador nuclear del recetor Ah. Ésta a su vez dimeriza con los receptores de Ah cuyos ligandos, como hidrocarburos aromáticos o aminas heterociclícas, son perjudiciales.[9]
Un vez haya sido transportada HIF- α al núcleo, se produce la dimerización con HIF- β y se forma el factor inducido por hipoxia. El complejo reconoce la secuencia de nucleótidos TACGT y a otros cofactores, elementos que responden ante situaciones de hipoxia que se encuentran en las regiones promotoras de muchos genes que participan en la regulación de muchos sistemas y procesos del organismo como el metabolismo energético o la angiogénesis.
Es importante destacar que HIF-F se acopla a unas HSP (Heat Shock Protein), que lo protege de un mal plegamiento o una agregación inadecuada y por tanto de su degradación.[9]
En condiciones de normoxia, o niveles de oxigeno normales, el factor inhibidor del HIF provoca que el HIF no lleve a cabo su función, mediante el bloqueo de la transactivación. Éste actúa hidrolizando el residuo de una asparagina cerca del C-terminal de la subunidad α, provocando la degradación de HIF-1.
PAPEL BIOMÉDICO
Las proteínas del tipo HIF son un descubrimiento reciente, cuyo papel a nivel sanitario se está estudiando en varios campos.
Ante una situación de hipoxia, las arterias sistémicas se dilatan, para permitir una mayor difusión de oxígeno, mientras que las arterias pulmonares se constriñen para acelerar el flujo sanguíneo hacia los pulmones. Esto se debe a la capacidad reguladora de HIF-1 en las células musculares arteriales lisas ante situaciones de hipoxia en el organismo. En situaciones de hipoxia continúa debido a enfermedades pulmonares crónicas, provoca una despolarización de las membranas que induce a la vasoconstricción en arterias pulmonares, así como un hiperatrofiamiento de estas. Como resultado, el corazón debe bombear sangre con más fuerza, dando lugar a hipertensión pulmonar y fallos por hipertrofia (en consecuencia) del tejido miocardio. [6][5][9]
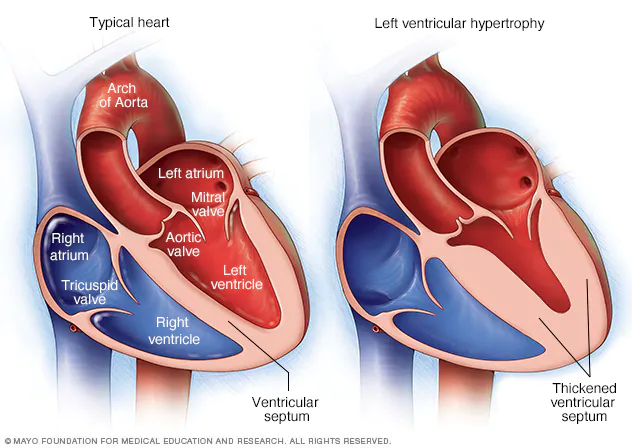
Enfermedades como la apnea del sueño obstructiva pueden inducir a hipoxia continua intermitente, en la cual el cuerpo carotideo provoca un secreción hormonal (catecolamina) que induce a un aumento de la tensión arterial sistémica, así como una producción de deshechos de oxígeno inducida por el HIF-1. [6]
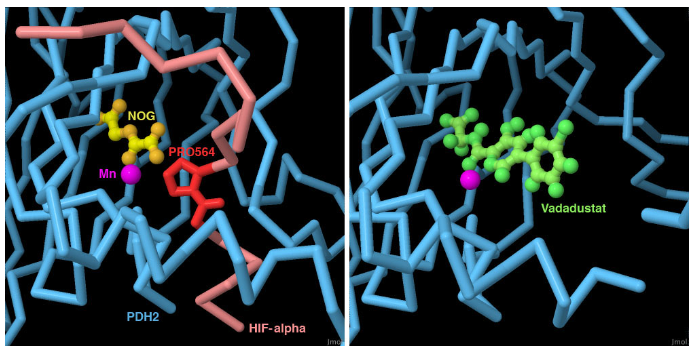
La anemia se describe como una patología en la cual la sangre produce una cantidad inferior a la normal de glóbulos rojos sanos. En pacientes con anemia, se están realizando estudios con medicamentos que inhiben las enzimas PHD, con medicamentos como el Vadasustat (2-([5-(3-clorofenil)-3-hidroxipiridina-2-carbonil]amino) ácido acético), que ejerce de inhibidor competitivo de enzimas PHD frente al HIF-1. Al unirse e inactivar las enzimas PHD, se espera activar las proteínas tipo HIF dentro del paciente en para así estimular la eritropoyesis y la producción de nuevos glóbulos rojos. [10][6]
Los tumores se forman debido a la reproducción descontrolada de células en un tejido debido a fallos de control en el ciclo celular. Este crecimiento conlleva un aumento de la actividad metabólica de la región, asociada al aumento de glucolisis para obtener la energía que las células tumorales requieren para reproducirse y al aumento descontrolado del número de células. Como resultado de este aumento en el consumo de oxígeno en los tejidos, la presión de oxígeno cae, y el tumor comienza a proliferar en un medio hipóxico, debiendo adaptarse a este para poder sobrevivir y proliferar. Ante esto, el papel de la proteína HIF-1 resulta vital para el desarrollo del tumor. En condiciones de hipoxia, HIF-1 no es degradado y activa una serie de genes y oncogenes que ayudan a la proliferación de las células neoplásicas. La proteína HIF-1 se activa y comienza a regular el metabolismo de la glucolisis, permitiendo a las células tumorales disminuir el pH y aumentar la eficiencia en la producción de energía en forma de ATP. Al aumentar las condiciones de hipoxia al desarrollarse el tumor, aumenta la expresión de HIF-1, que activa a los genes productores de VEGF y otros factores de crecimiento, que vascularizan el tejido tumoral, facilitando el crecimiento, agresión y metástasis de los tumores. [2][6]
BIBLIOGRAFÍA
[1] «Cellular adaptation to hypoxia: O2‐sensing protein hydroxylases, hypoxia‐inducible transcription factors, and O2‐regulated gene expression», doi: 10.1096/fj.01-0944rev.
[2] A. Fraga, R. Ribeiro, y R. Medeiros, «Hipoxia tumoral: Papel del factor inducible por hipoxia», Actas Urol. Esp., vol. 33, n.o 9, pp. 941-951, oct. 2009.
[3] R. H. Wenger, «Cellular adaptation to hypoxia: O 2 ‐sensing protein hydroxylases, hypoxia‐inducible transcription factors, and O 2 ‐regulated gene expression», FASEB J., vol. 16, n.o 10, pp. 1151-1162, ago. 2002, doi: 10.1096/fj.01-0944rev.
[4] L. Tacchini, L. Bianchi, A. Bernelli-Zazzera, y G. Cairo, «Transferrin Receptor Induction by Hypoxia: HIF-1-MEDIATED TRANSCRIPTIONAL ACTIVATION AND CELL-SPECIFIC POST-TRANSCRIPTIONAL REGULATION *», J. Biol. Chem., vol. 274, n.o 34, pp. 24142-24146, ago. 1999, doi: 10.1074/jbc.274.34.24142.
[5] D. Lovic, P. Narayan, A. Pittaras, C. Faselis, M. Doumas, y P. Kokkinos, «Left ventricular hypertrophy in athletes and hypertensive patients», J. Clin. Hypertens., vol. 19, n.o 4, pp. 413-417, abr. 2017, doi: 10.1111/jch.12977.
[6] G. L. Semenza, «Regulation of Oxygen Homeostasis by Hypoxia-Inducible Factor 1», Physiology, vol. 24, n.o 2, pp. 97-106, abr. 2009, doi: 10.1152/physiol.00045.2008.
[7] «Figura 3. Componentes de la respuesta celular a hipoxia: eritropoyetina…», ResearchGate. https://www.researchgate.net/figure/Figura-3-Componentes-de-la-respuesta-celular-a-hipoxia-eritropoyetina-y-HIF_fig1_339732055 (accedido 2 de febrero de 2023).
[8] «Autophagic Vacuoles (TEM)», Science Source Images. https://www.sciencesource.com/1517016-autophagic-vacuoles-tem.html (accedido 2 de febrero de 2023).
[9] C. Caramelo et al., «RESPUESTA A LA HIPOXIA. UN MECANISMO SISTEMICO BASADO EN EL CONTROL DE LA EXPRESION GENICA», 2006.
[10] «PDB101: Molecule of the Month: Hypoxia-Inducible Factors», RCSB: PDB-101. http://pdb101.rcsb.org/motm/240 (accedido 1 de febrero de 2023).
[11] P. Wagner Grau, «El factor HIF-1 inducido por la hipoxia y la sensibilidad al oxígeno: Rol del hierro intracelular», Acta Médica Peru., vol. 28, n.o 3, pp. 163-168, jul. 2011.
FIGURAS
- Imagen propia, basado en datos: PDB DOI: 10.2210/pdb4ZPK/pdb, created in BioRender.
- C. Caramelo et al., «RESPUESTA A LA HIPOXIA. UN MECANISMO SISTEMICO BASADO EN EL CONTROL DE LA EXPRESION GENICA», 2006
- Imagen propia, basado en datos: R. P. D. Bank, «RCSB PDB – 1IZ3: Dimeric structure of FIH (Factor inhibiting HIF)». https://www.rcsb.org/structure/1IZ3 (accedido 2 de febrero de 2023), created in BioRender.