Por Lidia Parras Ramallo, Javier Rubalcaba Arroyo, Esther Torres Vasalo. 1º Biología Sanitaria, UAH
La Bioquímica es la rama de la Ciencia que centra su estudio en el estado y características de los sistemas bioquímicos. Científicos como Andrey Belousov basaron gran parte de su trabajo experimental en la reproducción de sistemas bioquímicos artificiales que imitaran a los naturales, pero el sistema por excelencia –y que más cercano nos toca– es nuestro propio organismo, pues todas las reacciones metabólicas que ocurren en el cuerpo humano son sujeto de estudio de la Bioquímica. Y esto es así porque el Metabolismo (conjunto de todas las reacciones que ocurren en un organismo vivo y significan una interconversión o producción de energía, formado por la unión del Catabolismo y el Anabolismo) cumple las dos características básicas que esta ciencia estudia: en él intervienen reacciones irreversibles, ciclos autocatalíticos e hiperciclos, de los que depende la generación y mantenimiento del orden estructural y funcional de un sistema bioquímico; y es el sistema por el que el organismo consigue disipar toda la entropía que no puede dejar de producir (produciendo neguentropía, como decía Schrödinger).
Un estudiante de Bioquímica aprenderá sobre entropía, proteínas, metabolismo y enzimología, entre otros. Y eso es lo que nos lleva a exponer en este artículo nuestro estudio sobre una molécula en concreto, participante de una de las rutas biológicas más importantes, y a la que, después de tantas horas de trabajo, le hemos cogido cariño. Hablamos de la acetilcolinesterasa, una enzima animal presente tanto en la sangre como el tejido nervioso humano.
La acetilcolinesterasa, conocida de múltiples otras formas como colinesterasa grupo sanguíneo (AChE), colinesterasa de glóbulo rojo (CGR), colinesterasa eritrocítica o, más formalmente, acetilcolina acetilhidrolasa, fue nombrada por primera vez por Dale en el año 1914, quien ligó la actividad de las acetilcolinesterasas con los tejidos nerviosos. El estudio de su estructura y funcionamiento se realizó inicialmente en la especie Tetronarce californica, un pez cartilaginoso del orden de los Torpediniformes, conocido vulgarmente como raya eléctrica o pez torpedo, donde se consiguió cristalizar la enzima (TcAChE) en 1991 [1].
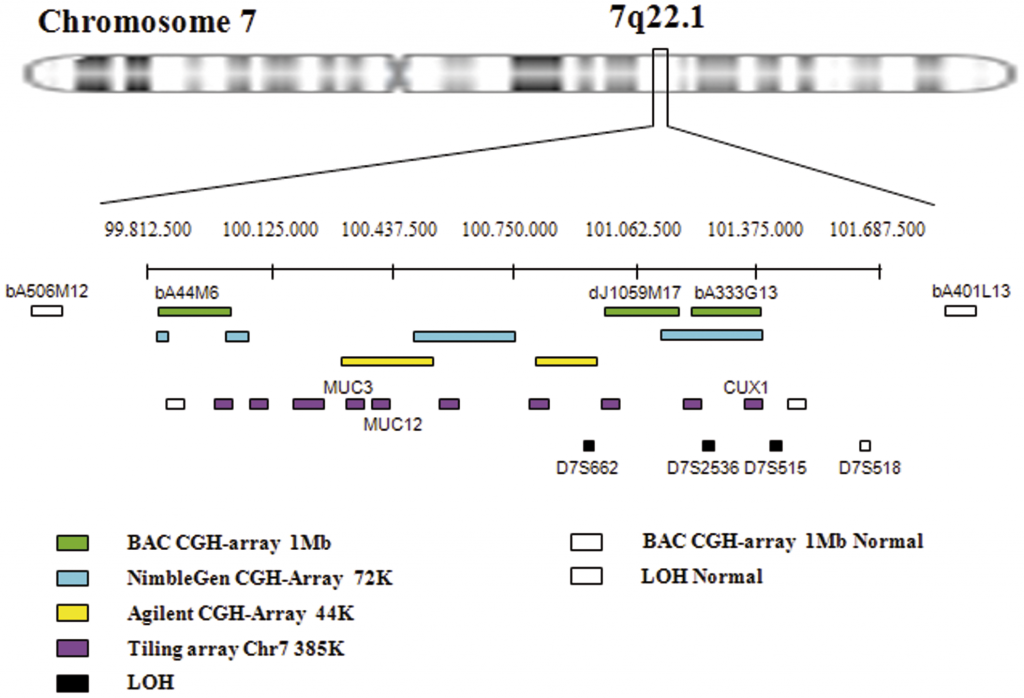
En el ser humano, está codificada por un único gen, el gen ACHE, localizado en el cromosoma 7 (localización cromosómica: 7q22.1) [2]. Procesos de modificación postrascripcionales dan lugar a las distintas subunidades catalíticas de la enzima (existen tres: H, T y S). Sin embargo, no hay diferencias funcionales entre las subunidades, ya que no varía la actividad catalítica o especificidad de sustrato [3].
Pero aún no hemos dicho la función catalítica de la acetilcolinesterasa. Se trata de una enzima hidrolasa (EC 3.1.1.7), por lo que catalizará una reacción de hidrólisis, concretamente la de la acetilcolina, que se romperá generando colina y el ion acetato. Más adelante, veremos la importancia de esta hidrólisis en nuestro organismo, pero ahora pasemos a estudiar en detalle la estructura y composición de la acetilcolinesterasa, a fin de entender mejor su papel biológico.
ESTRUCTURA Y COMPOSICIÓN DE LA ACETILCOLINESTERASA
La acetilcolinesterasa pertenece a la familia de colinesterasas (junto con la pseudocolinesterasa, presente en el hígado), que son esterasas o enzimas que catalizan la rotura por hidrólisis de un enlace éster. Concretamente, es una acetilesterasa, porque la hidrólisis ocurre en un grupo acetilo.
La enzima es un monómero constituido por una sola subunidad, es decir, una sola cadena polipeptídica (chain A) con un N-terminal y un C-terminal [5]. El péptido contiene 614 residuos, entre los que destaca la abundancia de Leu (L), Ala (A), Val (V) y Gly (G), y la poca frecuencia de Trp (W), Met (M) y Cys (C).
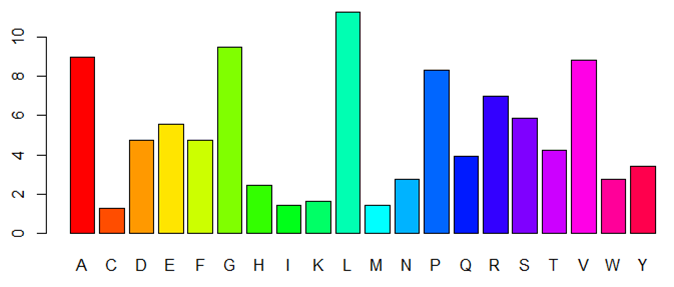
Según los datos recabados acerca de la composición y estructura de la acetilcolinesterasa con el software bioinformático ChimeraX, la enzima posee un total de 4496 átomos, suponiendo un peso molecular total de 67.796 kDa. Además, cuenta con 580 puentes de Hidrógeno. La composición en el aminoácido Cys (C), mostrada en la Figura 3, es de gran importancia, pues es el aminoácido que formará puentes disulfuro, muy fuertes. La AChE posee 7 residuos de Cys, que forman un total de 4 puentes S-S.
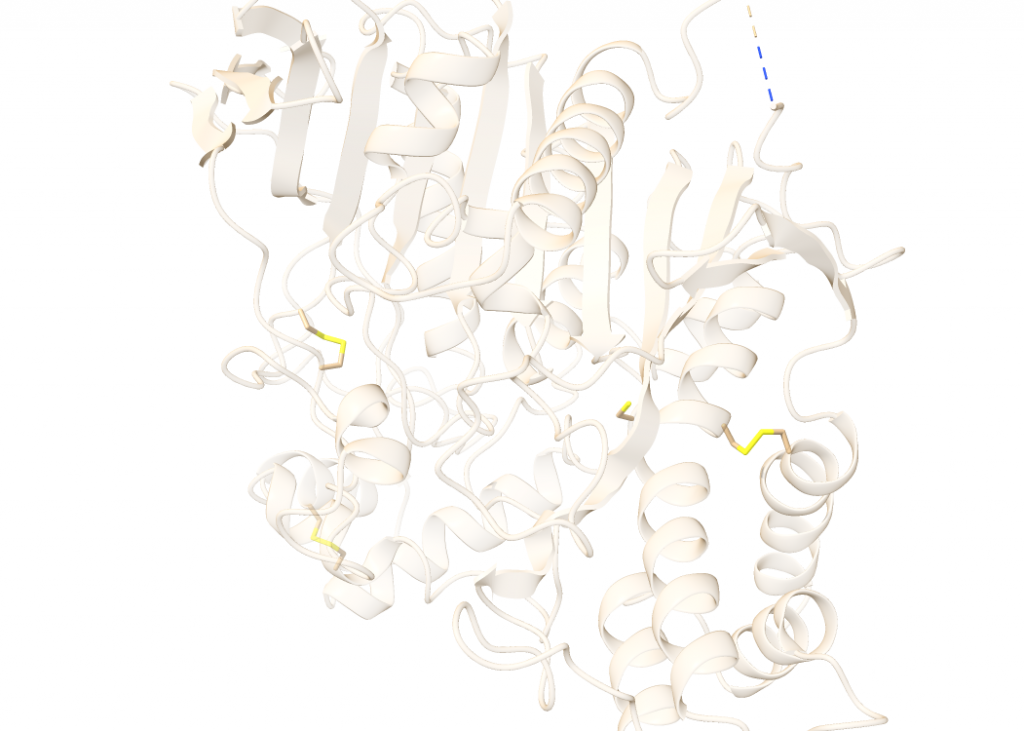
En el plegamiento de una proteína, los puentes de Hidrógeno conducirán la formación de estructuras secundarias, dirigiendo el plegamiento, pero serán los puentes disulfuro los que «sellarán» la estrcutura.
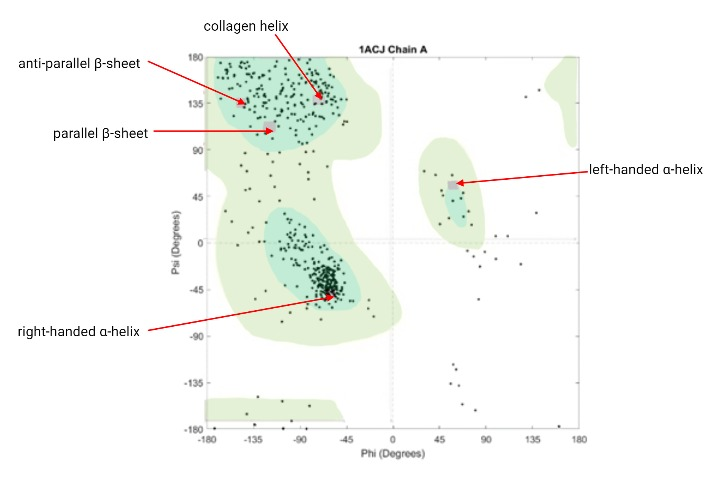
Conociendo su estructura primaria (la secuencia de aminoácidos), podemos inferir sobre la estructura secundaria. Según muestra la representación de Ramachandran de la acetilcolinesterasa, en función de la proporción de ángulos de giro ψ y φ, las zonas de mayor estabilidad para la formación de estructuras secundarias son las de α-hélices levógiras y láminas-β paralelas y antiparalelas.
La acetilcolinesterasa presenta un total de 12 láminas-β trenzadas envueltas alrededor de 14 α-hélices, lo que le confiere un motivo del tipo α/β. [7]

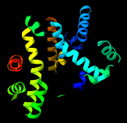
Este motivo es compartido con una gran variedad de enzimas hidrolasas. Tanto es así, que cuando su estructura fue estudiada, se debió discutir su similitud con hasta otras 4 enzimas hidrolasas con plegamiento α/β, como DLH o GLIP [8].
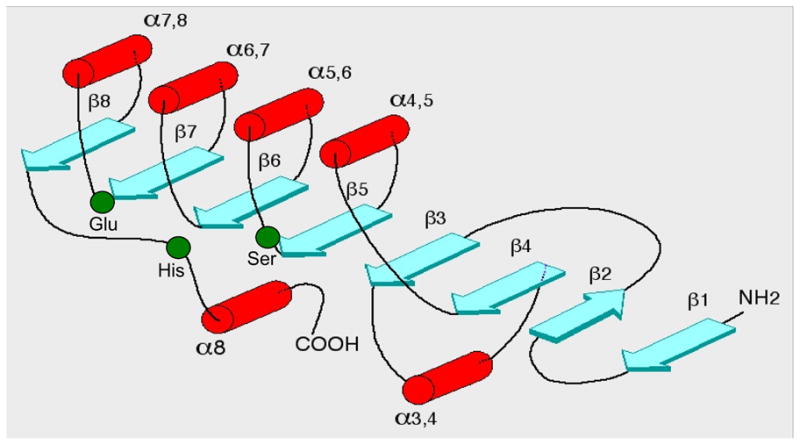
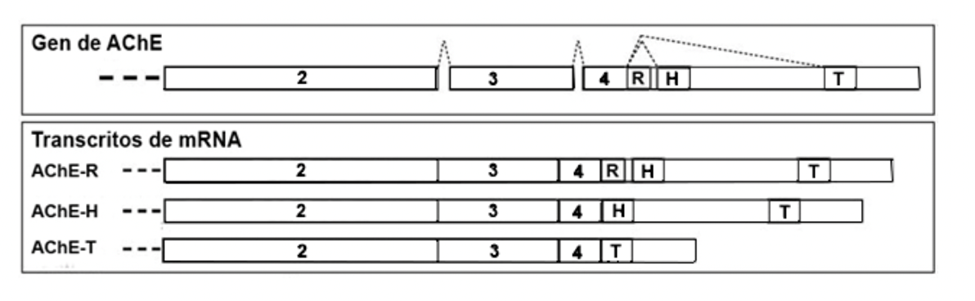
Anteriormente nos referimos a tres subunidades catalíticas de la acetilcolinesterasa, que son ligeramente diferentes en cuanto a estructura. Hablamos de isoformas, es decir, proteínas que realizan la misma función biológica y con el mismo origen genético, pero con una serie de cambios debidos a la duplicación de genes. Estas isozimas son variaciones producidas por splicing alternativo, en el que ocurre una eliminación de segmentos de exones influida por factores ambientales. Estas son: la AChE-R, que se expresa en forma de monómeros en situaciones de estrés y en las neuropatologías; la AChE-E, presente en los eritrocitos; y la AChE-T, que es la localizada principalmente en los procesos de sinapsis. La presencia de alternancia en la AChE determina, en parte, la diversidad funcional de la enzima.
La forma T es la elegida como forma canónica, y toda la información estructural y composicional en este artículo es referida a ella. Las formas H y R difieren de la canónica en alguna porción de la secuencia, que puede estar modificada o ausente. [6]
Como último apunte sobre la estructura, cabe mencionar que la acetilcolinesterasa presenta unas colas pseudo-colagénicas, que son ricas en Lys, y Pro hidroxiladas (en la Figura 3 se muestra la proporción de dichos aminoácidos, abundantes; y en la Figura 5 se observa una concentración de putos relevante en la región de probabilidad de la hélice de colágeno). Como dato adicional, el peso molecular de la acetilcolinesterasa puede aumentar como resultado de la glicosilación que sufren algunos de sus aminoácidos.
MECANISMO
Ahora que conocemos la ordenación atómica y el comportamiento molecular de la acetilcolinesterasa, podemos empezar a estudiar su acción. Al igual que muchas otras enzimas, la AChE realiza, además de su función enzimática como biocatalizador de una reacción (la hidrólisis de la acetilcolina), una función como antígeno en la sangre. Este fenómeno enzimático es conocido como moonlightning, y no son pocas las enzimas que, además de su actividad catalítica, participan en otras rutas metabólicas llevando a cabo otra función diferente a la nativa.
Esto explica la aparición de sitios de unión no concordantes con los sitios activos, pues la molécula es capaz de unirse además a otro ligando diferente a su sustrato nativo. Aun así, nos centraremos tan solo en su papel como hidrolasa.

Como mencionamos anteriormente, las enzimas de la familia de las colinesterasas tienen como función enzimática la catálisis de la hidrólisis del neurotransmisor acetilcolina, que es transformado en colina y ácido acético. Veamos más en profundidad esta reacción:
La acetilcolina tiene como fórmula química C7H16NO2 y, en su forma semidesarrollada es H3C-CO-O-CH2-CH2-N(CH3)3. Es el etanoato de 2-(-NN-trimetil)-etanamonio.
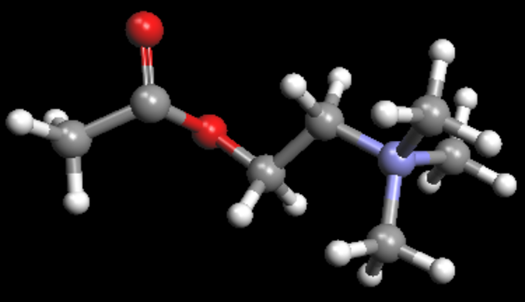
Mediante la catálisis enzimática, que añade una molécula de H2O, se rompe el enlace éster para producir colina (HO-CH2-CH2-NH4+, N,N,N-timetiletanolamonio) y ácido acético (H3C-COOH, ácido etanoico), que en su forma aniónica forma el ion acetato y un protón H+. La reacción es la siguiente:
La reacción que se produce es una substitución nucleofílica, en la que la colina se desplaza de la ACh y el grupo OH de la serina es acetilado. La afinidad nucleofílica se ve alterada por la desprotonación del grupo hidroxilo de la serina mediante una reacción de tipo ácido base, lo que acelera la hidrólisis.
Veamos ahora, ¿dónde en la proteína tiene lugar la hidrólisis de la acetilcolina? Pues, como no puede ser de otra manera, la reacción ocurre en el centro activo de la enzima.
El centro activo, inusualmente profundo para una enzima con tan elevada velocidad catalítica (hasta 25.000 moléculas degradadas por segundo [9]), está compuesto por un sitio aniónico y un sitio esteárico. Mientras que el sitio aniónico tiene carga negativa y ocurre la orientación del sustrato, en el sitio esteárico, con carga positiva, se recibe y cataliza.
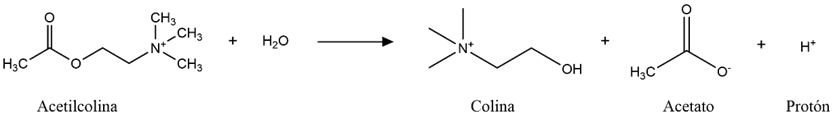
La tríada catalítica del centro activo está formada por Ser-Glu-His (concretamente, por los aminoácidos S200, E327 y H440), algo inusual (por no contener Asp) que la hace parecerse a las proteasas de serina, por lo que la acetilcolinesterasa es comúnmente llamada hidrolasa de serina. El hecho de que el centro aniónico catalítico (CAS) se encuentre al final de una “garganta” (gorge) estructural de 20Å de profundidad permite la diferenciación de un sitio aniónico periférico (PAS), con los aminoácidos Y70, Y121 y W279, que “entrega” el sustrato al CAS. Además, significa que el sustrato (acetilcolina) deberá estar rodeado casi 360º por la enzima para poder ser catalizada, lo que aumenta considerablemente las interacciones moleculares en comparación con otras proteasas de serina.
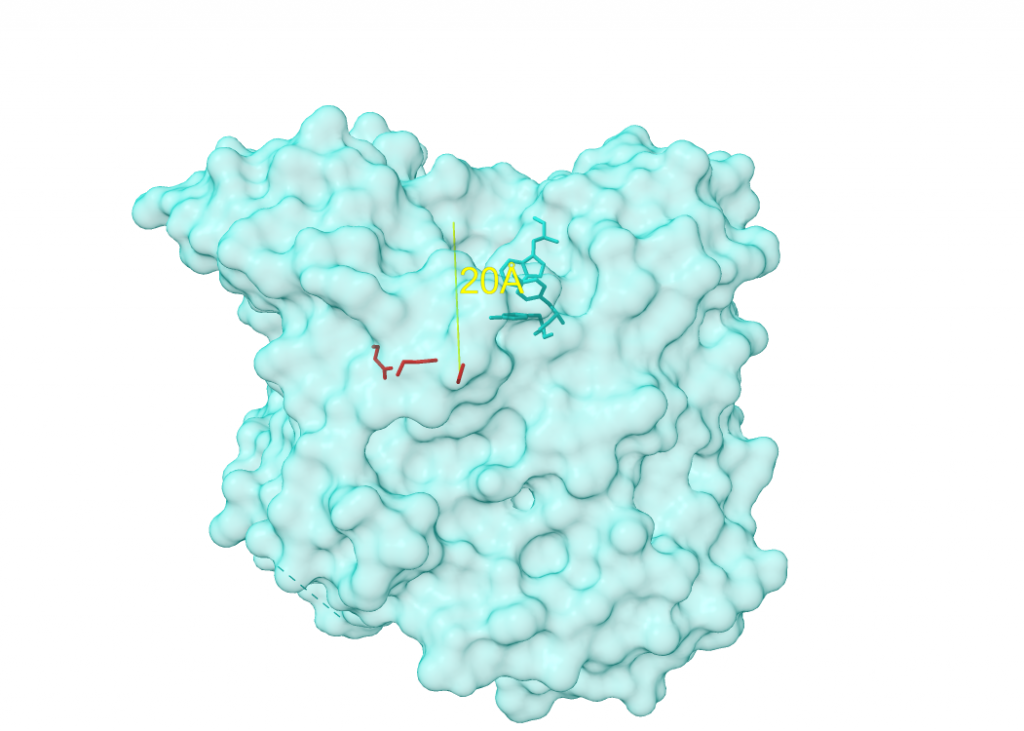
Pero lo singular sobre el centro activo de la acetilcolinesterasa no es solo su profundidad, y lo que ello conlleva. Si analizamos a fondo la estructura del centro activo (los tres aminoácidos catalíticos que lo conforman), vemos la gran importacia que cobra el agua.
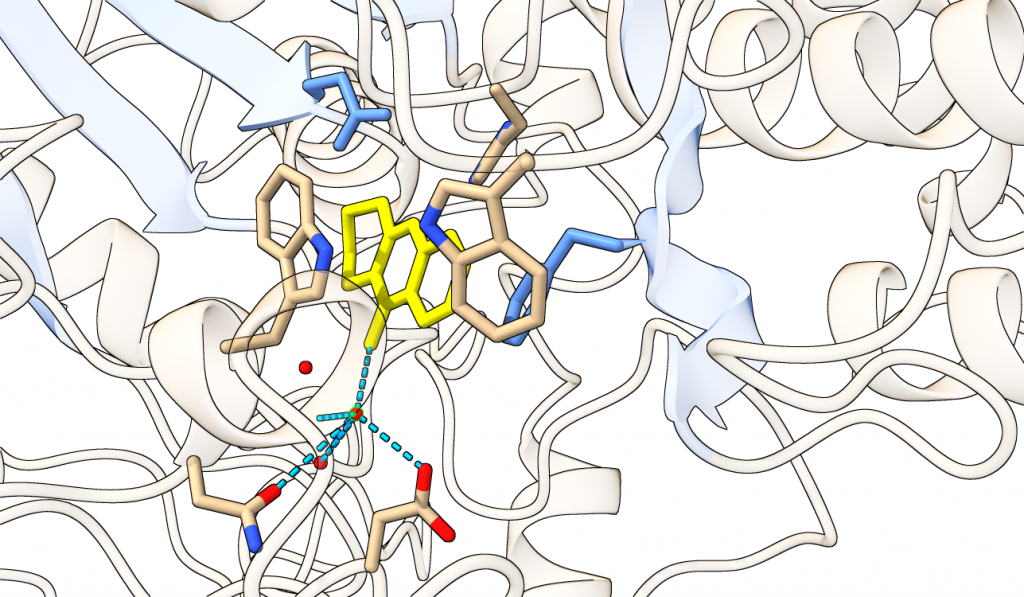
Como observamos en la Figura 12, el agua es un elemento esencial en la estructura y el funcionamiento de la proteína. Y es que, por curioso que resulte, las moléculas de H2O participan directamente en la unión del sustrato al centro activo. Dichas moléculas forman puentes de Hidrógeno con átomos electronegativos de aminoácidos cercanos al centro activo, y de esta manera, se estabilizan en su posición central y evitan la desolvatación sufrida por el resto de moléculas de agua de la molécula (un paso termodinámicamente fundamental en la unión al sustrato). Así, puede formar otro puente de Hidrógeno con el sustrato, asegurando su localización entre los aminoácidos catalíticos. Por tanto, el agua no solo favorece termodinámicamente la unión del sustrato (por desolvatación, efecto hidrofóbico y disipación de entropía), sino que participa directamente formando los enlaces necesarios para que la localización del sustrato sea la correcta.
INHBIDORES DE LA AChE
Los inhibidores de acetilcolinesterasa (AChEIs) previenen la catálisis de la degradación de la acetilcolina en colina y acetato.
Existen inhibidores reversibles e irreversibles. Los primeros se emplean en la farmacología como tratamiento para patologías como el Alzheimer. Ejemplos de inhibidores reversibles incluyen Rivastigmine, que se une al sitio esteárico; Donepezil, que se une al PAS; y Galantamine, que es competitivo y se une al sitio aniónico.
Los inhibidores irreversibles son compuestos organofosfóricos (OPs) que fosforilan las esterasas (la AChE entre ellas). La unión irreversible que forman con el centro activo se debe a que son ligandos no nativos de la proteína, por lo que se unen a la Ser. Son tóxicos de gran relevancia por la inactivación irreversible que ejercen sobre la acetilcolinesterasa.
No obstante, cabe recalcar que el mecanismo de acción de los compuestos organofosforados no siempre será irreversible, puesto que estos podrán llevar a cabo también una inhibición reversible y competitiva, como es el caso de muchos organofosforados empleados como plaguicidas, método que se detallará posteriormente.
De este modo, los organofosforados podrán ser: inhibidores prostéticos, que reaccionan con los centros aniónicos (efecto competitivo y reversible); inhibidores oxiadopóricos (reversibles o irreversibles) y ésteres orgánicos del ácido sulfúrico, que son poco empleados.
Las consecuencias de la inhibición de esta enzima son el aumento de concentración y duración de la acetilcolina en el sistema nervioso central, afectando a la correcta transmisión del impulso nervioso. [10]
Solo ahora, que conocemos en profundidad cómo funciona nuestra enzima, podemos estudiar el importante papel que juega en nuestro organismo.
PAPEL BIOLÓGICO DE LA ACETILCOLINESTERASA
Como función relevante de la AChE, hemos destacado la de hidrolizar a la acetilcolina, un neurotransmisor que ejerce su acción en regiones del sistema nervioso central, los ganglios periféricos y la placa neuromuscular, tras su liberación durante las sinapsis colinérgicas.
Recuerda que la sinapsis es la forma de comunicación entre los componentes del sistema nervioso (las neuronas) y también con el resto del organismo, al que transmiten los impulsos nerviosos. En este caso, al tratarse de una sinapsis colinérgica hablamos de una comunicación química mediada por neurotransmisores que son las acetilcolinas. Los neurotransmisores son liberados por exocitosis al espacio sináptico tras la entrada masiva de Ca2+ a la neurona presináptica cuando el potencial de acción llega al nivel sináptico. Posteriormente, los receptores específicos de acetilcolina captan los neurotransmisores, que pasan a la neurona postsináptica. Se abren canales de Na+ que despolarizan la neurona postsináptica y el impulso nervioso es propagado por el axón. [14][15]
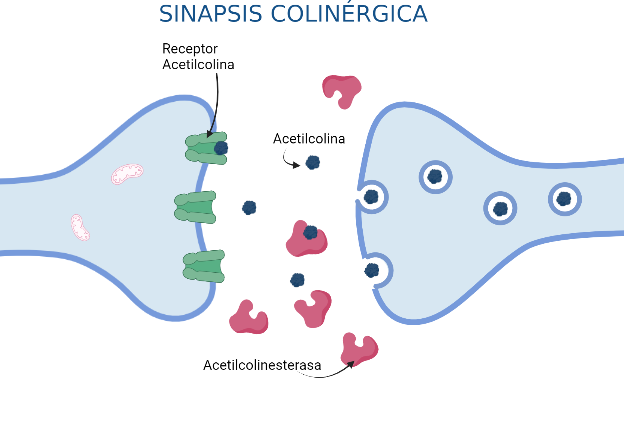
Podemos decir que la acetilcolinesterasa es la enzima que pone fin al efecto de la acetilcolina como neurotransmisor, es su regulador de concentración. De este modo podemos decir que actúa como inhibidor disminuyendo la degradación de acetilcolina, pero también evitando la formación de placas beta-amiloide, causantes de enfermedades neurodegenerativas. [12][13]
Como funciones adicionales a su papel en la sinapsis colinérgica encontramos la participación en procesos de desarrollo y también de adhesión celular ya que su secuencia de aminoácidos presenta un dominio de adhesión.
Uno de los alicientes de la diversidad funcional de la enzima es su presencia en estados prematuros del desarrollo embrionario, antes de la sinaptogénesis, lo que apunta a que esta no es su única actividad. Posteriormente se ha encontrado en neuronas adultas no relacionadas con la acetilcolina, en tejidos no neuronales en desarrollo, también en tejido hematopoyético, el endotelio de los vasos sanguíneos, la glía y células neoplásicas [11].
Por otra parte, en células nerviosas en cultivo se ha observado que la AChE fomenta el crecimiento de las neuritas (prolongaciones de las neuronas en contacto con células musculares, glandulares, …, de las cuales salen los impulsos nerviosos). Además, se ha demostrado que existen isoformas de la enzima, en este caso, AChE-S que no son capaces de realizar la hidrólisis de la ACh, pero sí pueden promover el crecimiento neurítico, lo que demuestra que una acción es independiente de la otra.
La adhesión celular se presenta también como una función no catalítica de la AChE, la cual es explicada por la presencia de un dominio similar al de proteínas relacionadas con la adhesión como la glutactina, la neurotactina, la gliotactina y las neuroliginas. Durante los últimos años se han encontrado proteínas de membrana sin actividad enzimática, pero con un dominio extracelular con una secuencia de aminoácidos equivalente a la de la AChE con función en la formación y diferenciación de uniones celulares, lo que evoca la participación de la AChE en los procesos de adhesión tanto en el desarrollo como en interacciones entre las neuronas y la glía.
En el papel biológico de la enzima hemos de destacar también su participación en enfermedades neuropatológicas como son el Alzheimer, el Parkinson y la miastenia gravis, debido a cambios de su concentración o de sus propiedades, información que se encontrará más detallada en el apartado de aplicaciones biomédicas.
IMPLICACIONES BIOMÉDICAS DE LA ACETILCOLINESTERASA
La acetilcolinesterasa presenta una gran importancia biomédica altamente conectada a sus funciones biológicas y en relación con su estructura, actividad y cantidad en las células y en el organismo. A lo largo de las diversas patologías podremos observar que esta enzima no solo es una participante fundamental en la aparición de diversas enfermedades, sino que además puede emplearse como indicador de diversas patologías, puesto que anomalías en su conformación, función, concentración o actividad son comúnmente empleadas en el diagnóstico de estas.
Como se ha explicado anteriormente, una característica fundamental de la acetilcolinesterasa (AChE) es que en vertebrados solamente existe un único gen que codifique esta proteína. De este modo, no se han demostrado evidencias de patologías causadas por defectos en la estructura del propio gen que la codifica. No obstante, sí se ha encontrado una relación entre anomalías en los componentes del llamado “operador colinérgico”, encargado de la síntesis, degradación y recepción celular de la acetil-colina, y algunas patologías. A su vez, si bien las mutaciones de la AChE no provendrían directamente de modificaciones estructurales a nivel genético, sí que pueden tener lugar alteraciones en la expresión de dicho gen, o errores en las modificaciones post-transcripcionales y post-traduccionales de la AChE que pueden provocar cambios con consecuencias patológicas.
Esta elevada relación entre la AChE y las patologías humanas permite que el estudio de su concentración, función, conformación y actividad o inhibición de esta en las células pueda ser indicativo de enfermedades y, por tanto, de utilidad en su diagnóstico y detección temprana.
De este modo, modificaciones en los parámetros previamente descritos de la acetilcolinesterasa son empleadas en el estudio y diagnóstico de patologías neurodegenerativas (Alzheimer, Parkinson, miastenias, etc.). También es empleada en oncología, sugiriéndose una relación entre la tumorogénesis (control del ciclo celular, apoptosis, diferenciación y metástasis en las células cancerígenas) especialmente en el control de la progresión del cáncer de ovario; y en la detección de defectos en el tubo neural durante el desarrollo embrionario. Por último, confirmando una vez más la relación entre la salud física y mental, a través del estudio de enfermedades asociadas al estrés, como la ansiedad, se ha podido demostrar el impacto e implicación que la AChE en el bienestar mental y emocional.
Así, podremos dividir las implicaciones biomédicas de la acetilcolinesterasa en el surgimiento y diagnóstico de patologías en varios grupos principales.
IMPLICACIÓN BIOMÉDICA DE LA ACETILCOLINESTERASA EN ENFERMEDADES NEURODEGENERATIVAS
Las alteraciones en la acetilcolinesterasa están altamente relacionadas con varias neuropatologías, debido a su función e intervención crucial en la transmisión del impulso nervioso a través de la sinapsis tanto en el sistema nervioso central (SNC) como el periférico (SNP).
Puede que estas patologías sean el principal foco de estudio biomédico en relación con esta proteína, puesto que entre ellas se encuentran enfermedades comunes y crónicas como son el Alzheimer o el Parkinson.
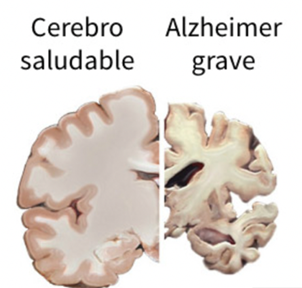
El Alzheimer es una neuropatología caracterizada sintomáticamente por la pérdida progresiva de la memoria, funciones cognitivas y la orientación. Esta conlleva además un proceso inflamatorio que desencadena un mal funcionamiento de la sinapsis y la muerte neuronal.
Si bien su origen aún no está científicamente demostrado y se cree que en este pueden intervenir un gran número de factores, entre estos se destaca la alteración de las neurotransmisiones colinérgicas. Estas consisten en todos los procesos de sinapsis en los que interviene la acetilcolina como neurotransmisor.
En los años 80 se define la “hipótesis colinérgica” que se relaciona con la enfermedad a través de los siguientes descubrimientos. En 1976 se establece un punto de partida pues se descubre la conexión entre el aumento de la muerte de neuronas productoras de acetilcolina y dicha patología, que se confirma en 1985 al observar un mayor desarrollo de la enfermedad ante la pérdida de los receptores de acetilcolina. Finalmente, en 1990 S.T. DeKosky y S.W. Scheff establecen la relación entre el Alzheimer y las modificaciones estructurales de las transmisiones colinérgicas.
De esta manera, dicha hipótesis concluye que la disminución de la acetilcolina en aquellas regiones del cerebro relacionadas con la memoria o el aprendizaje es una de las causas principales del Alzheimer.
Como consecuencia, la estructura y concentración de la acetilcolinesterasa también se ve modificada en dichas regiones, dificultando su papel en la sinapsis. Se aprecia una especial disminución de las formas G4: formas moleculares de la acetilcolinesterasa ancladas a las terminales axónicas.
En el Alzheimer destacan la formación de placas seniles o amiloides y ovillos neurofibrilares, que originan la muerte neuronal.
En 2003, T.M. Rees y S.Brimijoin llevaron a cabo un cruce de dos tipos de ratones transgénicos (el primero para el péptido amiloide humano y el segundo para la acetilcolinesterasa). Se observó que las crías de estos ratones desarrollaban estas placas seniles entre un 30 y un 35% más rápido que los progenitores.
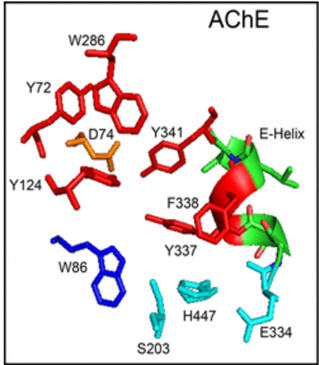
Se ha observado que, de este modo, el PAS (centro aniónico periférico) de esta enzima facilitaría la aparición de un entorno hidrófobo a su alrededor que favorecerá el plegamiento y agregación de los péptidos amiloides. En 1999 se descubre que los complejos AChE-Aβ tienen una mayor toxicidad que los complejos formados sin la intervención de la acetilcolinesterasa.
En esta patología se han identificado anomalías en la afinidad del enzima causadas por modificaciones en el plegamiento de esta.
Por último, también determinante en el desarrollo del Alzheimer y otras neuropatologías, se ha descubierto la implicación de la AChE en la apoptosis de las neuronas que, como se ha explicado previamente, es una de las principales causas asociadas a la enfermedad.
LA TACRINA Y MÉTODOS PARA RALENTIZAR EL AVANCE DE LAS NEUROPATOLOGÍAS
Con la investigación y estudio de las enfermedades neurodegenerativas, especialmente centradas en el Alzheimer, surgen diversos métodos para tratar de prevenir o ralentizar el avance de la enfermedad una vez diagnosticada. Entre estos encontramos los tratamientos con precursores de acetilcolina, tratamientos con agentes liberadores de acetilcolina (ambos tratamientos con el fin de favorecer una mayor transmisión del impulso nervioso para combatir las causas y, por tanto, los efectos de la enfermedad), tratamientos con agonistas colinérgicos (estos estimularán la neurotransmisión mediante sinapsis colinérgica), etc. No obstante, los medicamentos empleados con mayor frecuencia serán las sustancias inhibidoras de la acetilcolinesterasa.
Inicialmente se emplearía la fisostigmina, observándose cierta mejoría, pero de corta duración. De este modo, pasaría a ser mayoritariamente sustituida por la tacrina al tener sus efectos una mayor duración.
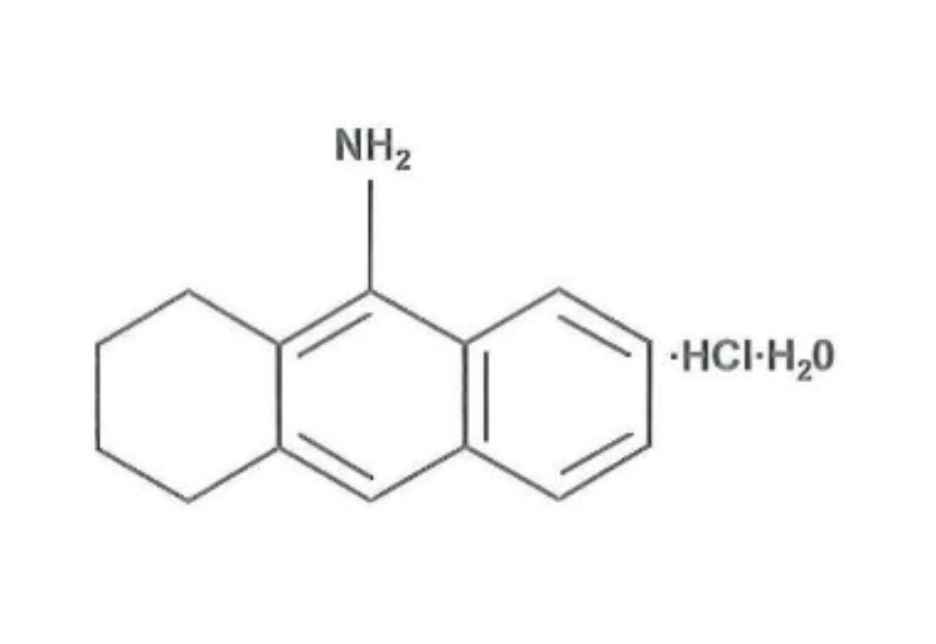
La tacrina (9-amino- 1,2,3,4 -tetrahidroaminoacridina) es un inhibidor de la acetilcolinesterasa que actúa sobre la región hidrófoba del área gamma aniónica de las enzimas (su centro PAS). Esta llevará a cabo una inhibición no competitiva, lo que favorece su acción más prolongada frente a inhibidores competitivos, pero reversible, por lo que su acción no será permanente, de ahí que los efectos no sean tan duraderos.
De este modo, al unirse al centro activo catalítico de la AChE, esta inhibirá su función, prolongando la transmisión de la sinapsis colinérgica, además encontrarse una relación entre su actividad y el aumento la concentración de acetilcolina en el líquido cefalorraquído.
A pesar de que su reacción nativa será la inhibición de la acetilcolinesterasa, esta enzima presentará la propiedad de moonlighting, dirigiendo e interviniendo en distintos tipos de reacciones. Entre las principales encontramos el bloqueo de los canales de sodio y potasio, facilitando y prolongando la entra de calcio, y así, interviniendo en la transmisión del impulso nervioso; una relación con las variaciones en concentraciones de receptores nicotínico y muscarínicos; aumentos en el metabolismo cerebral de la glucosa; actividades inmunosupresoras por la regulación negativa de los linfocitos NK (natural Killers); y, inhibición en la liberación de compuestos como el aspartato o el glutamato, relacionados con la actividad cerebral.
IMPLICACIÓN BIOMÉDICA DE LA ACETILCOLINESTERASA EN EL CÁNCER
La acetilcolinesterasa se ha encontrado modificada a nivel estructural y funcional en diversos carcinomas, lo que permite destacar a estas enzimas como indicadores de fallos en la regulación de la proliferación y ciclo celular.
Las modificaciones en esta enzima se observan principalmente en leucemias, carcinomas de ovarios y tumores cerebrales o del sistema nervioso (siendo estos últimos también afectados por colinesterasas con propiedades anormales).
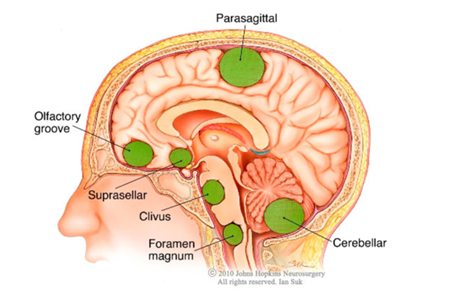
Los meninginomas y neurinomas son los tumores que más información han aportado sobre la influencia del acetilcolinesterasa en estos tumores. Además sus cambios en la composición u estructura varían en función del tipo de tumor, lo que puede ser un indicante no solo de posibles células cancerígenas, sino que también para la identificación del tipo tumoral.
Además, en tumores de mama se ha hallado un aumento de la actividad de la AChE. No obstante, la metástasis de este tipo de tumor a los nódulos linfáticos provoca un cambio brusco o decaída de la actividad de esta.
Si bien en estos casos anteriores se muestra cómo las variaciones en la concentración, actividad y estructura permiten emplear estas enzimas como indicadores de tumores y carcinomas, se cree que estas podrían estar también relacionadas con la causa de estos. Esto se debería a la relación e influencia de la AChE con el control de la proliferación, diferenciación y adhesión celular.
A su vez, se debe destacar su papel fundamental en la apoptosis, que se ha mencionado en el apartado anterior por su influencia en la muerte neuronal y las neuropatologías. La acetilcolinesterasa tiene en su mayoría una expresión y actividad en los estadios tempranos de la apoptosis.
Esta influencia se descubriría a raíz del empleo de inhibidores de la AChE. Al emplear estos fármacos, se garantizaba la supervivencia de la célula. Del mismo modo, mediante el empleo de sustancias como oligonucleótidos, se ha podido regular la expresión de la AChE en células, deteniéndola, provocando el mismo efecto de viabilidad de las células.
Un dato muy relevante relacionado con la influencia de la acetilcolinesterasa y el cáncer nos mostraría el motivo por el cual se considera que mucho pesticidas son perjudiciales para la salud.
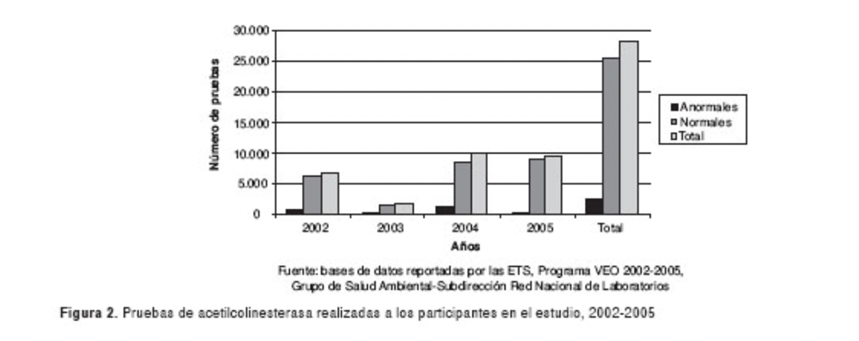
Los pesticidas son inhibidores de la acetilcolinesterasa. Por ello, en zonas de alta actividad agrícola se ha determinado una mayor tasa de leucemias y lonfomas no Hodgkins. Esto se debería a que, al estar expuestos a un inhibidor de la AChE, se inhibiría también el proceso de apoptosis celular, fomentando una división celular y proliferación descontrolada que podría originar en tumores cancerígenos. Esto se observa en la siguiente gráfica obtenida a partir de la base de datos reportadas por las ETS, Programa VEO 2002-2005 (grupo de Salud Ambiental-Subdirección Red Nacional de Laboratorios). En ella encontramos la incidencia de valores anormales de AChE en zonas agrícolas de Colombia.
Entre los distintos tipos de plaguicidas empleados, especialmente a partir de los años 60, podemos destacar los plaguicidas organoclorados. Estos eran altamente agresivos en la salud humana, puesto que, debido a su alto uso y exposición hacia los seres humanos, se detectaron un gran número de patologías asociadas a este, especialmente relacionadas con el cáncer o la capacidad reproductiva.
Como sustitución, comenzarían a emplearse los plaguicidas organofosforados. La exposición hacia estos plaguicidas puede tener lugar tanto en el ámbito agricultor, como en la contaminación del suelo, ropa, alimentos y otros objetos. Las diversas vías de contaminación por plaguicidas se deben a que estas pueden entrar en el organismo por vía cutánea, respiratoria o digestiva.
Estos insecticidas no solo dañarán a estos animales, sino también a los humanos, puesto que son inhibidores de la acetilcolinesterasa. Al inhibirla, favorecerán la actividad de la acetilcolina. Si esta inhibición es continua y persistente, se observará una activación de receptores nicotínicos, lo que dará lugar a temblores, convulsiones, parálisis muscular y finalmente, la muerte.
PATOLOGÍAS RELACIONADAS CON EL DESARROLLO EMBRIONARIO
Durante el desarrollo embrionario pueden surgir malformaciones congénitas como por fallos en el cierre del tubo neural. Estas serían principalmente las anencefalias y las espinas bífidas.
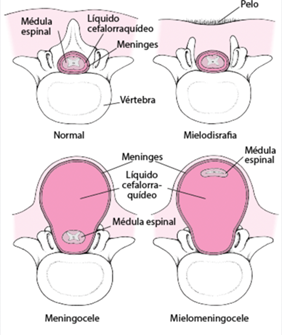
Para detectar este tipo de patologías se emplean pruebas de diagnóstico a partir de parámetros medidos en el líquido amniótico. Uno de estos es la actividad de la AChE, que aumenta especialmente ante defectos en la formación del tubo neural. El método de diagnóstico se lleva a cabo mediante electroforesis, puesto que es el único que evita la aparición de falsos positivos. Ante el aumento de la actividad de la acetilcolinesterasa, en dicho gel de electroforesis aparecerá una banda específica que indicaría la anomalía.
CONCLUSIÓN
Como se ha mencionado anteriormente, la acetilcolinesterasa, colinesterasa caracterizada por la hidrólisis del grupo éster de la acetilcolina, formada por motivos del tipo α/β, es una enzima trascendental del organismo.
Hemos visto que dado su paso por modificaciones postraduccionales se obtienen distintas subunidades catalíticas, también hemos podido observar la inusual estructura de su centro activo, la importancia del agua en las uniones y el surgimiento de distintas isoformas.
A lo largo del estudio se han podido destacar además las diferentes funciones que desempeña esta enzima, dando relevancia a la hidrolisis del neurotransmisor acetilcolina en la sinapsis colinérgica, su colaboración en procesos de desarrollo y de adhesión celular y, en temas biomédicos, su participación en enfermedades neurodegenerativas como el Alzheimer o el Parkinson e incluso con el cáncer, pero también su utilidad en diagnóstico y detección temprana.
Su importancia biomédica y biológica recae en su diversa funcionalidad y se relaciona también con su estructura, actividad y concentración, es por ello que es fundamental el estudio de su estructura, composición y mecanismo anteriormente citado.
Tras este detallado paso por los principales aspectos de la enzima acetilcolinesterasa podemos concluir que se trata de una proteína enzimática con gran relevancia para nuestro organismo dada su presencia como participante en diversos procesos metabólicos que en él ocurre.
Puede que haya pasado más de un siglo desde que se hablara por primera vez de ella, pero lo que queda claro después de este artículo es que la acetilcolinesterasa aún tiene mucho más que contar y descubrir.
REFERENCIAS
[1] Silman, I., & Sussman, J. L. (2008). Acetylcholinesterase: how is structure related to function?. Chemico-biological interactions, 175(1-3), 3-10.
[2] Ehrlich, G., Viegas-Pequignot, E., Ginzberg, D., Sindel, L., Soreq, H., & Zakut, H. (1992). Mapping the human acetylcholinesterase gene to chromosome 7q22 by fluorescent in situ hybridization coupled with selective PCR amplification from a somatic hybrid cell panel and chromosome-sorted DNA libraries. Genomics, 13(4), 1192-1197.
[3] Boison, D. (2007). Acetylcholinesterase. In xPharm: The Comprehensive Pharmacology Reference (pp. 1-8). Elsevier Inc.. https://doi.org/10.1016/B978-008055232-3.60539-2
[4] Robledo, C., Garcia, J. L., Benito, R., Flores, T., Mollejo, M., Martínez-Climent, J. Á., … & Hernandez, J. M. (2011). Molecular characterization of the region 7q22. 1 in splenic marginal zone lymphomas. PloS one, 6(9), e24939.
[5] Sussman, J. L., Harel, M., Frolow, F., Oefner, C., Goldman, A., Toker, L., & Silman, I. (1991). Atomic structure of acetylcholinesterase from Torpedo californica: a prototypic acetylcholine-binding protein. Science, 253(5022), 872-879.
[6] Uniprot entry for P22303 · ACES_HUMAN. UniProt. (n.d.). Retrieved January 29, 2023, from https://www.uniprot.org/uniprotkb/P22303/entry
[7] Dvir, H., Silman, I., Harel, M., Rosenberry, T. L., & Sussman, J. L. (2010). Acetylcholinesterase: from 3D structure to function. Chemico-biological interactions, 187(1-3), 10-22.
[8] Ollis, D. L., Cheah, E., Cygler, M., Dijkstra, B., Frolow, F., Franken, S. M., … & Goldman, A. (1992). The α/β hydrolase fold. Protein Engineering, Design and Selection, 5(3), 197-211.
[9] Quinn, D. M. (1987). Acetylcholinesterase: enzyme structure, reaction dynamics, and virtual transition states. Chemical reviews, 87(5), 955-979.
[10] Colovic, M. B., Krstic, D. Z., Lazarevic-Pasti, T. D., Bondzic, A. M., & Vasic, V. M. (2013). Acetylcholinesterase inhibitors: pharmacology and toxicology. Current neuropharmacology, 11(3), 315-335.
[11] Sánchez-Chávez, G., & Salceda, R. (2008). Enzimas Polifuncionales: El caso de la acetilcolinesterasa. Revista de Educación Bioquímica, 27(2), 44-51.
[12] Serrano, H. F. (2014). Comité Tutoral (Doctoral dissertation, Universidad Autónoma Metropolitana).
[13] Moreno, T., & De La, J. M. (2016). Diseño basado en la estructura. Fundamentos y un caso práctico.
[14] Lira, C., & Vivanco, M. (2018). Sinapsis y neurotransmisores.
[15] Parra, J. E. D., Parra, G. M., & Parra, C. A. D. (1997). Las sinapsis. Medicina, 19(2), 41-48.
[16] Cheung, J., Gary, E. N., Shiomi, K., & Rosenberry, T. L. (2013). Structures of human acetylcholinesterase bound to dihydrotanshinone I and territrem B show peripheral site flexibility. ACS medicinal chemistry letters, 4(11), 1091-1096.
[17] Cárdenas, O., Silva, E., & Ortiz, J. E. (2010). Uso de plaguicidas inhibidores de acetilcolinesterasa en once entidades territoriales de salud en Colombia, 2002-2005. Biomédica, 30(1), 95-106.
[18] DeKosky, S. T., & Scheff, S. W. (1990). Synapse loss in frontal cortex biopsies in Alzheimer’s disease: correlation with cognitive severity. Annals of Neurology: Official Journal of the American Neurological Association and the Child Neurology Society, 27(5), 457-464.
[19] Rees, T. M., & Brimijoin, S. (2003). The role of acetylcholinesterase in the pathogenesis of Alzheimer’s disease. Drugs of today (Barcelona, Spain: 1998), 39(1), 75-83.
[20] Sanabria-Castro, A., Alvarado-Echeverría, I., & Monge-Bonilla, C. (2017). Neurotransmisión Colinérgica Central: Aspectos Moleculares. Revista Mexicana de Neurociencia, 18(2), 76-87.
[22] Moreno, P. M. (2012). Estudio de las propiedades de acetilcolinesterasa y butirilcolinesterasa en el tejido pulmonar humano y sus alteraciones en distintos tipos histológicos de cáncer de pulmón de células no pequeñas (Doctoral dissertation, Universidad de Murcia).
[23] Castillo González, A. C. (2016). Estudio de las propiedades de las colinesterasas en epitelios de las vías aéreas superiores humanas y sus alteraciones en el cáncer. Proyecto de investigación:
[24] Davila, C., Viteri, C., & de Castro, P. (1997). Tacrina. Revista de Medicina de la Universidad de Navarra, 58-64.
[25] Yucra, S., Gasco, M., Rubio, J., & Gonzales, G. F. (2008). Exposición ocupacional a plomo y pesticidas órganofosforados: efecto sobre la salud reproductiva masculina. Revista Peruana de medicina experimental y salud pública, 25(4), 394-402.


