INMERSIÓN EN EL MUNDO DE LA ACONITASA
Samuel Cabello del Cerro y Jorge Carrera Chamorro. Sep 2022/Feb 2023, 1º Biología Sanitaria – UAH
Durante estos últimos meses han llegado a nuestras localidades varias festividades muy importantes y reconocidas mundialmente. En octubre, pudimos disfrutar de una de las fiestas populares americanas más multitudinarias, como es Halloween, donde la gente se atrevió a llevar tanto los disfraces más típicos como algunos más escalofriantes, y que todo los años nos llegan a sorprender. Llegó la Navidad en diciembre y nos tuvimos que desenfundar nuestras mejores vestimentas para poder dar la bienvenida al nuevo año; sí, aquel en el que nos marcamos una serie de propósitos que olvidamos en el segundo día de enero. Otra de las festividades que también solemos disfrutar es el Carnaval, en febrero, la cual siempre nos brinda una alegría y tiñe de color la recta final del invierno.

Si nos damos cuenta, durante todo el año vamos «disfrazándonos»; cambiando de traje según la festividad. Al igual que nosotros cambiamos de la ropa de vestir del día a día al, por ejemplo, disfraz de Carnaval, las proteínas también son capaces de hacerlo. Estas proteínas realizan su función, pero en ocasiones cambian de disfraz para realizar otras totalmente distintas. Es lo que se conoce como proteínas como función «moonlighting», de la cual hablaremos a partir de una de sus principales representantes: la aconitasa.

Fuente de la imagen: Wikipedia
PAPEL BIOLÓGICO
La aconitasa es una enzima que pertenece a la familia de las hidrolasas, pero solo aquellas que son dependientes de un centro ferro-sulfurado. Su principal función se encuentra relacionada con las reacciones de isomerización de los beta-hidroxiácidos.
Concretamente, la aconitasa cataliza la isomerización del citrato en isocitrato a través de una alternancia sucesiva entre una deshidratación y una hidratación. El resultado de dicha alternancia produce un metabolito intermediario, el cis-aconitato, que proviene del ácido aconítico. Este proceso ocurre principalmente durante el ciclo de Krebs, ciclo del ácido cítrico o ciclo de los ácidos tricarboxílicos, siendo considerada la aconitasa como la segunda enzima en actuar en este ciclo.
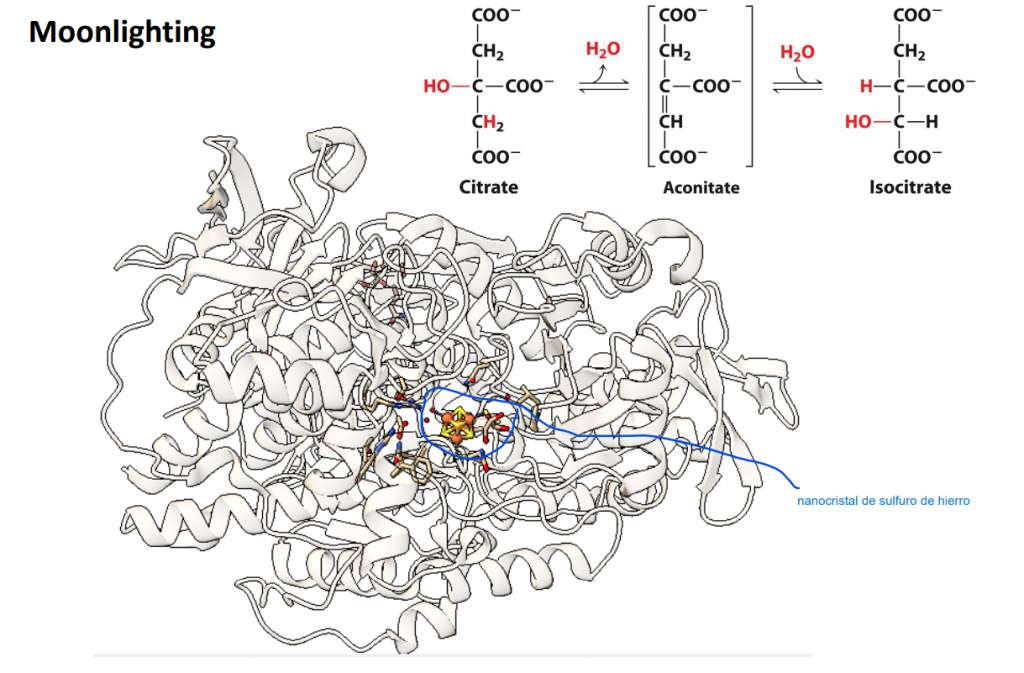
Una de las curiosidades que nos encontramos al observar la molécula de la aconitasa es que podemos tener dos variantes de ella en las células eucariotas. Estas están codificadas por distintos genes. Diferenciamos la aconitasa 1 (ACO1 o c-aconitasa), la cual es una enzima citosólica, y la aconitasa 2 (ACO2 o m-aconitasa), que es una enzima mitocondrial. Estas aconitasas son inactivadas reversiblemente mediante estrés oxidativo. Su actividad en las células y tejidos ha sido usado como biomarcadores frente al daño oxidativo.
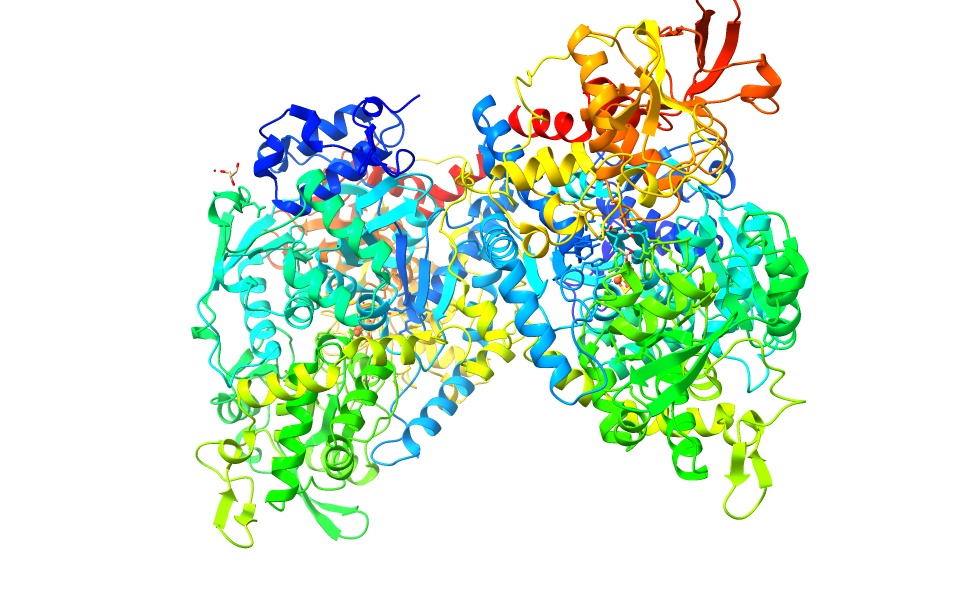
Imagen creada con ChimeraX a partir de PDB 2b3y
Chamorro
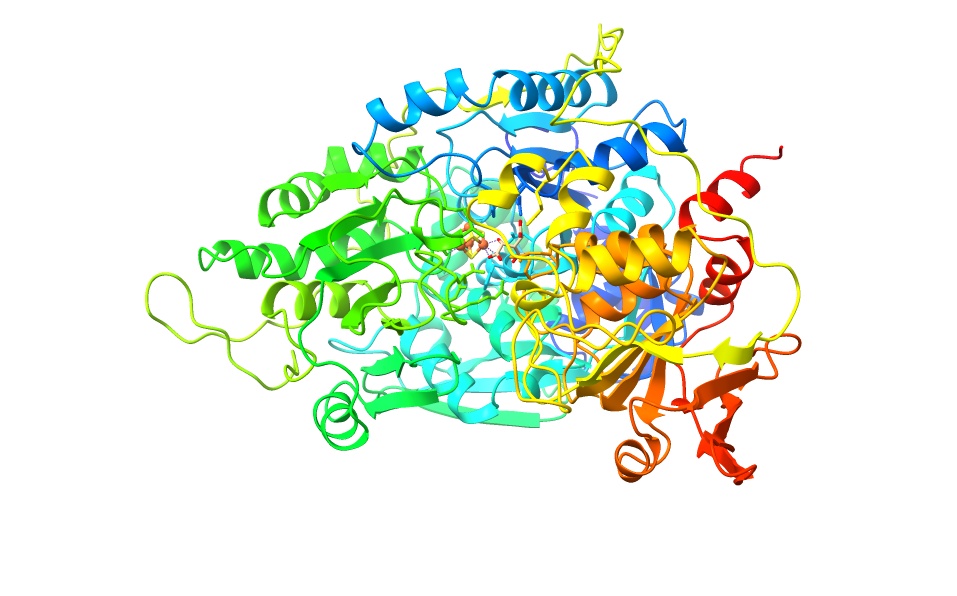
Imagen creada con ChimeraX a partir de PDB 7ACN
En muchos organismos encontramos que en la enzima citosólica existe un dominio denominado como el dominio ACO (cAc al ser citosólicas). Sin embargo, en el caso concreto de los organismo eucariotas se descubrió que se había introducido una segunda copia de la aconitasa. Esta copia es la que daría lugar a la aconitasa mitocondrial. En las plantas existen una mayor abundancia de estas copias de la aconitasa en la mitocondrias. Ambas moléculas son isoenzimas, es decir, enzimas que son diferentes en cuanto a la secuencia de sus aminoácidos pero que catalizan la misma reacción.
Las aconitasas citosólica y mitocondrial no son las únicas aconitasas que existen. Podemos determinar otro tipo de aconitasas, conocida como la aconitasa x. El supuesto dominio catalítico que encontramos en la aconitasa x fue predicho mediante análisis genómicos comparativos. Por norma general, las proteínas son encontradas en el dominio archaea y en las proteobacterias. Esta, sin embargo, está relacionada lejanamente con la familia de las aconitasas eucariotas, porque contiene una secuencia similar y una predicción en cuanto a su estructura secundaria. Esta aconitasa es codificada por el gen Lpl. Una de las aconitasas X que se ha descubierto ha sido la cis-3-hidroxi-L-prolina dehidratasa. Es bastante curioso que las bacterias que contienen el en Lpl pueden degradar la cis-3-hidroxi-L-prolina a una sola cadena de fuente de carbono.
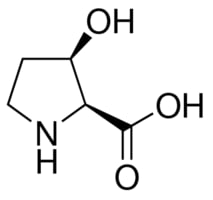
Fuente de la imagen: Sigmaaldrich
Sin embargo, la cis-3-hidroxi-L-prolina no es la única enzima que podemos clasificar dentro de las aconitasas x. También encontramos la mevalonate 5-fosfato dehidratasa, que forma parte de una ruta metabólica que produce el isopentil difosfato (IPP), que es un bloque construido a partir de la síntesis de poliisoprenoides. Esto es una parte crucial en cuanto al crecimiento de la bacteria patógena humana Enterococcus faecalis.
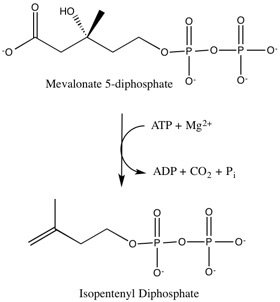
Fuente de la imagen: Wikipedia
Fuente de la imagen: Wikipedia
ESTRUCTURA
La aconitasa, como ya se especificó anteriormente, es una enzima que pertenece a las proteínas ferrosulfuradas, que son aquellas que presentan ese centro de hierro y azufre, y que contienen varios grupos sulfuro unidos a entre dos y cuatro átomos de hierro.
Presenta una estructura secundaria formada por hélices-alfa y láminas-beta alternadas. En cuanto a su estructura terciaria, es una proteína globular, lo que implica que será polar. Ese será el mayor nivel de estructuración que esta proteína podrá tener, ya que no presenta una estructura cuaternaria al carecer de subunidad.
En cuanto a los dominios que presenta la enzima, podemos diferenciar 4 dominios globulares: el 4, el 1, el 2 y el 3 (en este orden). Entre el primero y el último encontramos un “linker joining” que cambia de una a otra conformación funcional de la aconitasa. (Este linker joining une los dominios al ADN de la proteína). Este es el principal determinante para diferenciar a los dos tipos de aconitasas. En la citosólica es mucho más largo y estructurado que en el mitocondrial. En este primero su longitud es de entre 593 y 654 aminoácidos, mientras que en el segundo solamente lo comprenden entre 513 y 536. Además, los dominios del 1 al 3 están mucho más compactados que el 4, el cual es más flexible.
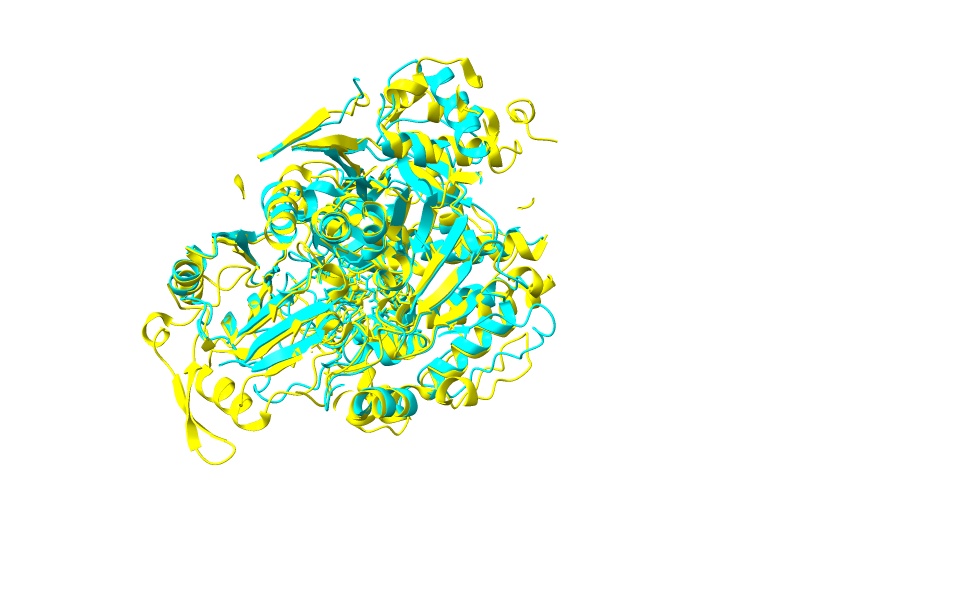
Crédito de la imagen: Samuel Cabello del Cerro y Jorge Carrera Chamorro
Imagen creada con ChimeraX a partir de PDB 2b3y y 7ACN
MECANISMO
La aconitasa es una proteína “moonlighting”, lo que se traduciría en multifuncional. Esto implica que la aconitasa, al igual que el resto de las proteínas moonlighting, que presenta más de una función y que ninguna de estas está relacionada entre sí. De este modo a la primera función se la conocerá como función canónica y a la segunda, o siguientes en el caso de tener más de dos, como moonlighting. Habitualmente la función canónica está implicada en el metabolismo, mientras que la/s moolighting suelen ser funciones más complejas y que se han adquirido posteriormente debido la evolución de la proteína. En este caso, la “moonligting” de la aconitasa sería la IRP-1 (Iron Regulatory Protein-1), la cual se encarga de regular el metabolismo y los niveles del hierro uniéndose a distintos ARNm. La IRP1 es una proteína bifuncional que existe en equilibrio entre un grupo Fe4S4, y que contiene tanto a la aconitasa citosólica como una apoproteína. Esta se une a los IRE, o elementos sensibles al hierro, en los ARNm para reprimir la traducción o la degradación.
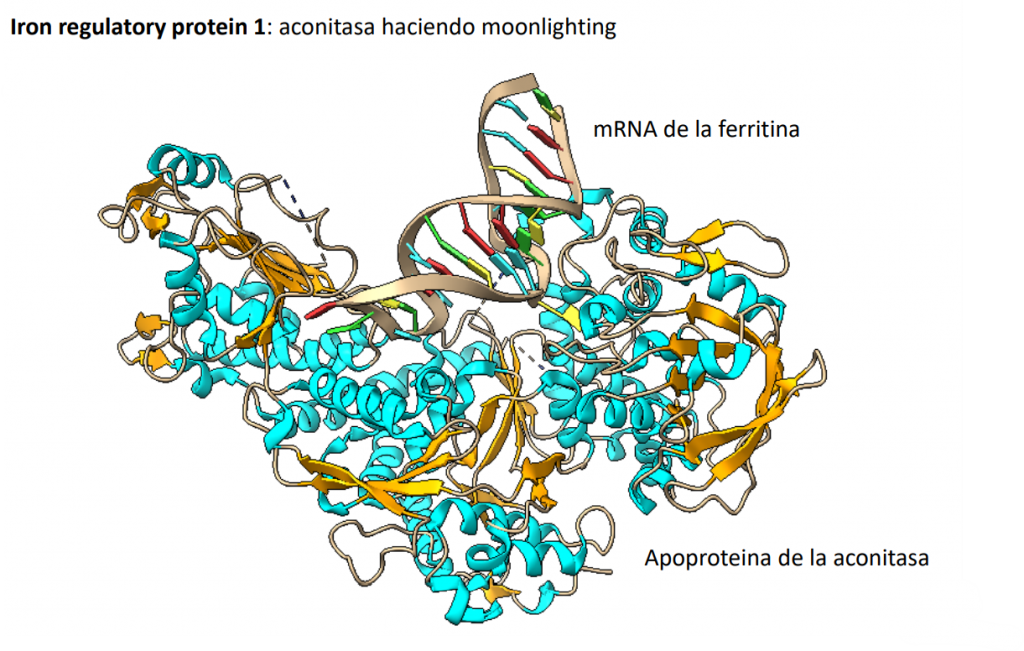
PAPEL BIOMÉDICO
La aconitasa es, por lo tanto, una proteína fundamental para el funcionamiento del organismo. El déficit de esta enzima, principalmente en los músculos esqueléticos, ocasiona una miopatía. Esta enfermedad se define como la intolerancia al ejercicio físico, y puede ser presentada desde la infancia. Una actividad física moderada en aquel individuo que presente la enfermedad puede sufrir, entre otros síntomas, palpitaciones cardiacas, acidosis láctica (acumulación de ácido láctico en el torrente sanguíneo), fatiga, debilidad muscular y disnea (sensación de dificultad respiratoria).
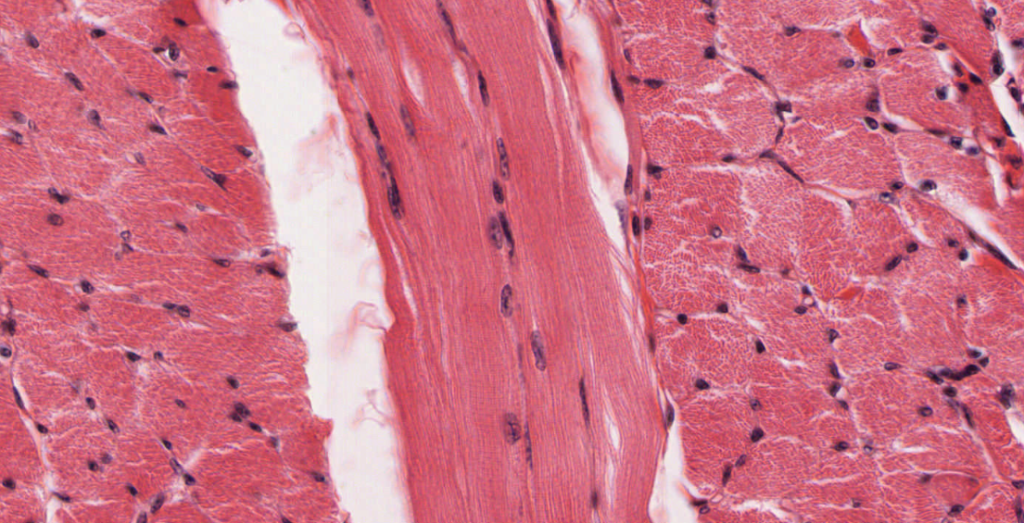
Fuente de la imagen: Itshistology
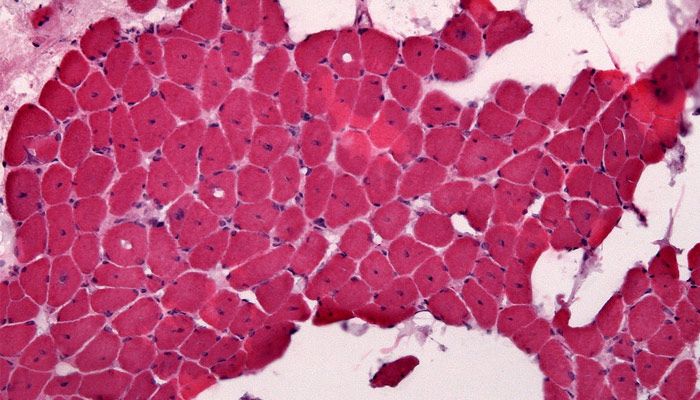
Crédito de la imagen: Jensflorian [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0) or GFDL (http://www.gnu.org/copyleft/fdl.html)], from Wikimedia Commons
Si la actividad física es intensa, los efectos son mayores, pudiendo ocasionar episodios agudos de debilidad muscular, dolores, tumefacción, mioglobinuria (expulsión de mioglobina a través de la orina), parálisis muscular extendida, debido al aumento del piruvato y lactato, y choque circulatorio. Hoy en día no existe tratamiento frente a la enfermedad.
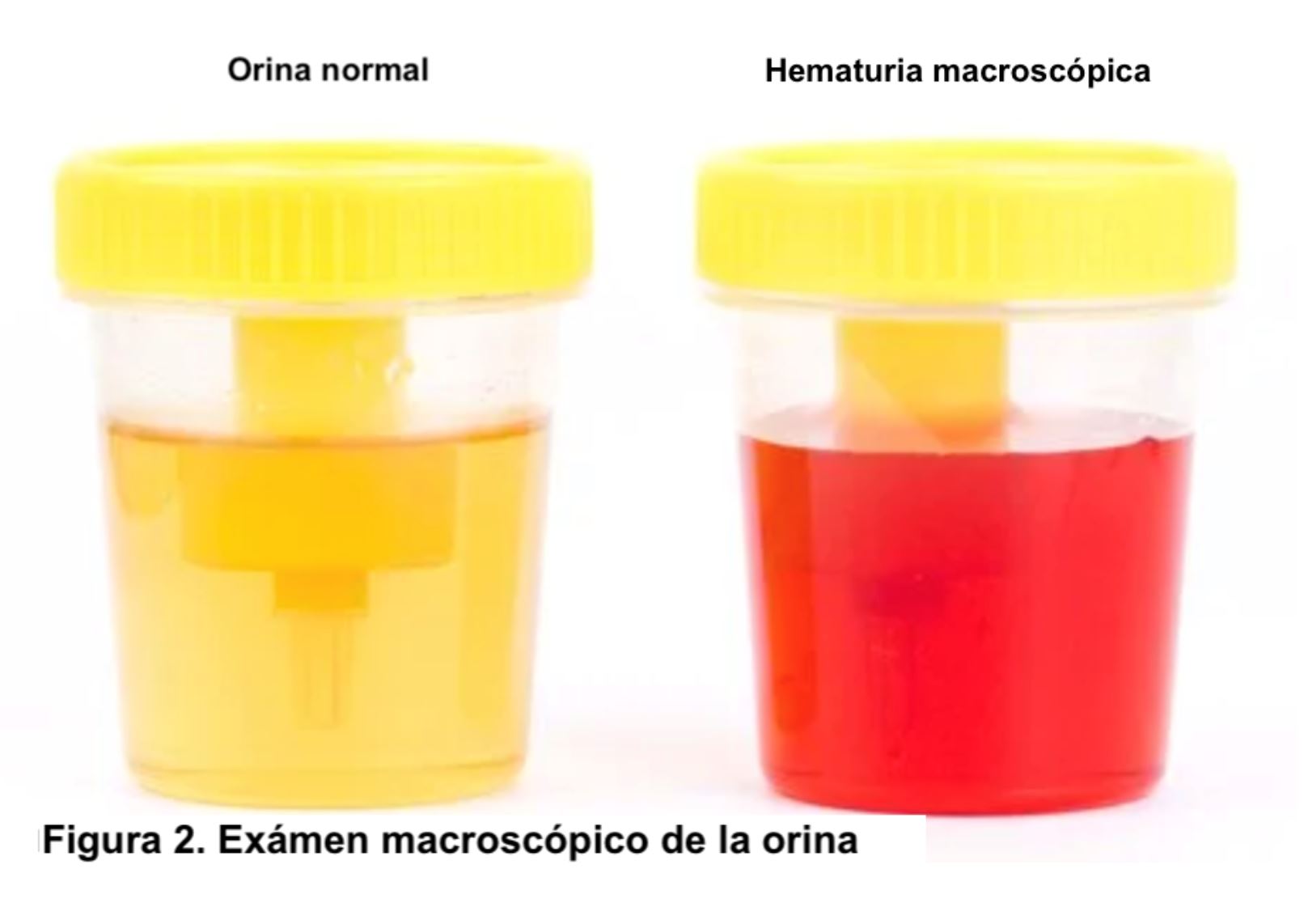
Fuente de la imagen: Rivera Hernández F, Anaya Fernández S, Romera AM et al. Síndromes Clinicos en Nefrología.En: Lorenzo V., López Gómez JM (Eds). Nefrología al día. ISSN: 2659-2606.
También se ha descubierto una variante de la aconitasa que puede llegar a producir el síndrome de degeneración cerebelo-retinal infantil, el cual presenta varios síntomas neurológicos y musculares.
Como consecuencia de estas enfermedades, la aconitasa juega un papel fundamental en la investigación biomédica. Por una parte, se desarrollan exhaustivos mecanismos para identificar algunas de las enfermedades, como análisis moleculares para relacionar la disminución de las concentraciones de aconitasa y el gen ISCU, cuya deficiencia también supone la transmisión de la miopatía a la herencia. Otros mecanismo usados son las biopsias del músculo esquelético para identificar su déficit. La aconitasa también está muy implicada en la lucha contra el cáncer, como el de próstata, el cual también se relaciona con la aconitasa.
REFERENCIAS
Chen CL, Mermoud JC, Paul LN, Steussy CN, Stauffacher CV. Mevalonate 5-diphosphate mediates ATP binding to the mevalonate diphosphate decarboxylase from the bacterial pathogen Enterococcus faecalis. J Biol Chem. 2017 Dec 29;292(52):21340-21351. doi: 10.1074/jbc.M117.802223. Epub 2017 Oct 12. PMID: 29025876; PMCID: PMC5766736.
Frishman, D., & Hentze, M. W. (1996). Conservation of aconitase residues revealed by multiple sequence analysis: implications for structure/function relationships. European journal of biochemistry, 239(1), 197-200.
Mansilla Marchetti, S. (2017). Caracterización bioquímica de una aconitasa mitocondrial de mamífero.
Mario Alcalde Redondo, Raquel Alonso Carro, Violeta Cascón Martín y Roberto García Vicente. (2018). Aconitasa, Dpto. Bioquímica y Biología Molecular. Available at: http://proteinasestructurafuncion.usal.es/moleculas/Aconitasa/index.html
Mochel, F., & Haller, R. G. (2009). Myopathy with Deficiency of ISCU – RETIRED CHAPTER, FOR HISTORICAL REFERENCE ONLY. In M. P. Adam (Eds.) et. al., GeneReviews®. University of Washington, Seattle.
Paysan-Lafosse T, Blum M, Chuguransky S, Grego T, Pinto BL, Salazar GA, Bileschi ML, Bork P, Bridge A, Colwell L, Gough J, Haft DH, Letunić I, Marchler-Bauer A, Mi H, Natale DA, Orengo CA, Pandurangan AP, Rivoire C, Sigrist CJA, Sillitoe I, Thanki N, Thomas PD, Tosatto SCE, Wu CH, Bateman A. (2022). Aconitase X catalytic domain, putative.
Paysan-Lafosse T, Blum M, Chuguransky S, Grego T, Pinto BL, Salazar GA, Bileschi ML, Bork P, Bridge A, Colwell L, Gough J, Haft DH, Letunić I, Marchler-Bauer A, Mi H, Natale DA, Orengo CA, Pandurangan AP, Rivoire C, Sigrist CJA, Sillitoe I, Thanki N, Thomas PD, Tosatto SCE, Wu CH, Bateman A. InterPro in 2022. Nucleic Acids Research, Nov 2022, (doi: 10.1093/nar/gkac993)
Serrano, F.L., Murillo, Q.E. and Abellan, A.I. (2018). Proteínas «moonlighting»: Identificación y relación con la infección por microorganismos patógenos y clínica humana.
Walden, W. E., Selezneva, A. I., Dupuy, J., Volbeda, A., Fontecilla-Camps, J. C., Theil, E. C., & Volz, K. (2006). Structure of dual function iron regulatory protein 1 complexed with ferritin IRE-RNA. Science (New York, N.Y.), 314(5807), 1903–1908. https://doi.org/10.1126/science.1133116
Redactado por Samuel Cabello del Cerro y Jorge Carrera Chamorro. Sep 2022/Feb 2023