Interacción ADN-proteínas
C. Menor-Salván. Oct. 2020. En construcción
Las proteínas y los ácidos nucleicos interaccionan fácilmente. Esta interacción se dió desde antes del origen de la vida y fue clave en la evolución. Actualmente, toda la Biología Molecular se basa en las interacciones entre ADN o ARN y proteínas. Vamos a estudiar algunos casos esenciales de proteínas que interaccionan con ácidos nucleicos y su papel biológico:
- Motivos estructurales básicos en la interacción con ADN (ver mas abajo en ésta página)
- La Topoisomerasa II
Motivos conservados de interacción con ADN
Vimos en el apartado de estructuras del ADN, que la doble hélice tiene un surco mayor, en el que las bases están accesibles, y un surco menor, en el que están expuesto el backbone o armazón de desoxirribosa y fosfato. Las proteínas interaccionan con la doble hélice, accediendo a ella por uno de los dos tipos de surco. Vamos a ver los tipos de interacción principales entre proteína y ADN:
Cremalleras de leucina (leucine zippers)
Las cremalleras de leucina son un dominio de interacción con ADN consistente en dos alfa-hélices anfipáticas (es decir, un lado hidrófobo y otro hidrófilo) formando una «coiled coil», un enrollamiento de las dos hélices. Esta estructura se conecta evolutivamente con proteínas fibrosas con estructura similar en «coiled coil».
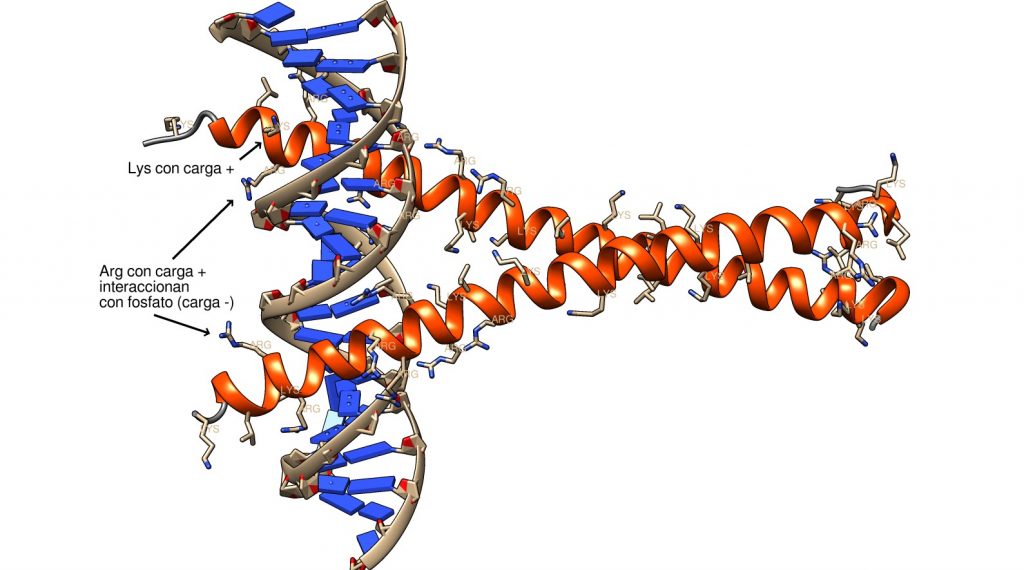
La cremallera de leucina tiene una región de interacción con ADN, rica en los aminoácidos básicos arginina y lisina, cargados positivamente, que interaccionan electrostáticamente con los fosfatos cargados negativamente del «backbone» de la estructura del ADN. La region de cremallera tiene una serie de leucinas ubicadas cada siete residuos, que, por efecto hidrofóbico, mantienen la estructura del «coiled coil». Así, tenemos una región hidrófoba, y dos regiones cargadas positivamente, que se repelen entre sí. La región hidrófoba permite la dimerización de la proteína; el conjunto de fuerzas resultante «retuerce» las alfa-helices una sobre otra. En algunos casos (no mostrado) interviene un catión Mg2+, que ayuda a mantener las estructura.

La interacción entre la cremallera de leucina y el ADN nos muestra otra funcionalidad del fosfato, el conector ionizado del ADN: la estabilización de interacciones con proteínas mediante atracción electrostática con aminoácidos cargados positivamente. Si observamos las superficies culombianas de las moléculas, este efecto queda patente:
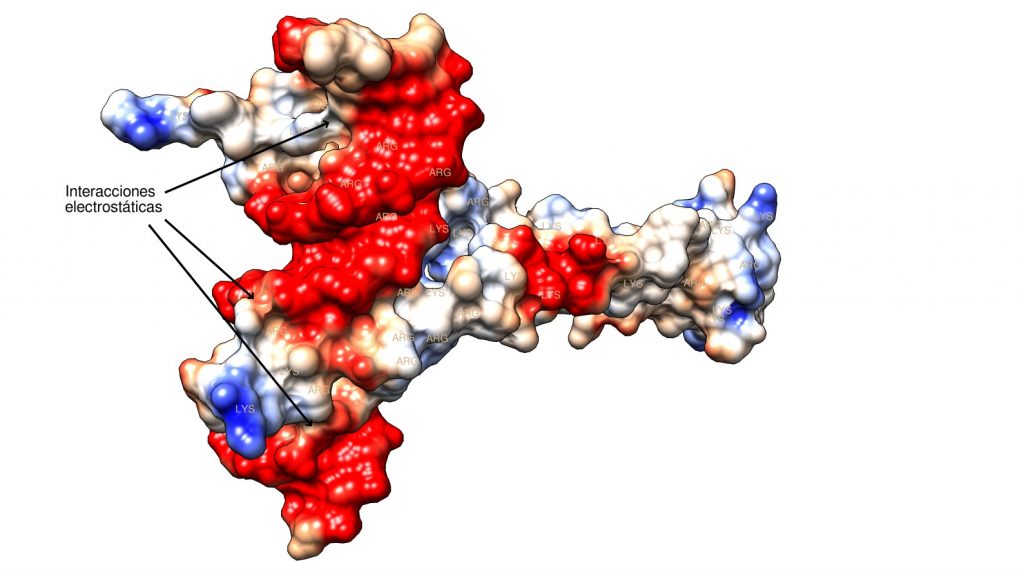
Las interacciones electrostáticas entre aminoácidos básicos y fosfato se observan bien en el modelo, resultando en una región casi neutra de contacto con el esqueleto de la hélice de ADN. Observándo el modelo en 3D pueden apreciarse bien las zonas de interacción:
Motivos de dedos de zinc
en construcción
Hélice-vuelta-Hélice (motivos HTH o «helix-turn-helix»)
en construcción