Por Alba Rodríguez y Ángela Sainz, Biología Sanitaria UAH
1. INTRODUCCIÓN
La clatrina se encuentra en el interior de las células y se encarga de la formación de vesículas para el tráfico intracelular. Participa en un proceso de vital importancia para que se pueda dar la vida. Por eso mismo, ha sido altamente conservada durante la evolución.
Las moléculas del interior de cada orgánulo realizan tareas específicas y deben permanecer aisladas del citoplasma, tanto para mejorar su eficacia química como, en muchos casos, para proteger al citoplasma de funciones potencialmente dañinas. A pesar de que los orgánulos hayan de estar segregados deben comunicarse entre sí, por ejemplo, para transportar los reactivos y productos del metabolismo celular. Para esto, las células pueden transportar moléculas a grandes distancias en pequeñas vesículas que brotan desde la superficie de un orgánulo para luego fusionarse con otro orgánulo de destino. En la mayoría de los casos, estas vesículas son facilitadas por proteínas de cubierta como la clatrina. Por otro lado las células también endocitan vesículas de diversos tamaños a partir de la membrana plasmática, por ejemplo, para absorber nutrientes, importar receptores de señalización o mediar en una respuesta inmunitaria tras tomar muestras del mundo extracelular. Todo esto tendrá un impacto en la biomedicina en cuanto a ciertas patologías como el cáncer.
2. ESTRUCTURA
Una molécula de clatrina se observa como una estructura que presenta tres brazos y recibe el nombre de triskelion. Cada triskelion está formado por tres cadenas pesadas y tres cadenas ligeras. La formación de la vesícula de clatrina se produce de forma que los triskeliones se van acoplando unos a otros por interacción a través de sus dominios generando, como resultado, una estructura comúnmente conocida como “jaula cerrada”, con forma de balón de fútbol. La correcta formación de esta proteína será regulada, como en muchas otras, por chaperonas. Si el plegamiento es incorrecto y es imposible arreglarlo, el complejo formado será degradado por la célula.
Estas vesículas necesitan estar formadas por una cantidad relativamente grande de triskeliones porque sino, la jaula va a ser muy pequeña y la carga no va a caber físicamente en su interior.
Mientras que las cadenas pesadas se van a encargar de darle su particular forma, las ligeras intervendrán en su formación (y rotura). La vesícula más pequeña posible está formada por doce pentágonos y cuatro hexágonos formados cada uno por diversos triskeliones. Por lo tanto, posee una forma poliédrica. Las caras que contenga ese poliedro van a variar en función de los hexágonos y pentágonos por los que esté formada. Cada vértice estará en el centro de un triskelion y los extremos serán en torno a cuatro brazos juntos.
El proceso de formación de la clatrina es bastante lento comparado con otros. Esto se debe a que la clatrina es mucho más grande que muchas otras estructuras, ya que en su interior presenta una carga que puede llegar a ser muy variada: lípidos, proteínas, ácidos nucleicos, etc. Por tanto, realizar todas las reacciones para que la vesícula quede cubierta de clatrina puede llegar a ser un proceso relativamente largo, aunque en menos de un minuto suele haberse logrado.
Figura 2.1. Arriba la vesícula de clatrina en la que claramente se pueden diferenciar los hexágonos y pentágonos que la forman. Debajo, el triskelion formado por las cadenas pesadas y ligeras y los dominios globulares. Modificado con Biorender a partir de 10.2210/rcsb_pdb/mom_2007_4.
3. MECANISMO
Una proteína llamada adaptina va a ser la encargada de unir los triskeliones para que adquieran su particular estructura, pero, también se va a encargar de la interacción entre la clatrina y los receptores de membrana. Cuando un receptor de membrana reconoce un ligando al que se va a unir, las adaptinas van a reclutar a la clatrina para que se disponga debajo de la membrana plasmática, y que esta forme la vesícula cuando se produzca la invaginación. La unión de la clatrina es lo que incita a que se produzca dicha invaginación, además, se ha investigado su participación en el llamamiento a otras proteínas que también son necesarias para la endocitosis.
La clatrina no se une directamente a la membrana, sino que se une a unas proteínas adaptadoras, como las adaptinas. Cada una de ellas se unirá a una proteína o fosfolípido presente en la membrana que serán característicos y estarán relacionados con diferentes orgánulos celulares.
Una vez tengamos la vesícula de clatrina formada con la carga dentro, unas proteínas llamadas dinaminas (ATPasas), se van a encargar de que esta se desprenda de la membrana y quede libre en el citosol.
En este momento la vesícula se va a liberar de la “jaula” de clatrina, gracias a otro tipo de ATPasa. Después, muy posiblemente, procederá a fusionarse con un endosoma.
A grandes rasgos lo que pasa posteriormente es lo siguiente: en el interior del endosoma se genera un pH más bajo en comparación con el pH citosólico lo que va a hacer que los receptores liberen la carga que portaban. Estos receptores se van a reciclar volviendo a formar parte de la membrana plasmática para que el proceso se pueda volver a llevar a cabo. La carga que llevaba la vesícula será degradada por mecanismos de la célula.
Figura 3.1. En esta imagen se puede ver el proceso de endocitosis de proteínas de la yema y lípidos asociados mediada por clatrina en los ovocitos de C. elegans. Fuente: Grant y Sato, 2006
4. FUNCIÓN
La función por excelencia de la clatrina es formar vesículas para el tráfico intracelular como hemos explicado previamente. No obstante, también es cierto que va a participar en multitud de otros procesos celulares: yendo desde espermiogénesis hasta la mitosis, además no solo va a participar en la endocitosis, pues se sabe que también está relacionada con la exocitosis. Se cree que esta variedad de funciones se debe a su capacidad de cambiar de forma.
Pero sin duda, su función por excelencia es la endocitosis:
La endocitosis mediada por clatrina es un mecanismo de la célula por el cual se consigue importar al interior celular componentes exteriores. Uno de los casos más famosos es la incorporación de LDL (low density lipoprotein también comúnmente conocido como “colesterol del malo”). Ocurre de la siguiente manera: el LDL es reconocido por unos receptores que se encuentran en la membrana plasmática. En el momento que estos se unan, se va a activar el sistema: las adaptinas reclutan a las clatrinas para estimular la invaginación y formar la vesícula con el LDL dentro de esta. Una vez libre en el citosol, la clatrina se desprenderá de la vesícula y esta irá hacia aquel que sea su siguiente destino. La clatrina por su parte quedará libre por el citoplasma en espera a que vuelva a ser necesitada en la membrana.
5. IMPACTO BIOMÉDICO
En cuanto al impacto biomédico, Caballero-Diaz et al. demostraron en 2020 que la clatrina tiene un impacto en el desarrollo y la progresión del cáncer de hígado, es decir, se descubrió una relación entre las células hepáticas y unos altos niveles de clatrina. A rasgos generales se establece que la expresión de clatrina aumenta en casos de cáncer de hígado pues es necesaria para que se active la vía pro-tumorogénica del TGF-β.
¿Cómo está relacionada la clatrina con el cáncer de hígado? Todo comienza con un amplio grupo de proteínas citoquinas llamadas TGF-β (Beta Transforming Growth Factor, Figura 5.1). Estas proteínas tienen un papel dual dependiendo de si se encuentran en estadios tempranos o en estadios tardíos de carcinogénesis. En estadios tempranos del desarrollo de un carcinoma las citoquinas ejercen un papel de supresor tumoral, promoviendo la muerte celular y disminuyendo el crecimiento del tumor. De manera contraria, en estadios avanzados de cáncer de hígado, las células cancerosas han logrado la habilidad para escapar de sus funciones supresoras respondiendo al TGF- β mediante inducción de la migración celular contribuyendo a la diseminación del tumor.
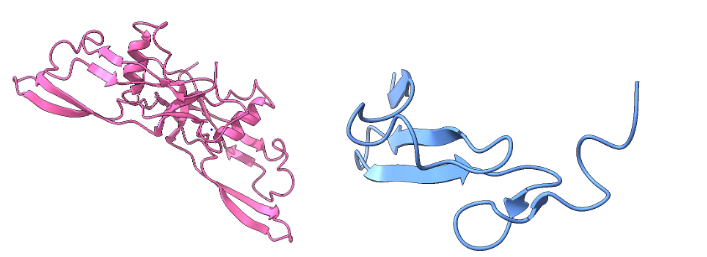
A la izquierda reproducida en rosa se ve la Figura 5.1 que representa la estructura del Transforming Growth Factor beta (TGF-β). Hecho por ChimeraX a partir de PDB 1BMP. Y a la derecha en azul se ve la Figura 5.2 que representa la estructura del Epidermal Growth Factor (EGF). El EGF es una pequeña proteína de 53 aminoácidos que estimula el crecimiento celular a través de un receptor tipo tirosina kinasa. Hecho por ChimeraX a partir de PBD 1EPG
Figura 5.3 Estructura del receptor del factor crecimiento epidérmico (EGFR). A la izquierda en azul se ve el receptor del factor crecimiento epidérmico y en rojo el factor de crecimiento epidérmico. A la izquierda se ve como con la unión del factor de crecimiento epidérmico se dimeriza la estructura del receptor. Fuente: June 2010, David Goodsell.
Este cambio de comportamiento de anti-tumorigénico a pro-tumorigénico del TGF-β se produce por activación – en las células tumorales – de la vía del receptor del factor de crecimiento epidérmico (EGFR, Figura 5.3), cuya sobreexpresión e hiperactividad se ha asociado a un gran número de cánceres. El EGFR se activa por dimerización cuando se une al EGF (Figura 5.2) y se produce la endocitosis mediada por la clatrina. Sin la clatrina no se podría endocitar el EGFR con el EGF y no se produciría el cambio de pro-apoptótico a anti-apoptótico del TGF-β. Además, también se ha evidenciado que el TGF-β es capaz de inducir la síntesis de clatrina, lo cual acaba por incentivar un fenómeno de retroalimentación positiva.
Figura 5.4 Esquema gráfico del proceso de cambio de comportamiento del TGF-β. Fuente: Caballero-Díaz et al., 2020
Entonces, siguiendo el gráfico (Figura 5.3), en situación normal el TGF-β se une al TβRII y al TβRI que desencadenan una serie de reacciones que tiene como final la apoptosis. En caso de cáncer, se activa la vía del EGFR que desencadena otra serie de reacciones que inhiben la apoptosis.
La expresión de clatrina es la que torna la respuesta al TGF-β a favor de las señales antiapoptóticas y pro-tumorogénicas. Entonces, se establece la existencia de una correlación positiva entre la expresión de TGF-β y la expresión de clatrina en muestras de pacientes de carcinoma hepatocelular, es decir, ambas aumentan a la vez. Lo más importante de todo esto es que los pacientes que expresan altos niveles de TGF-β y clatrina muestran un peor pronóstico y una menor supervivencia. (Figura 5.4)
Figura 5.5 Curvan de Kaplan-Meier sobre la supervivencia global y expresión de TGFB1, expresión de CLTC y una puntuación que combina ambas categorizaciones. Fuente: Journal of Hepatology
Finalmente se concluye que una elevada expresión de la clatrina podría contribuir al potenciamiento de la vía protumorígena a través del Factor de Crecimiento beta (TGF-β). Este es un nuevo conocimiento muy valioso para la medicina pues brinda un mayor entendimiento tanto del carcinoma hepatocelular como del mecanismo de acción del TGF-β. Además, también puede ser de gran ayuda para proporcionar a los pacientes de carcinoma hepatocelular una terapia más específica basada en inhibidores de la vía TGF-β en caso de que tengan niveles altos de clatrina.
6. REFERENCIAS
[1] The RCSB PDB «Molecule of the Month»: Inspiring a Molecular View of Biology D.S. Goodsell, S. Dutta, C. Zardecki, M. Voigt, H.M. Berman, S.K. Burley (2015) PLoS Biol 13(5): e1002140. doi: 10.1371/journal.pbio.1002140
[2] Wood, K. M., & Smith, C. J. (2021). Clathrin: the molecular shape shifter. The Biochemical journal, 478(16), 3099–3123. https://doi.org/10.1042/BCJ20200740
[3] Royle S. J. (2006). The cellular functions of clathrin. Cellular and molecular life sciences : CMLS, 63(16), 1823–1832. https://doi.org/10.1007/s00018-005-5587-0
[4] Descriptores en Ciencias de la Salud: DeCS [Internet]. ed. 2017. Sao Paulo (SP): BIREME / OPS / OMS. 2017 [actualizado 2017 May 18; citado 2017 Jun 13].
[5] Brodsky, F. M. (2012). Diversity of clathrin function: new tricks for an old protein. Annual review of cell and developmental biology, 28, 309-336.
Payne, G. S., & Schekman, R. (1985). A test of clathrin function in protein secretion and cell growth. Science, 230(4729), 1009-1014.
[6] Caballero-Díaz, D., Bertran, E., Peñuelas-Haro, I., Moreno-Càceres, J., Malfettone, A., López-Luque, J., Addante, A., Herrera, B., Sánchez, A., Alay, A., Solé, X., Serrano, T., Ramos, E., & Fabregat, I. (2020). Clathrin switches transforming growth factor-β role to pro-tumorigenic in liver cancer. Journal of hepatology, 72(1), 125–134. https://doi.org/10.1016/j.jhep.2019.09.012
[7] Figura 3.1. Grant, B. D. and Sato, M. Intracellular trafficking (January 21, 2006), WormBook, ed. The C. elegans Research Community, WormBook, doi/10.1895/wormbook.1.77.1, http://www.wormbook.org.
[8] PDB-101: Educational resources supporting molecular explorations through biology and medicine. Christine Zardecki, Shuchismita Dutta, David S. Goodsell, Robert Lowe, Maria Voigt, Stephen K. Burley. (2022) Protein Science 31: 129-140 doi:10.1002/pro.4200
[9] The Protein Data Bank H.M. Berman, J. Westbrook, Z. Feng, G. Gilliland, T.N. Bhat, H. Weissig, I.N. Shindyalov, P.E. Bourne (2000) Nucleic Acids Research, 28: 235-242. doi:10.1093/nar/28.1.235
[10] Molecular graphics and analyses performed with UCSF ChimeraX, developed by the Resource for Biocomputing, Visualization, and Informatics at the University of California, San Francisco, with support from National Institutes of Health R01-GM129325 and the Office of Cyber Infrastructure and Computational Biology, National Institute of Allergy and Infectious Diseases.
[11] UCSF ChimeraX: Structure visualization for researchers, educators, and developers. Pettersen EF, Goddard TD, Huang CC, Meng EC, Couch GS, Croll TI, Morris JH, Ferrin TE. Protein Sci. 2021 Jan;30(1):70-82.
[12] UCSF ChimeraX: Meeting modern challenges in visualization and analysis. Goddard TD, Huang CC, Meng EC, Pettersen EF, Couch GS, Morris JH, Ferrin TE. Protein Sci. 2018 Jan;27(1):14-25


