La enzima de las mil caras: El complejo 2-oxoglutarato deshidrogenasa
Por Marta Cuevas Sánchez, Biología sanitaria UAH
Introducción
El complejo de la 2-oxoglutarato deshidrogenasa (también llamado complejo alfa-cetoglutarato deshidrogenasa) se trata de un complejo multienzimático que forma parte del ciclo de Krebs. Concretamente, su función principal es transformar el 2-oxoglutarato en succinil-coenzima A tras una descarboxilación, la unión del succinil a la coenzima A, y la producción de una molécula de NADH: tres reacciones diferentes realizadas por tres subunidades diferentes que conforman esta enorme red de enzimas complejamente conectadas y coordinadas. Y eso no es todo, y es que este complejo también tiene importantes papeles en el mantenimiento de la homeostasis celular e incluso en el núcleo. En este artículo conoceremos su funcionamiento y relacionaremos sus variadas funciones con una de las mayores preocupaciones biomédicas de todos los tiempos: el cáncer.
Estructura
Nuestro complejo se compone de tres subunidades enzimáticas: un centro simétrico conformado por 24 copias de E2: dihidrolipoamida succinil transferasa (DLST); rodeado de numerosas copias de las subunidades E1: la propia 2-oxoglutarato deshidrogenasa (OGDH); y E3: dihidrolipoamida deshidrogenasa (DLD).
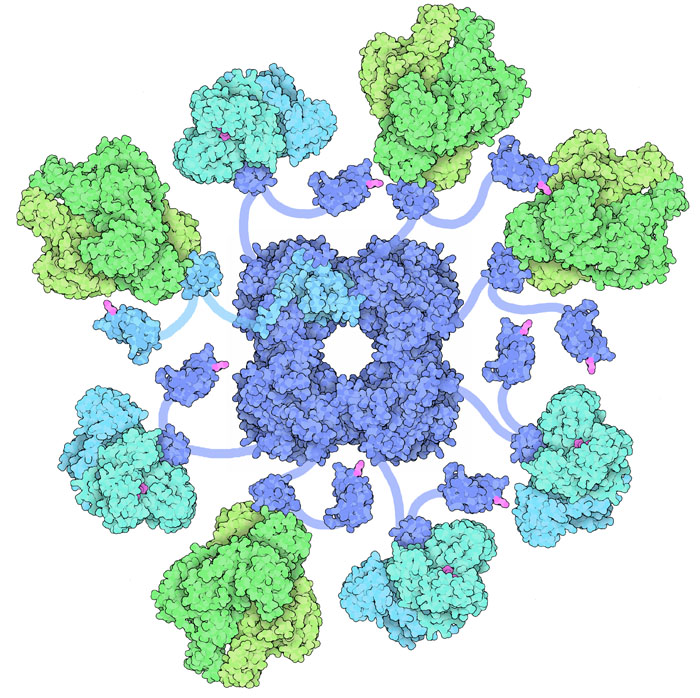
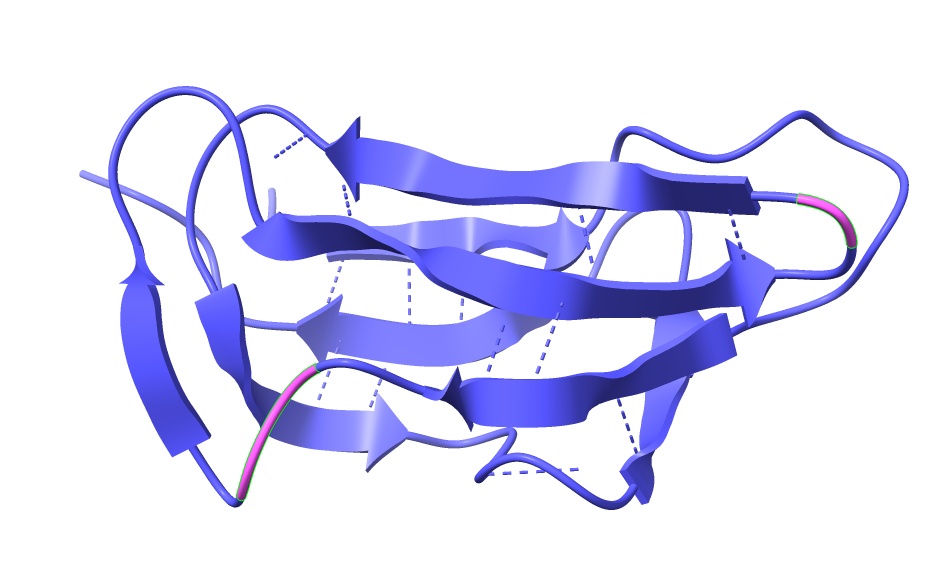
Concretamente, las subunidades E1 y E3 se unen al centro por uniones flexibles y móviles que permiten al complejo a coordinarse y llevar a cabo la reacción global. Cada una de estas uniones se conforma por cadenas proteicas con estructura secundaria beta-laminar, que les aporta dicha flexibilidad. Un aminoácido de lisina se une a una molécula transportadora (ácido lipoico), formando un largo brazo de lipoil-lisina que transporta la molécula que está siendo modificada de una subunidad a otra según la reacción va progresando.
Papel en el ciclo de Krebs
Nuestro complejo juega un papel crucial en la respiración celular aerobia. Concretamente, forma parte del ciclo de Krebs, ruta metabólica común en la que convergen el catabolismo de glúcidos, lípidos y aminoácidos, a lo largo de la cual se oxida el Acetil-CoA generando poder reductor en forma de moléculas de NADH.
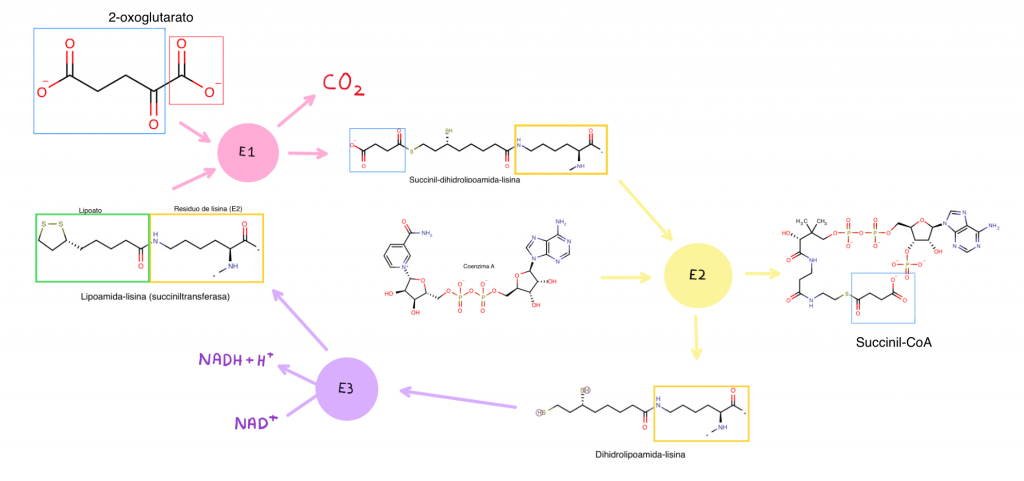
La reacción global catalizada por el complejo de la 2-oxoglutarato deshidrogenasa es: 2-oxoglutarato + CoA + NAD+ = Succinil-CoA + CO2 + NADH. A continuación conoceremos más a fondo las subunidades que componen este complejo y sus papeles en esta reacción:
E1
La primera de ellas es la propia 2-oxoglutarato deshidrogenasa, que le da su nombre. Cataliza el primer paso de la reacción: la descarboxilación del 2-oxoglutarato, y posteriormente la oxidación del ácido lipoico en dihidrolipoil, grupo que es unido covalentemente a un residuo de lisina de E2, transportando al centro catalítico de la segunda subunidad el succinil resultante de la decarboxilación Reacción: 2-oxoglutarato + lipoamida = succinil-dihidrolipoamida-lisina(E2) + CO2.
Esta subunidad no podría funcionar sin su coenzima: tiamina difosfato, cofactor de numerosas enzimas deshidrogenasas. Se trata de la forma coenzimática de la vitamina B1, la ausencia en la dieta de esta misma puede llevar a una enfermedad denominada Beriberi. enfermedad se caracteriza x perdida función neuronal
E2
La segunda subunidad se trata de la dihidrolipoamida succiniltransferasa. Se trata de una aciltransferasa: transfiere el succinil procedente del grupo dihidrolipoil a la Coenzima A Reacción: CoA + succinil-dihidrolipoamida-lisina(E2) = succinil-CoA + dihidrolipoamida-lisina(E2)
Los cofactores de esta enzima son la propia Coenzima A y el ácido lipoico que antes ha sido unido covalentemente por E1. De esta forma, si no actúa E1, E2 no puede funcionar.
E3
La tercera subunidad es la dihidrolipoamida deshidrogenasa. Se trata de una oxidorreductasa, que cataliza la oxidación de la dihidrolipoamida obteniendo lipoamida, que puede volver a ser utilizada por E1 cerrando el ciclo; y la reducción de una molécula de NAD+ en NADH. Sus cofactores son FAD y NAD. Reacción: dihidrolipoamida-lisina(E2) + NAD+ = lipoamida + NADH + H+
Se ha demostrado que los iones de calcio y el ADP estimulan la actividad catalítica de E1, mientras que el ATP y el NADH la reducen. Nos encontramos ante un claro ejemplo de retroinhibición, en el cual los productos de la vía (el NADH siendo generado por E3 y el ATP siendo el producto final de la respiración celular) inhiben uno de los pasos anteriores de la misma. (Strumilo, 2005)
Papel en el núcleo
Aunque la función más conocida de la 2-oxoglutarato deshidrogenasa es mitocondrial, se ha demostrado que también tiene una gran presencia en el núcleo celular, siendo crucial para la regulación epigenética de los procesos de la cromatina mediante las modificaciones en histonas. Se ha demostrado la presencia de un ciclo de Krebs alternativo en el interior del núcleo celular (nTCA), utilizado principalmente para la eliminación o producción local de metabolitos necesarios para esta regulación nuclear.
En el caso del complejo de la 2-oxoglutarato deshidrogenasa nuclear, se asocia con KAT2A (histona acetiltransferasa 2A). El succinil-CoA producto de la reacción catalizada por el complejo se asocia a KAT2A, que transfiere el grupo succinil a un residuo de lisina en la histona H3, modificación necesaria para su funcionamiento. Se ha demostrado que impidiendo la entrada del complejo en el núcleo reduce la expresión génica, lo cual puede ser de utilidad en futuros estudios sobre tratamientos que impidan la proliferación de células tumorales. (Wang et al., 2017)
Importancia biomédica: implicaciones en el cáncer
Después de investigar acerca de la complejidad del funcionamiento de la 2-oxoglutarato deshidrogenasa, no es difícil intuir que una mutación en cualquiera de las subunidades del complejo pueden alterar la reacción global. Esto tiene como consecuencia la acumulación de su sustrato, el 2-oxoglutarato, que puede promover el desarrollo de tumores como los paragangliomas. Gracias a este conocimiento se ha incluido el estudio genético de las enzimas del ciclo de Krebs como parte de la rutina para el diagnóstico de los paragangliomas. (Remacha et al., 2019)
Continuando con la importancia oncológica de nuestro complejo, debemos tener en cuenta la importancia del paso que nuestro complejo lleva a cabo en el ciclo de Krebs.
El paso que ejerce la 2-oxoglutarato deshidrogenasa se trata de un punto de intersección: el 2-oxoglutarato puede ser utilizado para la producción de energía siendo transformado en succinil-CoA y continuando con el ciclo de Krebs, o puede progresar por la vía de la glutaminolisis, produciendo el glutamato, esencial para la biosíntesis de nucleótidos púricos. Nuestro complejo, por tanto, tiene un importantísimo papel en el mantenimiento de la homeostasis celular, manteniendo un equilibrio entre estas vías catabólica y anabólica.
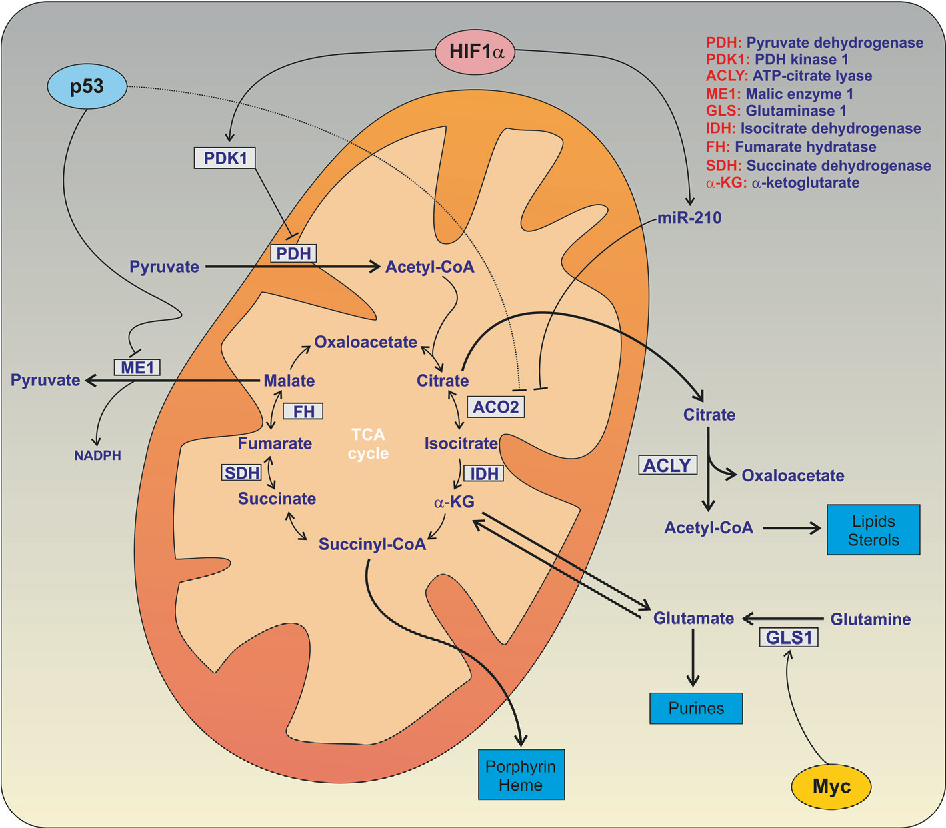
La presencia de glutamato puede ser limitante para la división celular. Generalmente las células cancerígenas presentan una alta tasa de glutaminolisis. La regulación del metabolismo de la glutamina, por tanto, es crucial para la prevención de la aparición de células tumorales. Ha sido demostrado que las alteraciones en el complejo de la OGDH afectan a la distribución de los metabolitos, produciendo un desequilibrio que puede llevar al cáncer. (Jin et al., 2016)
Referencias
Berman, H.M., Westbrook, J., Feng, Z., Gilliland, G., Bhat, T.N., Weissig, H., Shindyalov, I.N., Bourne, P.E. (2000) The Protein Data Bank Nucleic Acids Research, 28: 235-242. https://doi.org/10.1093/nar/28.1.235
Chang, L.-C., Chiang, S.-K., Chen, S.-E., & Hung, M.-C. (2022). Targeting 2-oxoglutarate dehydrogenase for cancer treatment. American Journal of Cancer Research, 12(4), 1436-1455.
Desideri, E., Vegliante, R., & Ciriolo, M. R. (2015). Mitochondrial dysfunctions in cancer: Genetic defects and oncogenic signaling impinging on TCA cycle activity. Cancer Letters, 356(2), 217-223. https://doi.org/10.1016/j.canlet.2014.02.023
Jin, L., Alesi, G. N., & Kang, S. (2016). Glutaminolysis as a target for cancer therapy. Oncogene, 35(28), 3619-3625. https://doi.org/10.1038/onc.2015.447
Nelson, D.L., Cox, M.M. (2008) Lehninger Principles of Biochemistry. Worth Publishers, New York.
Murphy, G. E., & Jensen, G. J. (2005). Electron Cryotomography of the E. coli Pyruvate and 2-Oxoglutarate Dehydrogenase Complexes. Structure, 13(12), 1765-1773. https://doi.org/10.1016/j.str.2005.08.016
Pettersen EF, Goddard TD, Huang CC, Meng EC, Couch GS, Croll TI, Morris JH, Ferrin TE. UCSF ChimeraX: Structure visualization for researchers, educators, and developers. Protein Sci. 2021 Jan;30(1):70-82.
Remacha, L., Pirman, D., Mahoney, C. E., Coloma, J., Calsina, B., Currás-Freixes, M., Letón, R., Torres-Pérez, R., Richter, S., Pita, G., Herráez, B., Cianchetta, G., Honrado, E., Maestre, L., Urioste, M., Aller, J., García-Uriarte, Ó., Gálvez, M. Á., Luque, R. M., … Cascón, A. (2019). Recurrent Germline DLST Mutations in Individuals with Multiple Pheochromocytomas and Paragangliomas. American Journal of Human Genetics, 104(4), 651-664. https://doi.org/10.1016/j.ajhg.2019.02.017
Strumilo, S. (2005). Often ignored facts about the control of the 2-oxoglutarate dehydrogenase complex. Biochemistry and Molecular Biology Education, 33(4), 284-287. https://doi.org/10.1002/bmb.2005.49403304284
The UniProt Consortium. UniProt: the Universal Protein Knowledgebase in 2023. Nucleic Acids Res. 51:D523–D531 (2023)
Wang, Y., Guo, Y. R., Liu, K., Yin, Z., Liu, R., Xia, Y., Tan, L., Yang, P., Lee, J.-H., Li, X., Hawke, D., Zheng, Y., Qian, X., Lyu, J., He, J., Xing, D., Tao, Y. J., & Lu, Z. (2017). KAT2A coupled with the α-KGDH complex acts as a histone H3 succinyltransferase. Nature, 552(7684), 273-277. https://doi.org/10.1038/nature25003