La triosa fosfato isomerasa
INTRODUCCIÓN
La triosa fosfato isomerasa (TPI) es una enzima fundamental para la glucolisis, al ser capaz de trasformar dihidroxiacetona e gliceraldehído-3-fosfato (DHAP y G3P, respectivamente) y viceversa (éste último es necesario para la siguiente reacción del proceso.). Permite una eficiencia mucho mayor en la glucolisis, y todavía no se ha observado ningún organismo que no la emplee. Si embargo, sí que existen patologías que pueden afectar a su rendimiento, dando lugar a enfermedades neurodegenerativas o anemias hemolíticas.
La TPI se considera una isomerasa, ya que convierte un isómero (compuesto con la misma fórmula molecular que otra molécula distinta) en otro. Esta, además, es una reacción reversible, cuyo equilibrio es determinado por la cantidad de cada uno de los isómeros e el medio.
ESTRUCTURA
Está compuesta por dos subunidades proteicas idénticas, lo que convierte esta proteína en un homodímero. Se trata de una proteína soluble, con cadenas de 27 kDa. Aunque sus dos dímeros funcionan independientemente el uno del otro, su emparejamiento es necesario para la estabilidad de la molécula. Su dimerización proporciona una muy alta resistencia a la oxidación y a la proteólisis.
Cada una de estas subunidades está compuesta por 8 láminas β paralelas unidas a sus adyacentes formando una circunferencia, pero también a una cadena α-hélice exterior. Esto crea una estructura llamada barril o tambor TIM (de hecho, TIM se refiere a la triosa fosfato isomerasa, ya que fue en esta enzima donde se vio por primera vez esta estructura). El barril TIM es la estructura más común y de las más conservadas en las proteínas. Se da únicamente en las proteínas de tipo α/β, ya que sólo estas tienen una mezcla de cadenas α y β no segregadas en la proteína. También es una proteína globular, como indica su forma.
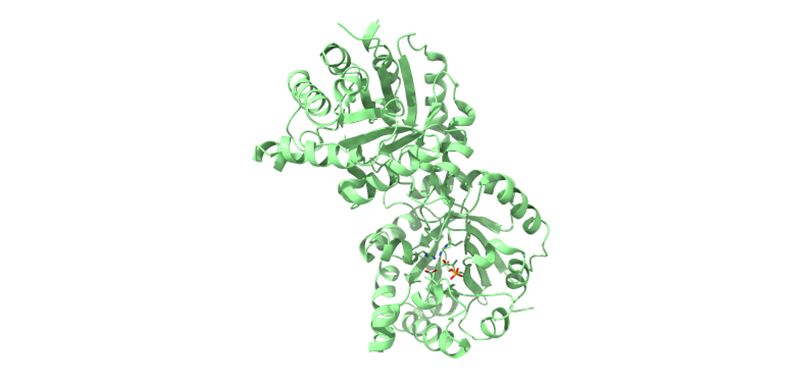
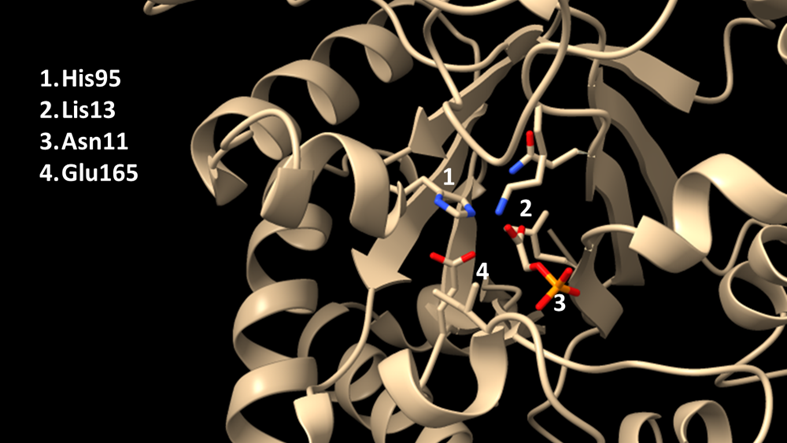
Cada subunidad de la proteína está compuesta por 247 aminoácidos. Estas tienen su centro activo en el barril TIM, con un residuo de ácido glutámico (Glu 167) y una histidina (His 95, de los colores rojo y azul en la imagen). Estos dos componentes forman el enodiol, un intermediario en la reacción. Además, se forma un bucle entre los aminoácidos 166 y 176, que es capaz de unirse al grupo fosfato del sustrato mediante un puente de hidrógeno, estabilizando el intermedio y evitado su descomposición.
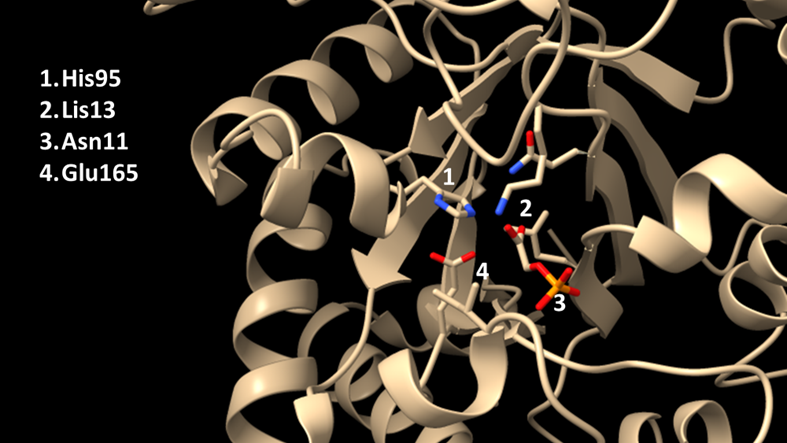
También hay una lisina con carga positiva cerca del centro activo, para contrarrestar la carga negativa del grupo fosfato. Esta distribución de cargas es muy importante: una TPI mutada puede conservar cierta funcionalidad si se mantiene la carga de la lisina.

PAPEL BIOLÓGICO Y MECANISMO DE FUNCIONAMIENTO
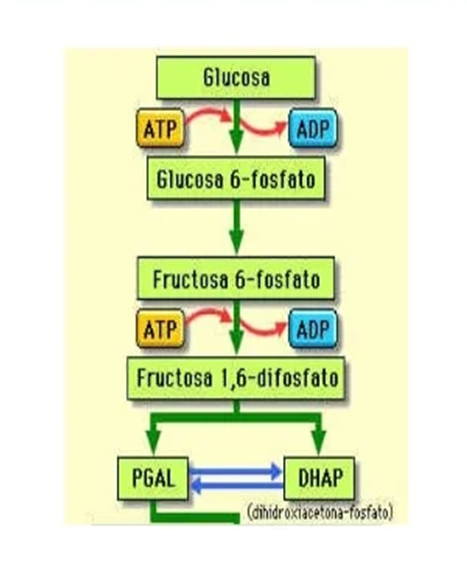
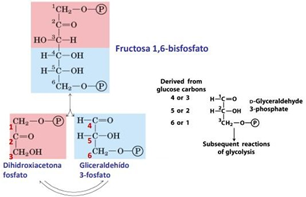
La triosa fosfato isomerasa realiza una de las 10 reacciones que conforman el proceso de la glucolisis, una de las principales fuentes de energía de la célula en forma de NADH y ATP y muy importante para la posterior fosforilación oxidativa. Es la última de las reacciones de la fase preparativa (las primeras 5), antes de la fase de generación de energía. Además, aparte de la glucólisis, es un interviniente fundamental en otros procesos, como la gluconeogénesis, la vía de las pentosas fosfato y la síntesis de ácidos grasos.
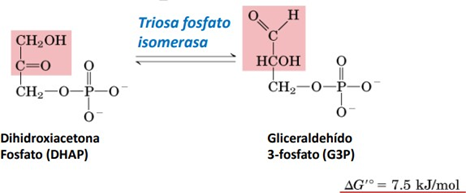
La reacción que cataliza es la isomerización de dihidroxiacetona fosfato (DHAP) a gliceraldehído-3-fosfato (GADP) y viceversa. Ambas moléculas son productos de la catálisis de la fructosa 1,6-bisfosfato, la reacción inmediatamente anterior en la glucólisis. Sin embargo, sólo el GADP es útil para continuar la glucólisis. La isomerización de DHAP permite una mucha mayor eficiencia en la glucólisis, al posibilitar el aprovechamiento de esas moléculas.
La estructura de la enzima, ya explicada, es necesaria para su correcto funcionamiento. El ácido glutámico, cargado negativamente, adquiere un protón del carbono 2 del GADP, y la histidina transfiere protones para convertir la cetona del GADP en un grupo hidroxilo. Los grupos funcionales (la cetona y los grupos hidroxilo y fosfato) cambian de posición en la corta cadena. En eso consiste la reacción (en ambos sentidos, además, porque es una reacción reversible).
Para catalizar la reacción apropiadamente necesitan que su sitio activo y sus otras estructuras cercanas se mantengan, sin mutaciones ni errores en la transcripción. Otros errores en zonas menos cruciales para la proteína pueden aguantarse, mientras que no alteren la polaridad o la hidrofobicidad de la proteína
La TPI puede acelerar su reacción de isomerización por varias órdenes de magnitud. Aumenta tanto la velocidad de la reacción que esta se ve únicamente limitada por la frecuencia de los choques de sustrato y enzima (lo que la concede el poder llamarse un “catalizador perfecto”). Esto independiza su velocidad de las de otros pasos de catálisis.
Aunque esta reacción no esté sujeta a ningún tipo de moderación o regulación, ni esté asociada a ningún cofactor, no se debe subestimar su importancia. Sin ella, la glucólisis sería un proceso con una muy mermada eficiencia, poniendo problemas a la célula para obtener toda la energía que necesita.
PAPEL BIOMÉDICO
La TPI se transcribe a raíz de un solo gen, el TPI1, localizado en 12p13, el brazo corto del cromosoma 12. Su secuencia de aminoácidos ha sido observada en cientos de organismos, y en todos ellos esta enzima presenta parámetros similares. Sin embargo, este gen puede sufrir mutaciones que alteran su estructura e impiden su función.
La deficiencia genética de TPI en los humanos proviene de un gen recesivo autosómico. Si alguien es homocigoto respecto a este carácter (las personas heterocigotas no sufren esta patología), su TPI tendrá una fracción de la actividad que en una persona sana, desequilibrando las cantidades de DHAP y G3P (en favor de la primera). las personas que sufren esta enfermedad experimentan una anemia hemolítica y un trastorno neurodegenerativo como consecuencia y mueren prematuramente, antes de los 6 años. Es común sufrir también miopatías e infecciones a causa de esta mutación.
La patología afecta sobre todo al sistema nervioso y al circulatorio. Los más afectados son los glóbulos rojos, que acumulan demasiada DHAP, que en tales cantidades se vuelve tóxica y provoca la muerte de los eritrocitos. No tiene cura conocida, pero se puede aliviar mediante transfusiones de sangre. Se puede detectar durante la gestación.
Esta enfermedad se debe a una mutación que afecta al centro activo, cambiando el residuo de ácido glutámico por aspartato. El ácido glutámico está muy conservado en las TPI de todas las especies, haciendo testamento a su importancia. Al verse sustituido, convierte la TPI en una enzima termolábil, es decir, fácilmente inactivada por el calor. Hay otras mutaciones, una que cambia la glicina 122 por arginina y otra que cambia la fenilalanina 240 por leucina. Sin embargo, estas dos no causan patologías relevantes. La TPI no tiene mutaciones positivas, por lo que se considera una enzima “evolutivamente perfecta”
Por último, la triosa fosfato isomerasa también puede ser la clave para combatir uva de las enfermedades más mortíferas de nuestros días: la malaria. El Plasmodium falciparum, el protozoo parásito que causa esta enfermedad, sólo es capaz de producir ATP mediante la glucólisis. Por lo tanto, la TPI es de vital importancia para su supervivencia. Siguiendo este razonamiento, se está investigando la posibilidad de desarrollar un fármaco que pueda atacar específicamente a su triosa fosfato isomerasa. La dificultad radica en que, como la TPI es un estructura muy bien conservada en los seres vivos, hay muy pocas diferencias que permitan atacar únicamente al parásito y no crear una anemia hemolítica en la víctima, al perjudicar también a su propia TPI. El fármaco debe centrarse en las pocas diferencias entre ambas enzimas: los aminoácidos número 13 (metionina en humanos y cisteína en el parásito) y 96 (en vez de serina como los humanos, tendrá fenilalanina). Sin embargo, hay otro posible punto de ataque: la TPI del Plasmodium falciparum se asocia a la membrana celular con el aminoácido 183 (ácido glutámico en humanos, pero en el protozoo es una leucina completamente expuesta, lo que permita a la proteína asociarse a la membrana usando la fuerza hidrófoba).
REFERENCIAS
Torres, L. G. (Julio del 2007). CARACTERIZACIÓN DEL PATRÓN DE PLEGAMIENTO Y ASOCIACIÓN DE LA TRIOSAFOSFATO ISOMERASA DE HUMANO. Universidad Autónoma del estado de Hidalgo.
Sameer S Velanker, Soumya S Ray, Rajesh S Gokhale, Suma S, Hemalatha Balaram, P Balaram, MRN Murthy, Triosephosphate isomerase from Plasmodium falciparum:. the crystal structure provides insights into antimalarial drug design, Volume 5, Issue 6, 1997, Pages 751-761, ISSN 0969-2126
Wierenga, R. K. (2010, 7 agosto). Triosephosphate isomerase: a highly evolved biocatalyst. SpringerLink. https://link.springer.com/article/10.1007/s00018-010-0473-9?error=cookies_not_supported&code=76c1c0ea-5a47-4388-bc99-f66a94e10431
Torres, L. G. (Julio del 2007). CARACTERIZACIÓN DEL PATRÓN DE PLEGAMIENTO Y ASOCIACIÓN DE LA TRIOSAFOSFATO ISOMERASA DE HUMANO. Universidad Autónoma del estado de Hidalgo.
Carl Branden and John Tooze. 1999. Introduction to Protein Structure 2nd ed. Garland Publishing: New York, NY. pp 47-50
Jordy Calderón, Oswaldo Carrera, Álex Granja, David Harb, Nathaly Mie. (s/f). Deficiencia de Triosa Fosfato Isomerasa (TPI). Universidad de las Américas.
Knowles JR (marzo de 1991). «Catálisis enzimática: no es diferente, solo mejor». Naturaleza . 350 (6314): 121–4. doi : 10.1038 / 350121a0 . PMID 2005961
Burton PM et al, The active centre of triose phosphate isomerase, Biochem J. 1966 September; 100(3): 702–710, su pubmedcentral.gov (archiviato dall’url originale l’8 maggio 2006).
Burton PM et al, Studies on the sub-units of triose phosphate isomerase, Biochem J. 1968 May; 107(6): 737–744, su pubmedcentral.gov (archiviato dall’url originale l’8 maggio 2006)


