Por Andrea Martín Luque, Russell Ngonde Bela y María Lázaro De la Fuente
INTRODUCCIÓN AL TRABAJO
Se ha realizado un profundo estudio de la proteína β-amiloide para detallar su estructura, funciones y mecanismo de acción, además de la relación que establece con ciertas enfermedades tanto neurodegenerativas como no neurodegenerativas. Respecto a este apartado, cabe destacar la intervención de la beta amiloide en el desarrollo de la enfermedad de Alzheimer, debido a su derivación en placas.
En cuanto a la parte estructural de la proteína, describiremos y expondremos imágenes extraídas de Chimera principalmente, pero también otras que hemos buscado en diversas páginas web. Toda la información ha sido extraída de papers científicos o páginas web científicas,que serán especificadas en el apartado de webgrafía.
RESUMEN DE LA PROTEÍNA
En esta entrada hablaremos de proteína beta-amiloide con el mismo sentido que péptido beta-amiloide.
El β-amiloide es un péptido formado por 39 a 43 aminoácidos. Procede del corte secuencial de su proteína precursora, APP (Amyloid Precursor Protein), que es una proteína transmembrana. Ésta, al ser procesada por una vía amiloidogénica da lugar al péptido β-amiloide.
Entre las funciones fisiológicas del β-amiloide encontramos implicaciones en el metabolismo, como la activación de quinasas o la regulación del transporte de colesterol y protege contra el estrés oxidativo. También actúa como factor de transcripción y es una molécula proinflamatoria. Por otro lado, mutaciones autosómicas en la proteína precursora APP pueden causar la enfermedad del Alzheimer.
En cuanto a su localización, el β-amiloide se encuentra fundamentalmente depositado en las placas seniles presentes en el tejido cerebral. Aunque se sigue investigando acerca de sus funciones y enfermedades en las que está relacionado, se ha observado que tiene un efecto tóxico sobre las neuronas y actualmente se cree que funciona como primer eslabón en la cadena que desemboca en la enfermedad del Alzheimer.
ESTRUCTURA DE LA PROTEÍNA
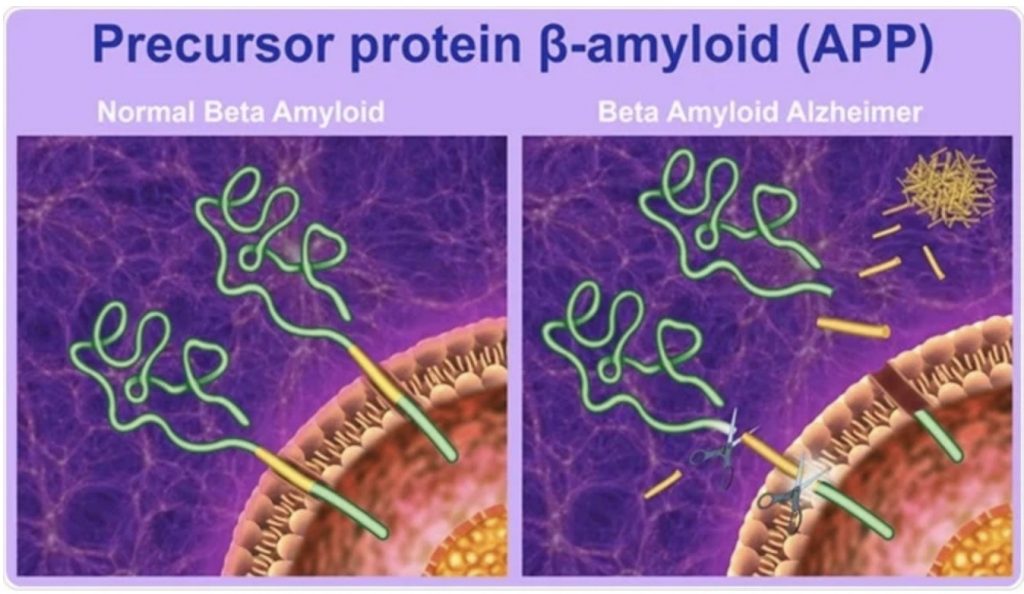
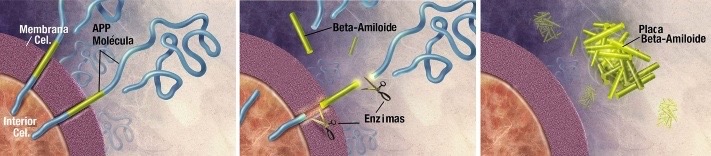
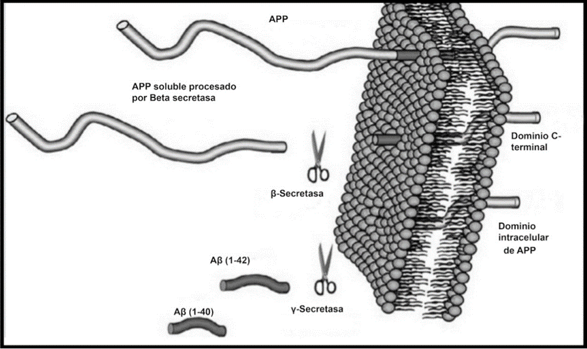
β-amiloide es un péptido que está formado por alrededor de 39-42 aminoácidos, lo que provoca que adopte una conformación especial. En su forma nativa, se encuentra en una conformación de random coil, es decir, no tiene una estructura ordenada. Proceden del corte proteolítico de la proteína precursora APP, glucoproteína de tipo I perteneciente a la membrana plasmática. La APP presenta 3 lugares de corte para 3 enzimas. 2 de estas enzimas (β- y γ-secretasas) dan lugar a la formación del péptido β-amiloide.
Este proceso en el que se produce el corte de la proteína precursora y que da lugar al péptido β-amiloide recibe el nombre de vía amiloidogénica.
Este péptido forma agregaciones en las que los residuos de aminoácidos del 1 al 17 se encuentran desordenados, y desde el residuo 18 al último, forman un motivo lámina beta – giro – lámina beta. Este motivo se forma mediante dos hojas β-paralelas, una formada por los residuos 18-26 y otra por los 31-42.
β-amiloide posee su extremo N-terminal fuera de la célula, a 28 aminoácidos de la zona transmembrana. En cambio, su extremo C-terminal sí se encuentra en el interior de la membrana. Estos extremos surgen de los respectivos cortes secuenciales realizados por las enzimas mencionadas anteriormente: la β-secretasa, que da lugar al extremo N-terminal, y por la γ-secretasa, que origina el extremo C-terminal.
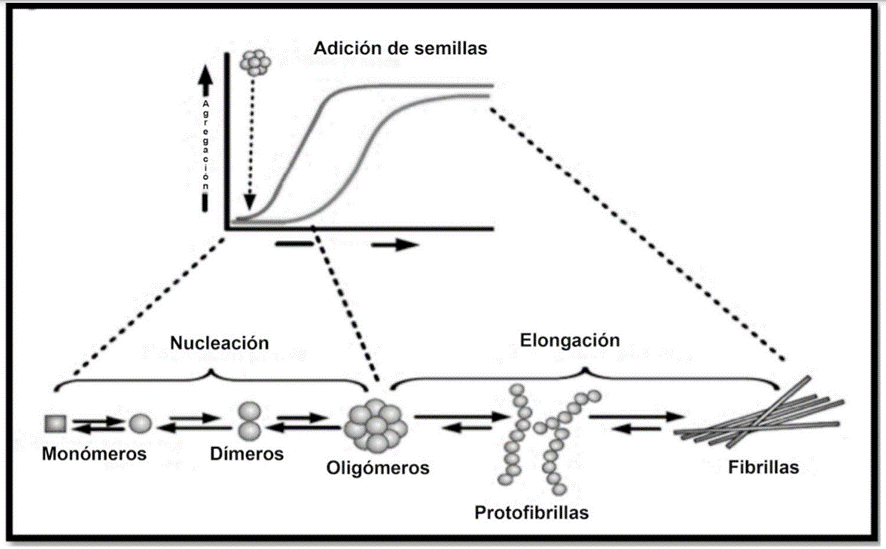
Las diferentes formas y tamaños que puede adoptar el β-amiloide dependen, en gran parte, de las condiciones en las que se produce la formación del mismo. En función de diferentes factores que siguen siendo objeto de estudio, el péptido sufre procesos de agregación que da lugar a una población de moléculas en distintas proporciones: dímeros, trímeros, tetrámeros, oligómeros solubles, protofibras y fibras de mayor tamaño.
El proceso de agregación de β-amiloide consiste básicamente en la conversión de monómeros solubles y fibras. El “random coil” en el que se encuentra el péptido inicialmente puede plegarse incorrectamente en estructuras β-plegadas, que tienen una alta probabilidad de agregarse, lo que tiene consecuencias tóxicas en las neuronas.
ESTRUCTURAS CON CHIMERA
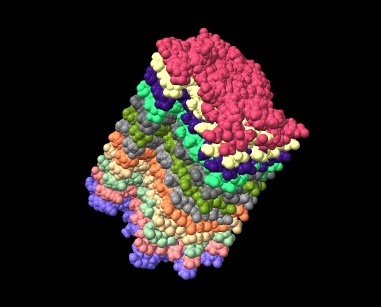

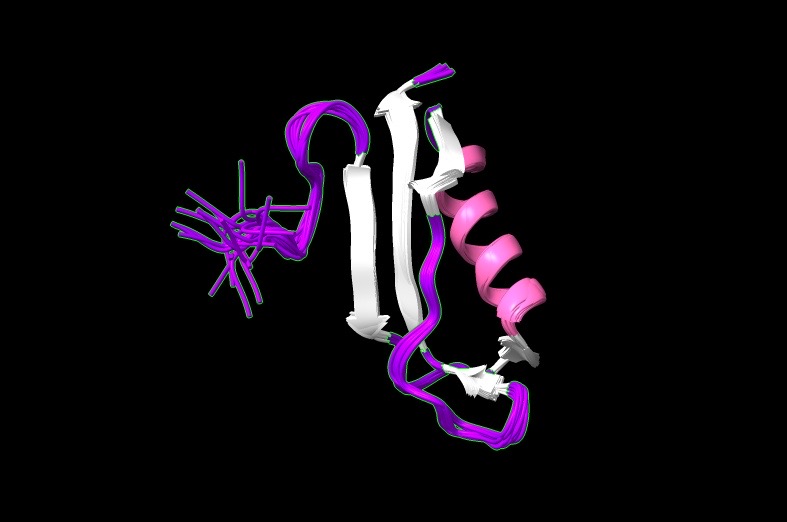
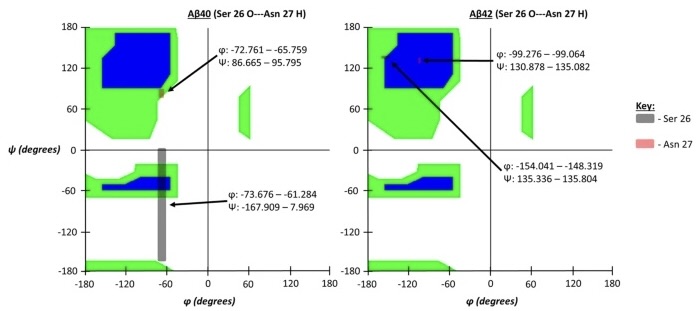
Podemos sacar dos conclusiones a partir de la representación de Ramachandran de diferentes ángulos de las isoformas del péptido β-amiloide.
- La cepa Aβ42 tiene una estructura secundaria que presenta hélices alfa.
- La dispersión de los valores de los ángulos es menor en dicha cepa.
FUNCIONES DE LA β-amiloide (fisiológicas y patológicas)
Existen funciones en las que el beta-amiloide no es patológica como por ejemplo: la activación de quinasas, protección contra el estrés oxidativo de la célula, regulación del transporte del colesterol, forma parte de los factores de transcripción y actividad microbiana vinculada con su acción proinflamatoria. Cuando este se convierte en patológica, desarrolla nuevas funciones y deja de tener otras que originalmente sí que poseía.
- TRANSMISIÓN DE INFORMACIÓN ENTRE NEURONAS
La proteína beta-amiloide forma parte de un grupo de moléculas endógenas encargadas de la regulación de la transmisión sináptica en el hipocampo y esta depende de la actividad de la neurona y se encarga de la liberación de las vesículas con neurotransmisores a la sinapsis neuronal.
Además participa en la alteración de componentes proteicos, inhibición de la plasticidad sináptica, muerte celular y disfunción cerebral.
- HOMEOSTASIS DEL COLESTEROL
El colesterol que producen los astrocitos del cerebro es transportado por proteínas apoE a las membranas externas de las neuronas, donde se encuentra un relación con el mantenimiento de las balsas lipídicas y el colesterol. Por tanto, existe una relación entre la producción de colesterol y el péptido beta-amiloide.
- DISFUNCIÓN NEURONAL Y ESTRÉS OXIDATIVO
El péptido βA actúa como un tóxico mitocondrial inhibiendo diversas enzimas mitocondriales, entre las que podemos destacar la citocromo c oxidasa, afectando así a la cadena de transporte de electrones donde se realiza la fosforilación oxidativa. Como consecuencia, se deteriora la producción de ATP, el consumo de oxígeno y el potencial de membrana de la mitocondria. No solo se une a la citocromo c, también podemos encontrarla unida a sustratos como la alcohol deshidrogenasa y la α-cetoglutarato deshidrogenasa (parte del ciclo de Krebs) que produce daños en el ADN mitocondrial, y por tanto, mutaciones en este.
- SEÑALIZACIÓN Y ACTIVACIÓN DE QUINASAS
La β-amiloide se le atribuye el inicio de una cascada de señalización que conlleva la acción de la quinasa ERK, que comunica con el medio extracelular, la quinasa N-terminal c-Jun fosforilada (pJNK), la quinasa serina (Akt), el sustrato receptor de la insulina y/o proteínas G, que a su vez modifican la activación de factores de transcripción y estas modifican la expresión del gen BACE1.
- PROINFLAMATORIA
La β-amiloide se internaliza en los vasos sanguíneos por acción de receptores RAGE, aumentando la afluencia de la βA vascular. Como consecuencia de la respuesta inflamatoria, ocurre una ruptura de la barrera vascular de la sangre con el cerebro y otros cambios neuríticos.
- QUELANTE DE METALES
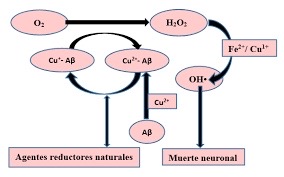
La beta-amiloide protege ante el daño oxidativo inducido por metales puede que se pueda relacionar con que esta proteína tiene condiciones oxidativas. La β-amiloide como antioxidante se transforma en pro-oxidante específicamente a través de su interacción con metales oxidantes.
MECANISMO DE ACTUACIÓN
Las neuronas se comunican mediante cargas eléctricas que circulan por los axones, liberando sustancias químicas, los neurotransmisores, a la sinapsis , espacio que comunica una neurona con otra. Existen células localizadas en el cerebro, los astrocitos y las microglías, encargadas de la eliminación de desechos y ayudan a evitar que las neuronas se conviertan en patológicas. Todos estos cambios tóxicos en el cerebro destruyen el equilibrio cerebral saludable provocando la aparición de enfermedades como el Alzheimer.
Estos cambios ocurren a lo largo de los años y están protagonizados por dos proteínas: beta-amiloide y tau, que se vuelven tóxicas para el cerebro.
· La proteína tau anómala se acumula y forma ovillos dentro de las neuronas. Cuando alcanza niveles muy elevados se expande por todo el cerebro.
· Las beta-amiloides se agrupan en placas, acumulándose entre las neuronas impidiendo así la transmisión de neurotransmisores por el espacio sináptico.
Estas proteínas, además de provocar el Alzheimer, afectan a procesos como que el sistema vascular no envíe suficiente sangre y nutrientes al cerebro, provocando una carencia de glucosa que impulse su actividad, o producir una inflamación crónica en las células microgliales, impidiendo eliminar los desechos, y en los astrocitos, impidiendo su reacción con las microglías alteradas.
De esta forma, las neuronas pierden su capacidad de comunicarse. En el proceso de muerte de las neuronas, el cerebro se va encogiendo, empezando por el hipocampo, encargado del aprendizaje y la memoria. Lo que conlleva a la pérdida de memoria, dificultad para el lenguaje y problemas en la toma de decisiones. A medida que la enfermedad se agrava se pierde la capacidad de pensar, recordar y funcionar de manera independiente.
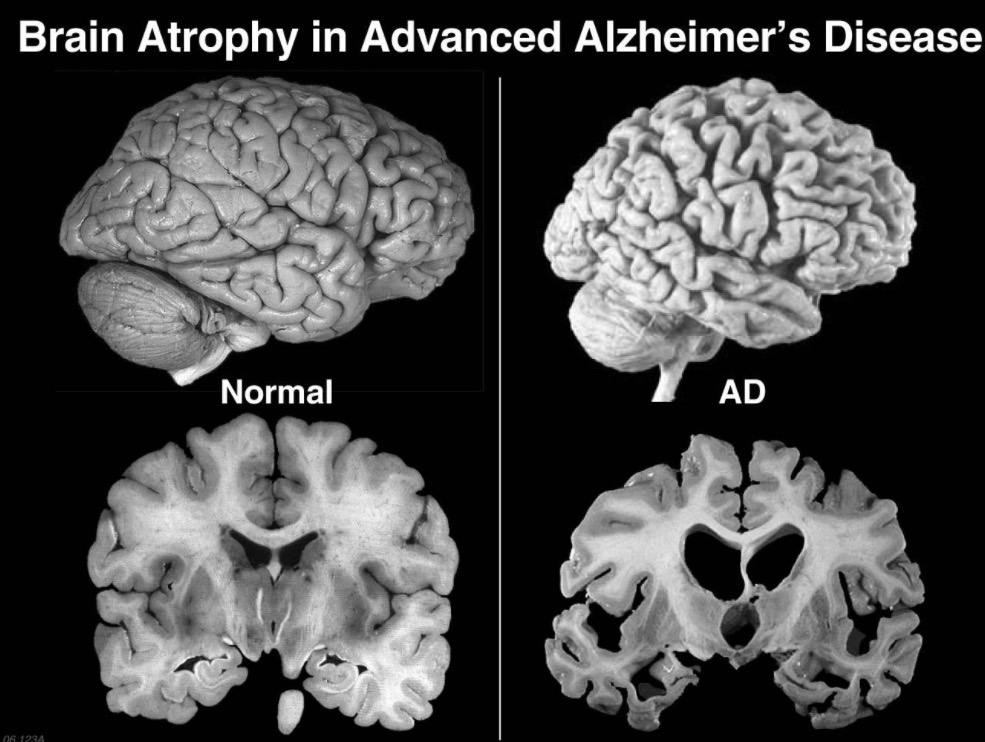
En estas dos imágenes podemos ver cómo varía el cerebro de un humano con y sin Alzheimer. Se puede apreciar que el que padece la enfermedad esta mucho mas encogido.
La aparición del Alzheimer está relacionada con la aparición de mutaciones en el gen de la proteína precursora amiloidea, en el cromosoma 21. La proteína precursora amiloidea origina el beta-amiloide al ser procesada por una vía amiloidogénica, el cual se deposita en las placas seniles del cerebro y causa efectos tóxicos para las neuronas. En el cromosoma 17 se encuentra el gen que codifica la síntesis de la proteína Tau. Mutaciones por fosforilación irreversible de este gen, provocan que la proteína pierda su función normal y facilitan su autoagregación, formando los ovillos neurofibrilares.
Sigue en estudio, pero se sabe que el depósito de beta-amiloide es una de las primeras causas de la enfermedad, pero son los ovillos neurofibrilares los que determinan la intensidad de la enfermedad y sus lesiones patológicas.
PAPEL BIOMÉDICO
- El Alzheimer es la principal enfermedad con la que el péptido β-amiloide está relacionado. La enfermedad de Alzheimer es uno de los desórdenes cerebrales más frecuentes. Se caracteriza por una serie de complicaciones celulares y moleculares que estimulan una disfunción cerebral progresiva. Los mecanismos moleculares y celulares que provocan las diferentes alteraciones en el sistema nervioso son prácticamente desconocidos. En cambio, sí existen marcadores histopatológicos que ayudan a la detección de la enfermedad. El más importante es la presencia de placas seniles, compuestas por el péptido β- amiloide, principal agente patológico del Alzheimer.
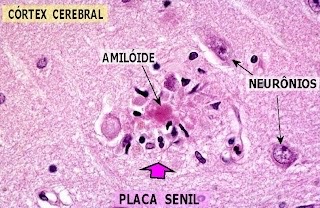
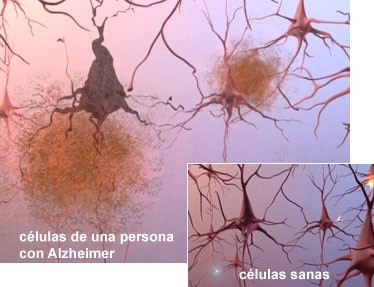
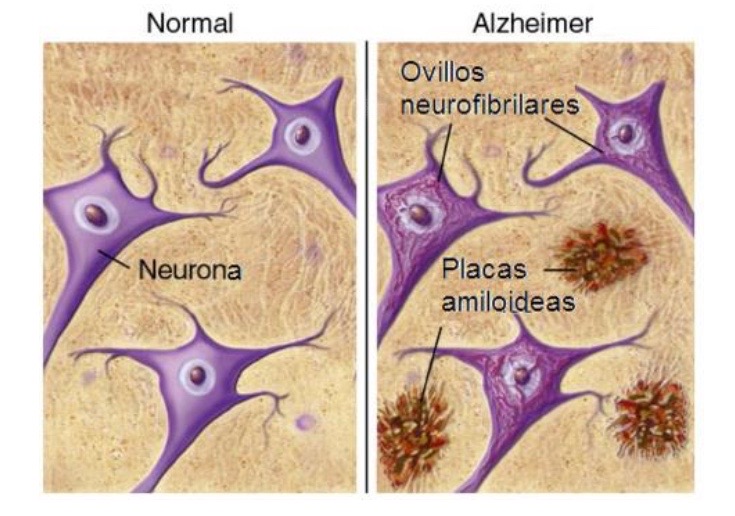
Aunque las fibras de β-amiloide también pueden ser tóxicas para el cerebro, se ha observado que la forma del péptido más perjudicial para el cerebro y la que más contribuye al desarrollo de la enfermedad son los oligómeros solubles. Estos son los que protagonizan la llamada cascada amiloide:
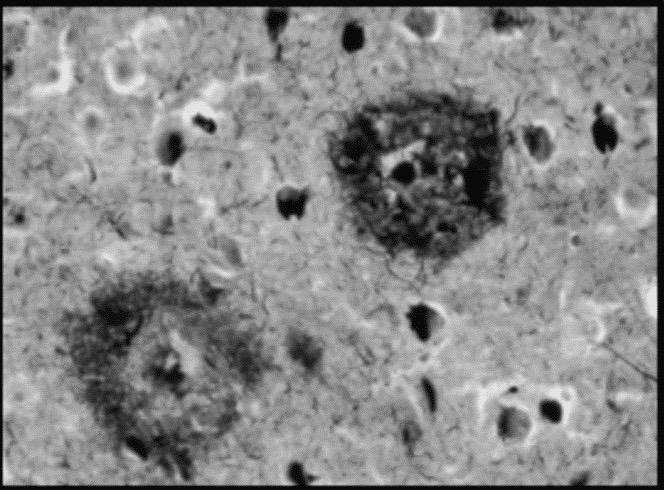
Se trata de una hipótesis que se fundamenta en diferentes experimentos, los cuales demuestran que diferentes interacciones del péptido β-amiloide en su extremo extracelular pueden tener consecuencias tóxicas en las células nerviosas. Se ha observado que diferentes formas del péptido son las responsables del comienzo de una cadena de acontecimientos citotóxicos. Como consecuencia, se produce una disminución de la masa cerebral y con ello se forman placas amiloides, entre otras consecuencias. Estudios han sugerido que el origen de estas placas no solo se encuentra en la formación de acumulaciones extracelulares del péptido, sino que también puede estar en las propias células.
También cabe destacar que se cree que las neuronas, aunque no son células fagocitarias de manera natural, podrían contribuir a la acumulación del β-amiloide captando el extremo extracelular del péptido por difusión simple o por endocitosis. Esto resulta peligroso porque durante la etapa de acumulación intracelular del péptido no se percibe acumulación extracelular, por lo que solo se puede detectar la posible enfermedad una vez que aparecen déficits cognitivos.
- Además del Alzheimer, β-amiloide también está relacionado con diferentes enfermedades como la miositis por cuerpos de inclusión, la demencia de los cuerpos de Lewy o la amiloidosis cerebral. En esta última enfermedad, tanto los síntomas como el diagnóstico son muy parecidos a los del Alzheimer. Esta similitud se puede comprobar en estudios de pacientes que padecen Alzheimer y otros que padecen demencia de los cuerpos de Lewy. La proporción del péptido β-amiloide en ambas patologías es muy parecida. En este caso, la proteína TAU es determinante para un correcto diagnóstico, ya que se encuentra en una proporción mayor en el líquido cefalorraquídeo de pacientes con Alzheimer.
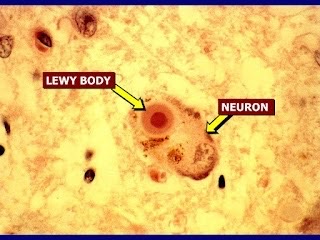
- La amiloidosis cerebral es una enfermedad que se desarrolla de manera independiente al Alzheimer, pero también puede estar relacionada a ella. Además, existen mutaciones en el gen que codifica para la proteína precursora APP que pueden causar la aparición de la enfermedad en pacientes más jóvenes. En este caso, la presencia en forma de depósito del péptido β-amiloide provoca la plasmólisis de los vasos sanguíneos provocando una hemorragia severa en el encéfalo del paciente.
- La agregación de las β-amiloide en las fibras amiloides y su depósito en placas e inclusiones intracelulares es el distintivo de la enfermedad amiloidea. La acumulación y depósito de las fibras amiloides, conocido como amiloidosis, está asociado a muchas patologías como el Alzheimer, el Parkinson, la diálisis y la diabetes de tipo II.
BIBLIOGRAFÍA
Bastidas, Oscar H., et al. “Few Ramachandran Angle Changes Provide Interaction Strength Increase in Aβ42 versus Aβ40 Amyloid Fibrils.” Scientific Reports, vol. 6, no. 1, 3 Nov. 2016, p. 36499, www.nature.com/articles/srep36499, 10.1038/srep36499. Accessed 28 Dec. 2021.
“Beta-Amiloide.” Www.quimica.es, www.quimica.es/enciclopedia/Beta-amiloide.html#_note-4/. Accessed 28 Dec. 2021.
Gra Menéndez, Silvia, et al. “Péptido Beta Amiloide, Proteína Tau Y Enfermedad de Alzheimer.” Revista Cubana de Investigaciones Biomédicas, vol. 21, no. 4, 1 Dec. 2002, pp. 253–261, scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-03002002000400006.
Lahiri, Debomoy K., and Bryan Maloney. “Beyond the Signaling Effect Role of Amyloid–β42 on the Processing of AβPP, and Its Clinical Implications.” Experimental Neurology, vol. 225, no. 1, 1 Sept. 2010, pp. 51–54, www.ncbi.nlm.nih.gov/pmc/articles/PMC2922469/, 10.1016/j.expneurol.2010.04.018. Accessed 28 Dec. 2021.
Macaluso, Publicado por Juan Pedro. ANGIOPATÍA AMILOIDE CEREBRAL. www.elrincondelamedicinainterna.com/2011/06/angiopatia-amiloide-cerebral.html. Accessed 28 Dec. 2021.
Morgan, Carlos, et al. “Structure and Function of Amyloid in Alzheimer’s Disease.” Progress in Neurobiology, vol. 74, no. 6, 1 Dec. 2004, pp. 323–349, www.sciencedirect.com/science/article/pii/S0301008204001972, 10.1016/j.pneurobio.2004.10.004. Accessed 28 Dec. 2021.
“PDB101: Molecule of the Month: Amyloid-Beta Precursor Protein.” RCSB: PDB-101, 2019, pdb101.rcsb.org/motm/79.
Presentada Por La Bachiller, Tesis, et al. EVALUACIÓN de LA INTERACCIÓN ENTRE CICLÓTIDOS PRESENTES EN LA FAMILIA RUBIACEAE Y ESTRUCTURAS de β-AMILOIDE a NIVEL de MECÁNICA MOLECULAR Para Optar El Título Profesional de Ingeniera Biotecnóloga. 2018.
S.L.U, 2021 Viguera Editores. “La Proteína Beta Amiloide Es Esencial Para La Transmisión de La Información Entre Neuronas : Neurología.com.” Www.neurologia.com, www.neurologia.com/noticia/1916/la-proteina-beta-amiloide-es-esencial-para-la-transmision-de-la-informacion-entre-neuronas.
Wang, Hao, et al. “Regulation of Beta-Amyloid Production in Neurons by Astrocyte-Derived Cholesterol.” Proceedings of the National Academy of Sciences, vol. 118, no. 33, 12 Aug. 2021, p. e2102191118, 10.1073/pnas.2102191118. Accessed 30 Aug. 2021.
Zou, Kun, et al. “A Novel Function of Monomeric Amyloid Beta-Protein Serving as an Antioxidant Molecule against Metal-Induced Oxidative Damage.” The Journal of Neuroscience: The Official Journal of the Society for Neuroscience, vol. 22, no. 12, 15 June 2002, pp. 4833–4841, pubmed.ncbi.nlm.nih.gov/12077180/. Accessed 28 Dec. 2021.


