El PS II: DE LAS PLANTAS A LA BOCA
Proyecto de investigación realizado por Manuel Marín, Joaquín Palacios & Juan Martín (1º Biología Sanitaria – UAH)
INTRODUCCIÓN
Un fotosistema se puede definir como un complejo proteico situado en la membrana tilacoidal de los cloroplastos —en el interior del cloroplasto se encuentran los tilacoides, que son sacos aplanados delimitados por una membrana, la cual se puede formar desde la membrana interna por un proceso de emisión de vesículas—, donde se agrupan los pigmentos fotosintéticos. Prácticamente todo el mundo ha oído mencionar alguna vez una referencia a la clorofila cuando se habla de plantas. De hecho, el uso de la palabra está tan extendido que incluso podemos encontrar chicles con sabor a clorofila en el mercado. Pero, ¿sabías que cuando te comes un chicle de clorofila estás saboreando el verdadero impulsor de la vida compleja en la Tierra? Esto último puede resultar muy metafórico, pero la realidad es que la clorofila es un pigmento fotosintético, capaz de captar la energía lumínica procedente del sol y transformarla en energía química. Durante este artículo dirigiremos nuestra atención hacia el fotosistema II, situado en las membranas del tilacoide apiladas, cuyo centro de reacción contiene dos moléculas de clorofila a2, denominadas P680 (generalmente), que presentan su máxima absorción a una longitud de onda de 680 nm.
ORIGEN, FORMACIÓN Y ESTRUCTURA
El fotosistema II o agua-plastoquinona oxidorreductasa es el primer complejo conocido como fotosistema durante la evolución de la tierra y fue uno de los primeros casos de proteínas integrales de membrana de las que se pudo determinar su estructura. Inicialmente se estudió su estructura en bacterias púrpuras (Rhodobacter sphaeroides), cuyo fotosistema II estaba conformado por un centro de reacción P870 (par especial de bacterio-clorofila a) que se excitaban al recibir fotones de longitudes de onda menores a 870 nm transfiriendo electrones a otro complejo llamado bacterio-feofitina que los transfería de ahí a una coenzima Q o ubiquinona enlazada, hasta reducirla por completo (Q ↔ QH2). (Chirino, A. J., et al. (1994)
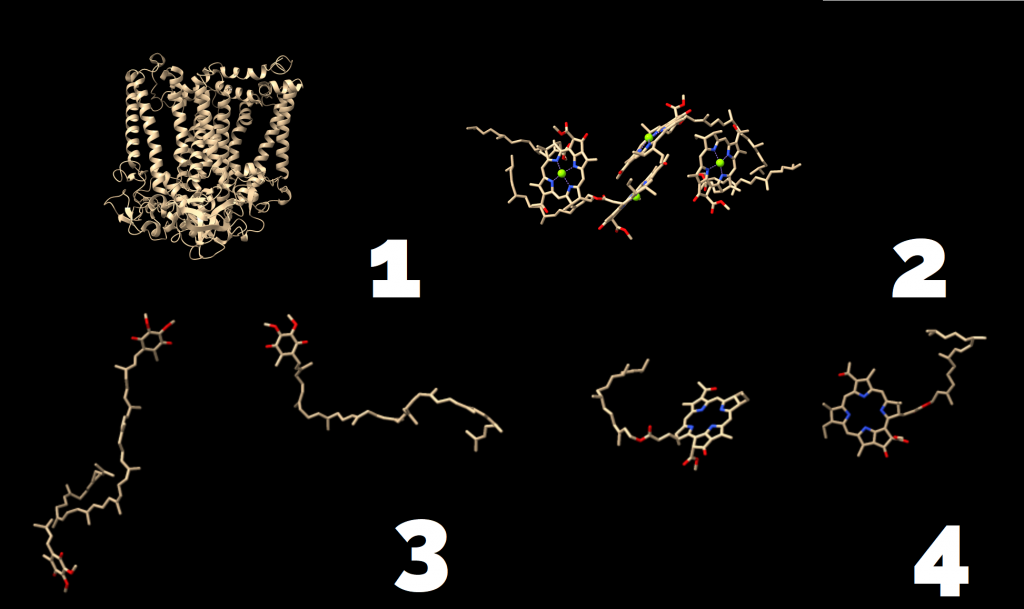
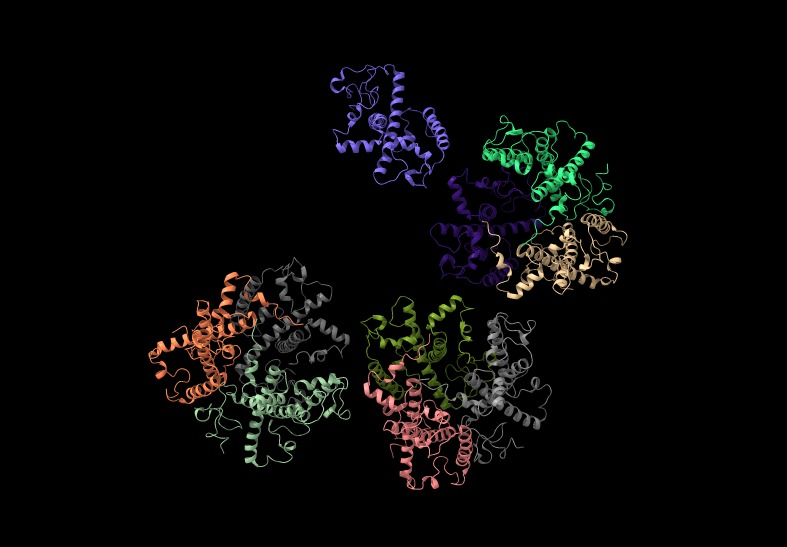
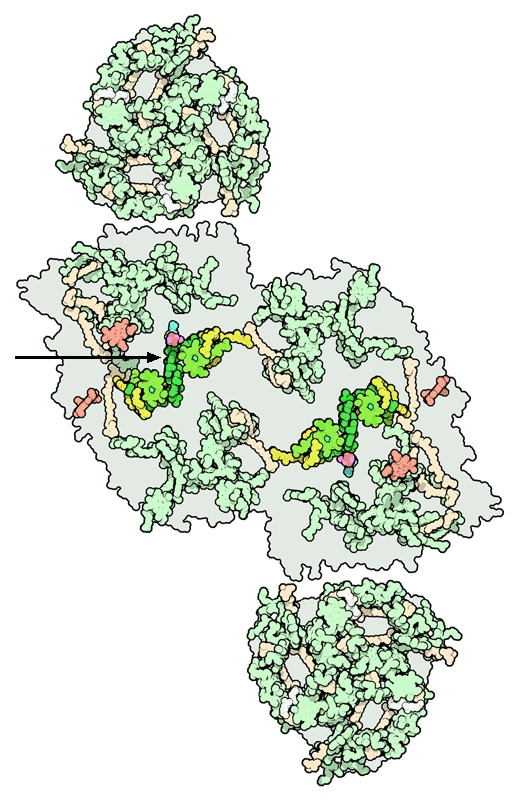
Sin embargo, este PS II estudiado previamente no fue el único en descubrirse, ya que a día de hoy sabemos que el PS II es estructuralmente diferente en la mayoría de las plantas que conocemos hoy en día. Por ejemplo, el fotosistema de las cianobacterias Thermosynechococcus elongatus está compuesto principalmente de dos subunidades (D1 y D2) que forman un dímero, aunque el complejo entero actúe como un monómero. Cada subunidad está compuesta por 17 subunidades proteicas intrínsecas y 3 extrínsecas, conteniendo 35 clorofilas, 2 feofitinas, 12 carotenoides, 2 grupos hemo (Cyt c559 y Cyt c550), 1 hierro no perteneciente a grupo hemo, 2 iones de calcio, 1–2 iones de cloro, 3 plastoquinonas y 4 iones de manganeso, junto con más de 25 lípidos.
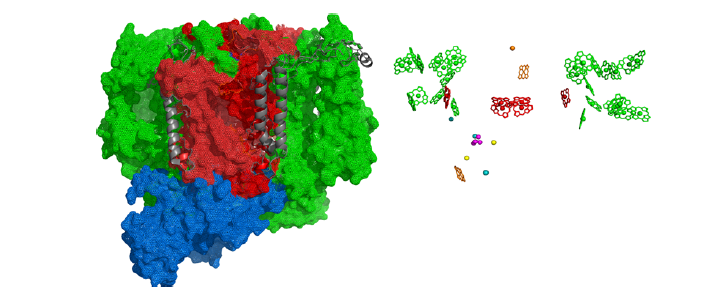
A su vez, se pueden distinguir tres dominios proteicos principales en el fotosistema: el transmembrana, el complejo colector de luz interior y el dominio extrínseco. El primero está formado por las subunidades D1 y D2 que están unidas al par especial P680 y al complejo de desprendimiento de oxígeno (Mn4Ca), que realiza la fotólisis del agua, estando presentes también unidades alfa y beta del citocromo b559 y dos polipéptidos helicoidales transmembrana. El complejo colector de luz interior, llamado así por ser el más cercano al centro de reacción, tiene dos proteínas principales: CP43 y CP47, que contienen clorofila que recibe fotones de complejos colectores de luz más alejados y los transporta al par especial. Por último, el extrínseco tiene una subunidad llamada MSP que protege al fotosistema frente a la fase acuosa solvente.
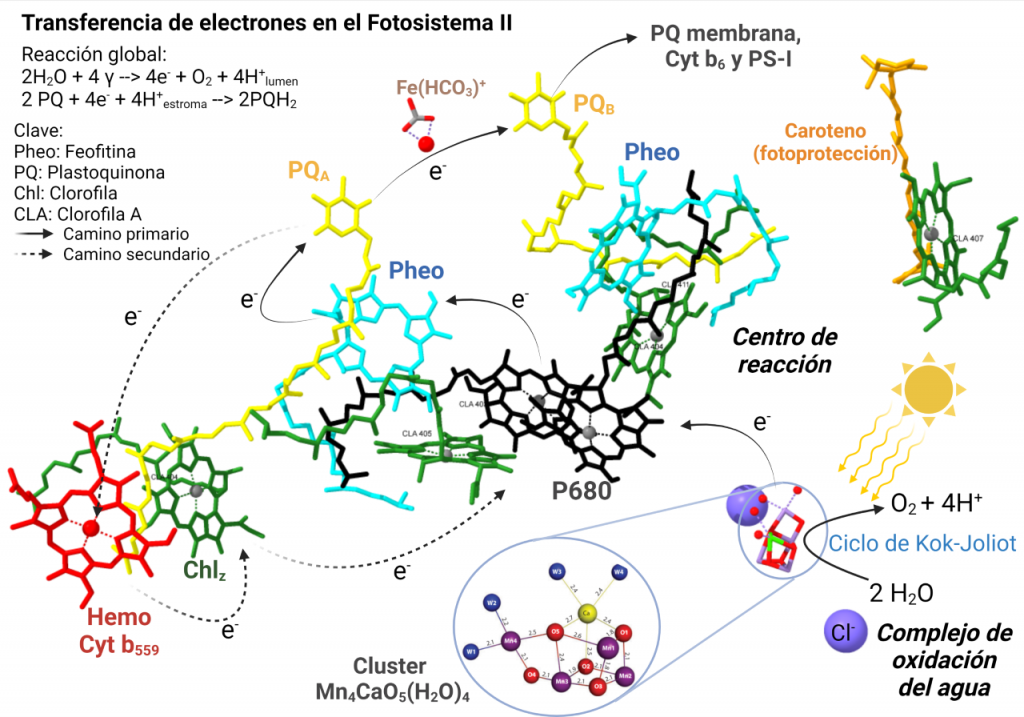
Los componentes de la cadena transportadora de electrones son (en orden): las clorofilas de CP43 y CP47 (en el complejo colector de luz) que reciben fotones de la luz; pasándoselos a las clorofilas del P680, las cuales se excitan y transfieren los electrones a las feofitinas, que por último consiguen reducir la plastoquinona, que se va hacia el siguiente componente fotosintético (Williamson, A., Conlan, B., et al. (2011).
MECANISMO Y FUNCIÓN BIOLÓGICA
Todas las clorofilas presentes en cualquier fotosistema colaboran en formar un complejo antena o captador de luz que presenta unas 300 moléculas de pigmentos fotosintéticos, principalmente clorofila (a y b). Cuando una molécula de clorofila se excita al captar un fotón, transfiere esa energía a la molécula adyacente, y ésta a otra, hasta llegar a la clorofila situada en el centro de reacción, a través de un proceso llamado «light harvesting complex» (LHCs) (Croce y Van Amerongen 2014), cuya estructura ya se menciono en la introducción.
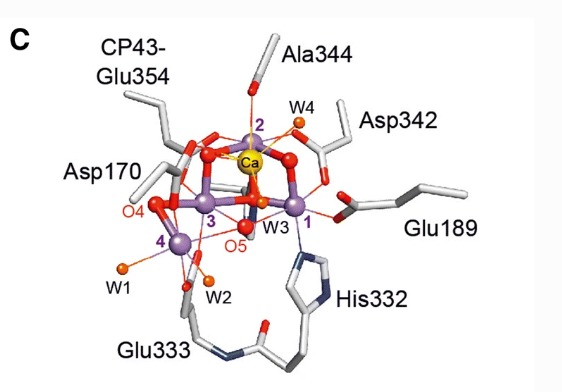
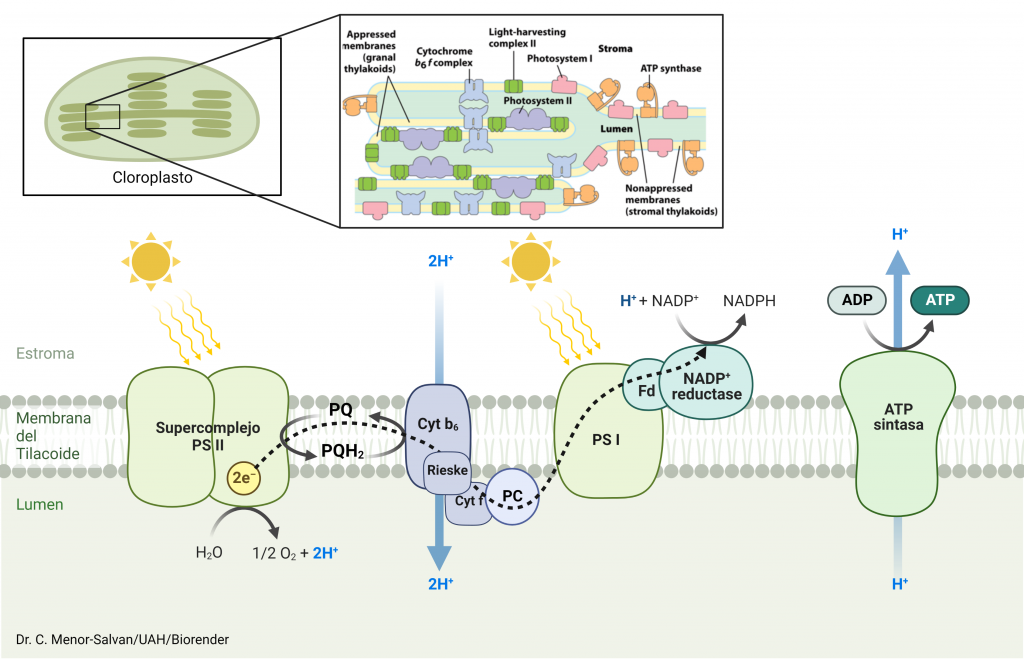
El complejo OEC (complejo de desprendimiento de oxígeno, de fórmula Mn4O5Ca) del fotosistema II rompe 2 moléculas de agua y consigue liberar sus electrones, produciendo 1 molécula de O2 y 4 protones. Esta reacción libera 4 electrones que al llegar, por una serie de pasos, hasta las clorofilas localizadas en este complejo, desplazan a otros electrones que habían sido previamente excitados por la luz y liberados desde el fotosistema II. Estos electrones liberados pasan a una plastoquinona que los cederá al citocromo b6/f, el cual, con la energía de los electrones captados, introduce 4 protones en el interior del tilacoide. El complejo citocromo b6/f cede entonces los electrones a una plastocianina, y ésta al complejo fotosistema I, que gracias a la energía de la luz que captan sus clorofilas eleva de nuevo la energía de los electrones. Asociada a este complejo está la ferredoxina-NADP+ reductasa, la cual reduce NADP+ en NADPH, que queda en el estroma. Los protones incorporados en el interior del tilacoide y los del estroma forman un gradiente capaz de producir ATP gracias a la ATP sintasa, cuyo centro catalítico está orientado hacia el estroma. Tanto el NADPH como el ATP serán utilizados en el ciclo de Calvin, que es una ruta metabólica en la que se fija el CO2 por la RUBISCO (ribulosa-1,5-bisfosfato), la cual produce moléculas de fosfoglicerato a partir de CO2. (Cardona, et al. (2012)
Un aspecto importante y a tener en cuenta es que dentro de las membranas fotosintéticas, tanto el fotosistema I como el II trabajan juntos para crear el potencial REDOX necesario para llevar a cabo múltiples reacciones del proceso fotosintético, (Blankenship 2014).
IMPLICACIONES BIOMÉDICAS, MEDIOAMBIENTALES Y TECNOLÓGICAS Y CURIOSIDADES
Está claro que un mecanismo tan complejo y evolucionado como es este fotosistema, se ha estado estudiando durante muchos años y es algo que se sigue estudiando a día de hoy por sus posibles implicaciones futuras para la sociedad.
Por un lado, se puede decir que el fotosistema II es la única enzima de todo el planeta que es capaz de oxidar el agua hacia O2, lo cual es imprescindible para la fotosíntesis y la hace vital para los seres vivos.
También se está investigando el fotosistema II para generar, recolectar y almacenar nuevas energías renovables.
A) Entendiendo como la naturaleza almacena energía y sobre todo utiliza la luz solar para separar las moléculas de agua, se podrían abrir futuras puertas hacia la recolección y almacenaje de la energía solar, lo que podría satisfacer considerablemente las demandas energéticas con una «fotosíntesis artificial».
B) Pero sobre todo la ciencia ha puesto en el punto de mira a la fotosíntesis oxigénica, en lo que podría ser uno de los avances del futuro, ya que tiene un gran potencial que se podría explotar al poseer principios nunca antes vistos que pueden brindar avances tecnológicos sin igual. La explotación de la maquinaria fotosintética estaría orientada hacia la producción de nuevas formas de energía renovables y absolutamente limpias: generando directamente electricidad o combustibles almacenables (Abrahamsson, 2001).
Esto es debido a que actualmente vivimos en una sociedad dependiente de combustibles fósiles, en la que los países pelean por el control de los mismos, además del constante aumento del CO2 y el efecto invernadero, que estimulan las enfermedades humanas, por lo que es estrictamente necesario desarrollar nuevas formas de energía que garanticen superar estos problemas y crear una sociedad del futuro.
La forma de energía que podría ser la indicada sería sin duda alguna el HIDRÓGENO, puesto que es el elemento más abundante del universo y por sus características únicas, es el mejor candidato. Hay muchos contras ya que una transición a esta energía será cara y larga, pero existe un método viable y muy efectivo para obtenerlo, gracias a la acción de la enzima hidrogenasa (que cataliza la oxidación del hidrógeno molecular) y a una modificación que permite aislar metabólicamente su función y la del PSII, creando un entorno favorable para que se lleve a cabo esta obtención (Melis et al., 2000; 2001; Zhang et al., 2002). Estos mecanismos de obtención pueden ser, alterando el metabolismo de organismos ya existentes (lo que es lo mismo, modificar a los organismos fotosintéticos con esta modificacion para crear el entorno favorable en estos) , o sintetizando artificialmente miméticos moleculares de los procesos fotosintéticos, en cuanto a absorción lumínica, conversión de energía, transferencia de electrones y oxidación del agua, lo cual sería más costoso ya que partiríamos de cero (Abrahamsson, 2001; Tran, 2001; Moore et al., 2002). Esto promete un gran futuro y situa al fotosistema II como el complejo molecular más importante en la supervivencia del ser humano y la vida en general.
REFERENCIAS
Abrahamsson, L. (2001) Electron transfer in Ruthenium-Manganese complexes for
artificial photosynthesis. Acta Universitatis Upsaliensis, Comprehensive Summaries of
Uppsala Dissertations from the Faculty of Science and Technology 669. Uppsala. ISBN 91-
554-5154-3.Blankenship, J. C.,Fihn, S. D., Alexander, K. P., Bittl, J. A., Byrne, J. G., Fletcher, B. J., … & Smith, P. K. (2014). 2014 ACC/AHA/AATS/PCNA/SCAI/STS focused update of the guideline for the diagnosis and management of patients with stable ischemic heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines, and the American Association for Thoracic Surgery, Preventive Cardiovascular Nurses Association, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. Journal of the American College of Cardiology, 64(18), 1929-1949.
Cardona Londoño, T. (2004). Recientes avances en fotosíntesis-el fotosistema II y el complejo oxidante de agua.
Cardona, T., Sedoud, A., Cox, N., & Rutherford, A. W. (2012). Charge separation in photosystem II: a comparative and evolutionary overview. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1817(1), 26-43.
Chirino, A. J., Lous, E. J., Huber, M., Allen, J. P., Schenck, C. C., Paddock, M. L., Feher, G., & Rees, D. C. (1994). Crystallographic analyses of site-directed mutants of the photosynthetic reaction center from Rhodobacter sphaeroides. Biochemistry, 33(15), 4584–4593. https://doi.org/10.1021/bi00181a020
Croce, R., & Van Amerongen, H. (2014). Natural strategies for photosynthetic light harvesting. Nature chemical biology, 10(7), 492-501.
Jorquera, O., Hernández, J., & Herrera, L. (2001). Producción biofotolítica de hidrógeno. Ciencia Abierta. Revista electrónica, 16.
Melis, A., Zhang, L., Forestier, M., Ghirardi, M., and Seibert, M. (2000) Sustained
photobiological hidrogen gas production upon reversible inactivetion of oxygen
evolution in the green alga Chlamydomonas reinhardtii. Plant Physiology 122: 127-135.Molecular graphics and analyses performed with UCSF ChimeraX, developed by the Resource for Biocomputing, Visualization, and Informatics at the University of California, San Francisco, with support from National Institutes of Health R01-GM129325 and the Office of Cyber Infrastructure and Computational Biology, National Institute of Allergy and Infectious Diseases.
PDB-101: Educational resources supporting molecular explorations through biology and medicine. Christine Zardecki, Shuchismita Dutta, David S. Goodsell, Robert Lowe, Maria Voigt, Stephen K. Burley. (2022) Protein Science 31: 129-140 doi:10.1002/pro.4200
UCSF ChimeraX: Structure visualization for researchers, educators, and developers. Pettersen EF, Goddard TD, Huang CC, Meng EC, Couch GS, Croll TI, Morris JH, Ferrin TE. Protein Sci. 2021 Jan;30(1):70-82.
UCSF ChimeraX: Meeting modern challenges in visualization and analysis. Goddard TD, Huang CC, Meng EC, Pettersen EF, Couch GS, Morris JH, Ferrin TE. Protein Sci. 2018 Jan;27(1):14-25.
Wada, M., & Kong, S. G. (2018). Actin-mediated movement of chloroplasts. Journal of cell science, 131(2), jcs210310. https://doi.org/10.1242/jcs.210310
Williamson A, Conlan B, Hillier W, Wydrzynski T. The evolution of Photosystem II: insights into the past and future. Photosynth Res. 2011 Jan;107(1):71-86. doi: 10.1007/s11120-010-9559-3. Epub 2010 May 29. PMID: 20512415.