Receptores de estrógenos, ¿cuál es su papel menos conocido?
Por Natalia Sanz Sacristán y Jorge Villa Díaz. Biología Sanitaria, UAH.
Introducción
Los receptores de estrógenos (ER) son proteínas que pertenecen a una superfamilia de receptores nucleares (NR). Los ER se ligan a los estrógenos circulantes y actúan como factores de transcripción, regulando la expresión génica en respuesta a estímulos fisiológicos y patológicos. (Arenas, 2007) (Noriega-Reyes, 2008).
Dentro de los estrógenos, el estradiol es el que ejerce efectos estrogénicos más potentes, los cuales están regulados por los ER. Los principales receptores son el ERα y el ERβ. (Serrano Alandí, 2022).
Como se ha mencionado, el ERα y el ERβ regulan funciones fisiológicas en la transcripción de genes diana, además de expresarse en una gran variedad de células y tejidos a nivel reproductivo, como las glándulas mamarias, útero, vagina y ovarios en hembras, y testículos, epidídimo y próstata en machos, interviniendo en procesos de crecimiento, desarrollo y diferenciación celular. También desarrolla funciones a nivel cardiovascular, esquelético y nervioso. (Márquez, 2010) (Coromoto, 2009).
Los estrógenos y sus receptores, a nivel general, son conocidos como hormonas relacionadas con el sexo femenino, pero desarrollan un papel importante en el hombre. Están implicados en procesos de formación de tumores y desarrollo del cáncer en diversos órganos como, por ejemplo, el cáncer de próstata, en el que se promueve la progresión de la enfermedad de distintas formas.
Estructura
Los receptores de estrógeno pertenecen a la clase 1 de la superfamilia de los NR, que actúan como factores de transcripción ligando-dependientes y regulan la expresión genética.
Anteriormente, solo se conocía el ERα que se encargaba de realizar todas sus funciones, pero tiempo después se identificó otro receptor de estrógenos, denominado ERβ, en próstata de rata. Se vió que ERα y ERβ contenían dominios estructurales y funcionales comunes entre sí.
Ambas isoformas fueron purificadas y caracterizadas desde diferentes tejidos, explicando así su expresión diferente en cada tejido y los efectos selectivos de los estrógenos. (Coromoto, 2009).
Según Diana C. Márquez, M.D., los receptores de estrógenos, especialmente el ERα, están organizados en 6 dominios, nombrados con las letras de la “A” a la “F”:
- Dominio A/B: localizado en el lado amino-terminal. Tiene función de activación de la transcripción genética y varios sitios de fosforilación, importantes en el proceso de activación de la proteína.
- Dominio C: región de unión al ADN.
- Dominio D: región de bisagra. Participa en la unión a una proteína chaperona, la cual permanece unida al receptor mientras éste se encuentre en un estado inactivo.
- Dominio E/F: localizado en el extremo carboxi-terminal. Es el dominio de unión al ligando (LBD), donde se une la hormona. Esta región es altamente específica, es decir, que el receptor de estrógeno une estrógeno con alta afinidad, pero no otras hormonas esteroideas. Otras funciones de este dominio son la activación de la transcripción, dimerización, interacción con otras proteínas co-activadoras o co-represoras de la transcripción, fosforilación y localización nuclear.
El ERα y ERβ se diferencian en que el ERβ tiene una cadena de aminoácidos más corta. ERβ mantiene los mismos dominios pero, al dominio carboxi-terminal le falta una porción que determina la unión de ciertos antiestrógenos. (Coromoto, 2009).
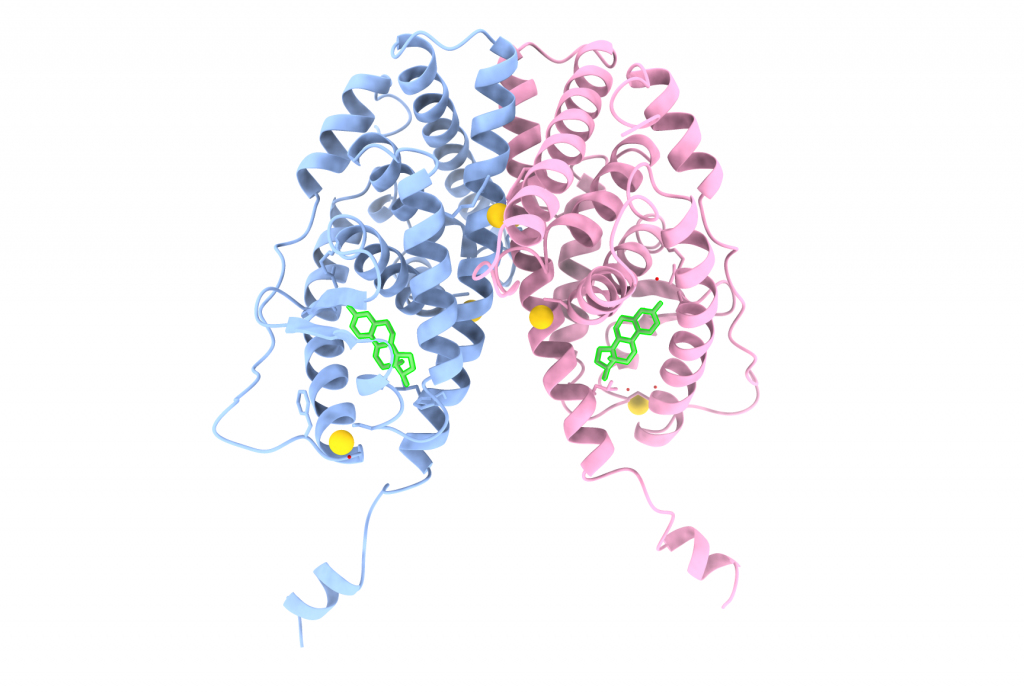
Se observa que la estructura de la proteína está formada por dos cadenas, A (azul) y B (rosa), de hélices α, mayoritariamente. Ademá de dos moléculas de estradiol (verde) e iones de oro (amarillo).
Como hemos explicado, el ER se compone de varios dominios que se conectan formando una cadena larga.
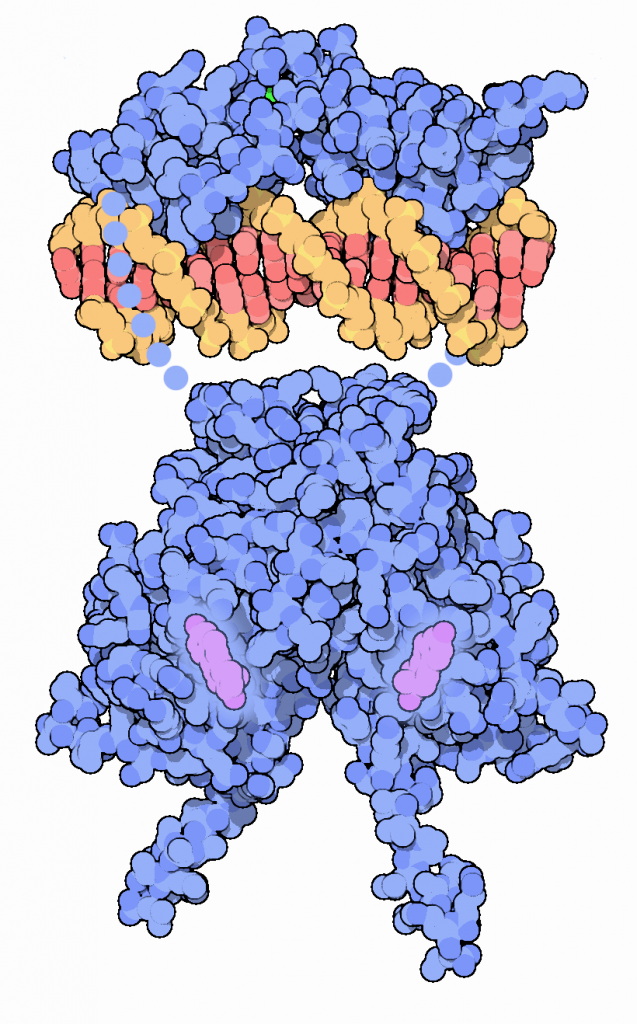
Observando la representación del receptor de estrógenos, figura 3:
- La zona del dominio de unión al ADN se encuentra en el extremo superior del receptor, que reconoce secuencias específicas de ADN.
- El dominio de transactivación se encuentra por encima del anterior, aunque no es visible.
- Las moléculas de estradiol están conectadas por debajo con el dominio de unión al ADN.
- El dominio de unión a la hormona se encuentra en la parte inferior de la figura, conectado a las moléculas de estradiol. (Goodsell, 2003).
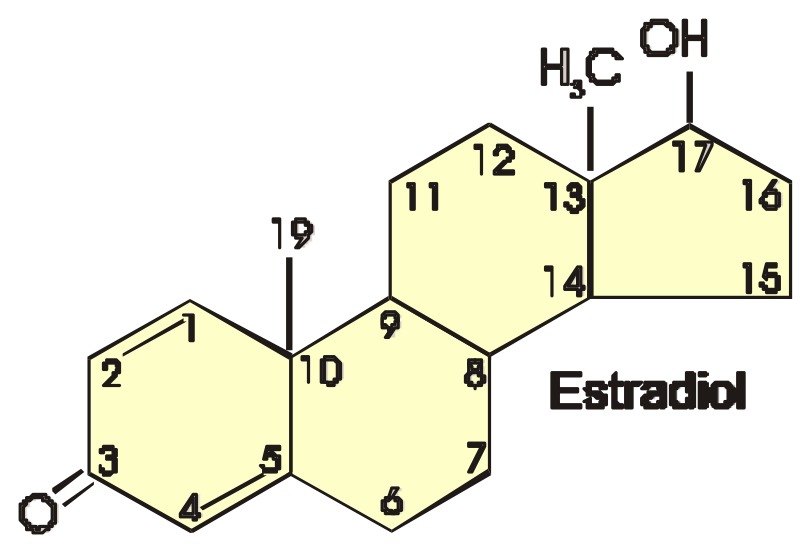
Como hemos mencionado anteriormente, estos receptores se van a ligar con los estrógenos circulantes, como el estradiol. En la figura 4, visualizamos la estructura química del estradiol, formado por tres anillos ciclohexanos y un anillo de ciclopentano. Tiene 18 átomos de carbono (C), 3 dobles enlaces en el primer anillo, un grupo hidroxilo (OH) en C3 y otro OH en C17.
Mecanismo de acción
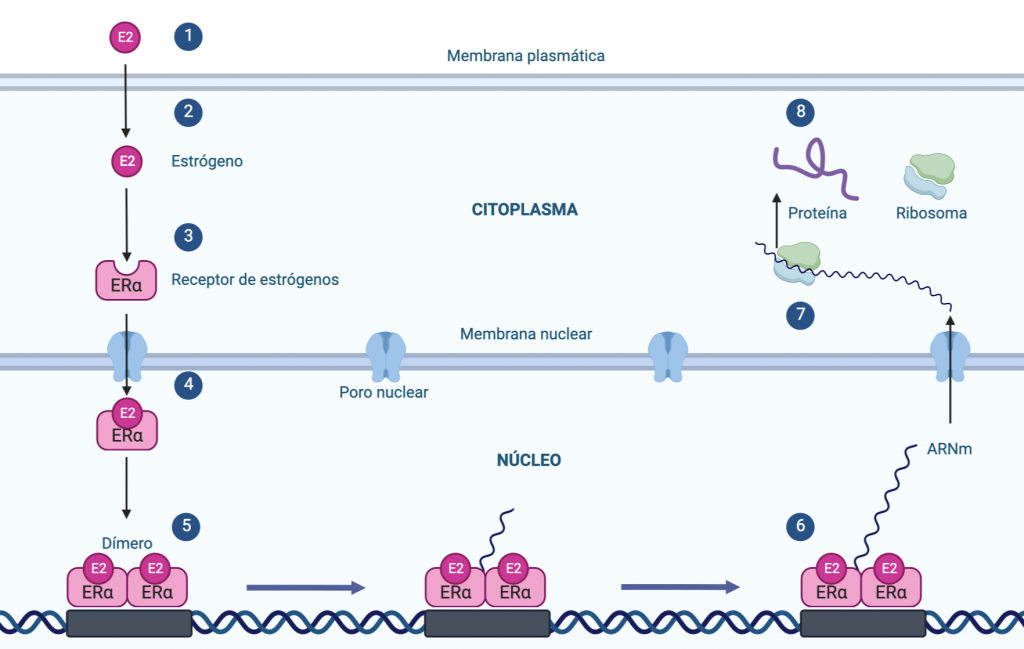
Existen diferentes mecanismos de acción de los receptores de estrógenos, pero nos enfocamos en el mecanismo clásico de acción nuclear, que sigue los siguientes pasos:
- Los estrógenos circulan unidos a células plasmáticas por el plasma sanguíneo. Estas células los llevan hasta la célula.
- Una vez el estrógeno ha llegado a la célula, este atraviesa la membrana y entra en el citoplasma.
- En el citoplasma, el estrógeno se une al receptor de estrógenos, que estaba inactivado por su asociación a proteínas HSP.
- La unión de la hormona con el receptor produce un cambio conformacional que promueve la homodimerización o heterodimerización del receptor, facilitando la entrada del complejo hormona-receptor al núcleo a través de los poros nucleares.
- Dentro del núcleo, el dímero se une a regiones diana del ADN que contienen los genes que deben ser activados, iniciando la transcripción genética y produciendo así la cadena de ARN mensajero.
- El ARN mensajero sale del núcleo al citoplasma donde se une al ribosoma.
- El ribosoma junto con el ARN mensajero, realizan el proceso de traducción.
- El resultado de la traducción es la formación de una proteína. (Goodsell, 2003) (Coromoto, 2009).
En cuanto al proceso de transcripción genética, este va a ser realizado a través de dos dominios distintos de transactivación. Uno está localizado en la región A/B del amino-terminal (AF-1) y el otro en la región E del carboxi-terminal (AF-2).
Ambos deben funcionar para que se produzca la máxima actividad transcripcional. Se ha demostrado que el promotor AF-1 es independiente de hormona, mientras que el promotor AF-2 es dependiente de hormona.
La diferencia entre ellos es que, mientras que AF-2 presenta la misma productividad en ERα y ERβ, AF-1 apenas promueve la transcripción en ERβ y produce gran actividad en ERα. De esta manera, la actividad transcripcional será mayor en ERα. (Coromoto, 2009).
Papel biológico
Gracias a los mecanismos de acción de los ER, los estrógenos desempeñan funciones fisiológicas en el organismo. Cumplen un papel importante en el sistema cardiovascular, en la progresión de enfermedades renales, en el mantenimiento de la densidad ósea y en el funcionamiento del sistema nervioso.
Es de importancia a nivel reproductivo, tanto en los tejidos femeninos (tejido mamario, útero, vagina, ovario), como en los masculinos (testículos, epidídimo, próstata); en los que actúa como factor de transcripción. Esta transcripción se regula de manera específica en función del tejido en el que ocurre. (Márquez, 2010).
En la próstata, el desarrollo y el funcionamiento están influenciados por acciones estrogénicas directas por la activación de los ER, especialmente los ERβ.
Según diversos estudios, se ha podido detectar que, tanto en tejido prostático de ratón como de humano, el ERβ y ERα realizan acciones antagónicas.
El receptor de estrógenos β actuaría controlando la proliferación celular, inhibiendo el ciclo celular, mientras que el receptor de estrógenos α lo haría promoviendo la proliferación.
De esta manera, ERβ podría ser considerado como factor de protección contra el cáncer y, ERα como un oncogen que se sobreexpresa en células carcinomatosas.
Se ha asociado que, en las células tumorales, un aumento de ERα va acompañado de una disminución de ERβ, por lo que la mala regulación de la proliferación celular por fallo de los receptores da lugar a enfermedades en esta glándula, como la hiperplasia benigna prostática y cáncer de próstata. (Espinoza, 2013) (García-Figueredo, 2015).
Implicaciones biomédicas
Los receptores de estrógenos se utilizan en el campo de la medicina para la detección de diversas enfermedades, generalmente neoplásicas, así como para el tratamiento de algunas de ellas.
En cuanto a la detección de enfermedades, los receptores de estrógenos se utilizan en forma de marcadores tumorales para la detección, principalmente, del cáncer de mama.
Un marcador tumoral (MT) es toda aquella sustancia producida por las células tumorales o por el organismo en respuesta al tumor. Puede ser detectada en el suero o en otros líquidos biológicos. Estos reflejan la actividad tumoral y permiten conocer la presencia, evolución o respuesta terapéutica de un tumor maligno, por lo que se utilizan como indicadores de la presencia de una neoplasia. (Hermida, 2016).
La detección de estos marcadores tumorales se puede realizar mediante una de las técnicas de laboratorio más importantes actualmente: la inmunohistoquímica.
La inmunohistoquímica es un método bioquímico que determina la presencia y el nivel de determinadas proteínas celulares. Esto se hace por medio de anticuerpos, que se adhieren con gran especificidad y alta afinidad a las proteínas de interés. La unión del anticuerpo con los componentes celulares del tumor se marca, por ejemplo, con enzimas, que hacen posible la detección de estas moléculas en el tejido, pudiendo ser observadas con el microscopio óptico. (CancerQuest, s.f.) (Megías, 2019).
En el caso del cáncer de mama, los resultados de la marcación tumoral con receptores de estrógenos se basan en el número y en la intensidad de los núcleos teñidos. Esto se mide mediante el sistema de Allred. Este funciona mediante la asignación de una puntuación, determinada de la siguiente manera:
A) Número de células teñidas:
- 0 → sin células teñidas.
- 1 → células teñidas <1/100.
- 2 → 1/100 ≤ células teñidas < 1/10.
- 3 → 1/10 ≤ células teñidas < 1/3.
- 4 → 1/3 = células teñidas < 2/3.
- 5 → células teñidas >2/3.
B) Intensidad de la tinción:
- 0 → ninguna.
- 1 → débil.
- 2 → intermedia.
- 3 → fuerte.
Cuando la suma de ambos criterios (A+B):
- está entre 0 y 2, se considera que la muestra presenta un resultado negativo para receptores de estrógenos.
- está sobre 2, se considera que la muestra presenta un resultado positivo para receptores de estrógenos. (CancerQuest, s.f.).
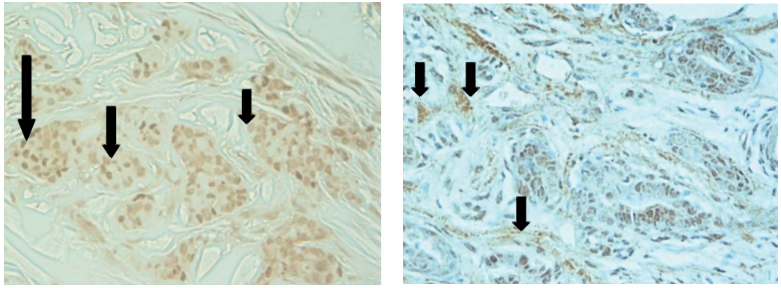
En la imagen de la izquierda, la flecha pequeña indica una intensidad de tinción nuclear débil, la flecha mediana indica una intensidad de tinción nuclear moderada y la flecha grande indica una tinción nuclear fuerte.
En la imagen de la derecha, las flechas indican que, además de la tinción nuclear, se observa tinción del estroma mamario.
(Hermo, 2010).
Como se ha comentado, los receptores de estrógeno también están implicados en el tratamiento del cáncer de mama. Este tipo de tratamiento se denomina terapia hormonal o endocrina y se recomienda en receptores de estrógenos positivos. Con este tratamiento se consigue disminuir los niveles de estrógeno o bloquear la acción de los mismos en células cancerosas. Esto se lleva a cabo a través de medicamentos como el tamoxifeno, el fulvestrant e inhibidores de la aromatasa. (American Cancer Society, 2019).
En el cáncer de próstata, la utilización de los receptores de estrógenos como marcadores tumorales no se suele utilizar, ya que hay otros marcadores mucho más eficaces.
Aún así se han realizado estudios en tejidos prostáticos de perros en los que han sido utilizados y se ha llegado a la conclusión de que la tinción inmunohistoquímica es nuclear en presencia de tumor. (Gallardo de Medrano, 2006).
Referencias
Adapted from “Estrogen Receptor Signaling”, by BioRender.com (2022). Retrieved from https://app.biorender.com/biorender-templates.
American Cancer Society. (2019). Terapia hormonal para el cáncer de seno. https://www.cancer.org/es/cancer/cancer-de-seno/tratamiento/terapia-hormonal-para-el-cancer-de-seno.html#referencias.
Arenas, L. A. S., Cáez, C., Camargo, P., Castro, Y., Moreno, A., Rodríguez, C., … & García, R. (2007). Análisis de los factores inmunohistopatológicos (receptores hormonales, estrógenos, progesterona y ERB-2) asociados al pronóstico del cáncer de mama en la población de Barranquilla (2004-2005). Salud Uninorte, 23(2), 150-161.
CancerQuest. (s.f.). Inmunohistoquímica. https://www.cancerquest.org/es/para-los-pacientes/deteccion-y-diagnostico/inmunohistoquimica.
Coromoto, Y. (2009). Receptores de estrógenos, estructura, mecanismo de acción y su relación con el desarrollo de embriones de mamíferos. Boletín Med Postg, 25, 1-10.
Espinoza, J. L., Aguilar, M. E. H., Abreu, G. E. A., Durán, F. R., Denes, J. M., Ávila, G. A. C., … & Cid, A. H. S. (2013). El papel de los estrógenos y sus receptores en la prevención y promoción de enfermedades proliferativas de la glándula prostática. Eneurobiología, 4(8).
Gallardo de Medrano, F. (2006). Estudio clínico-patológico y molecular durante la inducción, desarrollo y regresión de la hiperplasia benigna de próstata en perros Beagle. Universitat Autònoma de Barcelona,.
García-Figueredo, I., Candia, M. N., Pereda-Meira, C. M., & Laborí-Carda, C. M. (2015). Papel de los estrógenos y sus receptores en las enfermedades benignas y malignas prostáticas: Parte 1. Revista Mexicana de Urología, 75(5), 283-291.
Goodsell, D. (2003). Estrogen Receptor. RCSB Protein Data Bank. https://doi.org/10.2210/rcsb_pdb/mom_2003_9.
Hermida Lazcano, I., Sánchez Tejero, E., Nerín Sánchez, C., Cordero Bernabé, R., Mora Escudero, I., & Pinar Sánchez, J. (2016). Marcadores tumorales. Revista Clínica de Medicina de Familia, 9(1), 31-42.
Hermo, G., Soldati, R., Wargon, V., Scursoni, A., Lanari, C., & Gobello, C. (2010). Inmunohistoquímica y expresión de receptores de estrógenos y progesterona en neoplasias mamarias malignas caninas en distintos estadios clínicos. Revista Científica, XX(3), 245-253.
Malgor-Valsecia (s.f.). Sección IV: Capítulo 26: Farmacología de las hormonas sexuales femeninas. Estrógenos. Antiestrógenos. Progesterona. Progestágenos. Antiprogestágenos anticonceptivos hormonales https://med.unne.edu.ar/sitio/multimedia/imagenes/ckfinder/files/files/cap26_femen.pdf
Márquez, D. C. (2010). Receptor de Estrógeno: Bases Moleculares Aplicadas a Medicina. Los Angeles.
Megías M, Molist P, Pombal MA. (2019). Atlas de histología vegetal y animal. Técnicas histológicas. Recuperado (2022) de: http://mmegias.webs.uvigo.es/6-tecnicas/1-introduccion.php.
Noriega-Reyes, M. Y., & McCarron, L. (2008). Correguladores del Receptor de Estrógenos y su Implicación en el Cáncer Mamario. Cancerología, 3, 29-40.
PDB-101: Educational resources supporting molecular explorations through biology and medicine. Christine Zardecki, Shuchismita Dutta, David S. Goodsell, Robert Lowe, Maria Voigt, Stephen K. Burley. (2022) Protein Science 31: 129-140 doi:10.1002/pro.4200.
Serrano Alandí, P. (2022). Expresión diferencial de receptores de estrógenos en diferentes tejidos de un modelo murino de menopausia experimental (Doctoral dissertation, Universitat Politècnica de València).
Tanenbaum, DM, Wang, Y., Sigler, PB. (1998). Dominio de unión al ligando alfa del receptor de estrógeno complejado con estradiol. PDB DOI: 10.2210/pdb1A52/pdb
UCSF ChimeraX: Structure visualization for researchers, educators, and developers. Pettersen EF, Goddard TD, Huang CC, Meng EC, Couch GS, Croll TI, Morris JH, Ferrin TE. Protein Sci. 2021 Jan;30(1):70-82.