¿Somos todos iguales frente al COVID? Los anticuerpos rebeldes que te mandan a la UCI
Por Irene Torres Pulido y MªIsabel López Rodrigo – Universidad de Alcalá de Henares
Todos conocemos ya a los protagonistas de esta historia: los anticuerpos, una de las principales líneas de defensa de nuestro organismo frente a los invasores del exterior. Pero ¿es esto siempre así?
Recientemente se ha probado que estos, uno de nuestros mayores aliados, podrían actuar en nuestra contra en el caso del COVID y ser responsables de muchas de las complicaciones que hacen que la enfermedad se desarrolle de forma más grave.
Tras los dos últimos años, todo el mundo conoce ya el COVID y hemos sido bombardeados con datos sobre qué perfiles son más vulnerables frente al virus: Personas de avanzada edad, determinados grupos sanguíneos, hombres… La lista continúa. Pero ¿a qué se deben estas diferencias?
Pues, al parecer, es posible que muchas de estas diferencias que llevan al desarrollo de un COVID de mayor gravedad se deban a la presencia de unos autoanticuerpos presentes sólo en parte la población y que no se lo ponen fácil a nuestro sistema inmune para combatir la infección.
Mientras que los anticuerpos luchan contra infecciones: los autoanticuerpos, se dirigen por error a las células, tejidos y órganos del propio organismo. En el caso del COVID, los autoanticuerpos que nos interesan van a atacar al interferón tipo I (IFN-I).
1. Interferón
Para saber cómo funcionan estos autoanticuerpos y por qué agravan la enfermedad es fundamental conocer la función del interferón.
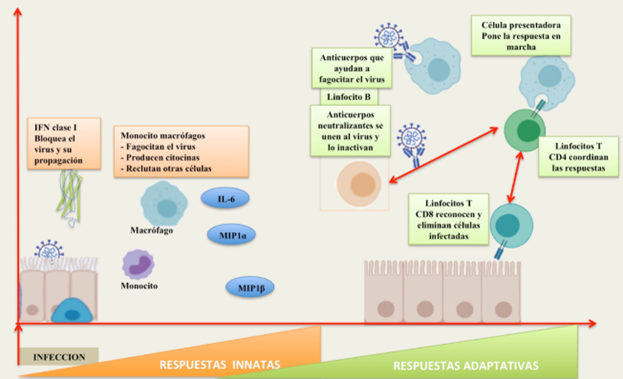
En el caso de la COVID, para contener el virus cuando este entra en nuestro organismo, nuestro cuerpo lanza un primer “ataque” que es inespecífico y sirve para retrasar su propagación mientras se activan otros mecanismos de defensa más específicos. En este ataque inicial es donde se libera el interferón (IFN), que es una sustancia producida por determinadas células como glóbulos blancos o células infectadas y que ayuda a combatir infecciones y enfermedades.
Pertenecen a la familia de las citoquinas, que son moléculas que se usan para la comunicación entre células y reciben su nombre porque interfieren con la replicación de virus, aunque esta no es su única función. También juegan un papel esencial a la hora de desencadenar distintos mecanismos de defensa para combatir todo tipo de patógenos, incluyendo bacterias, parásitos o tumores.
Generalmente, los interferones I y III poseen propiedades más enfocadas a combatir el virus mientras el interferón II se relaciona más con la activación de respuestas específicas.
Si te apetece profundizar…
Al entrar en nuestro cuerpo, las partículas virales son reconocidas por receptores de nuestro sistema inmune que se localizan en el citosol o las membranas de células como monocitos y fibroblastos. Estos reconocen las moléculas víricas como extrañas e inician la respuesta inmune, en la que una de las primeras sustancias de defensa en ser liberadas es el interferón tipo I, un tipo de citoquinas producidas por las células del sistema inmune innato como antivirales.
Este interferón se une a células específicas y, mediante la vía JAK-STAT, activa la expresión de ISGs, un conjunto de genes que al ser activados por IFN producen moléculas antivíricas y factores de transcripción entre cuyas funciones se encuentran:
- Evitar la entrada del virus a células que aún no han sido infectadas.
- Interferir con el ciclo vírico: a nivel de la replicación o liberación del virus
- Aumentar la sensibilidad del resto de células al interferón aumentando la síntesis de sus receptores.
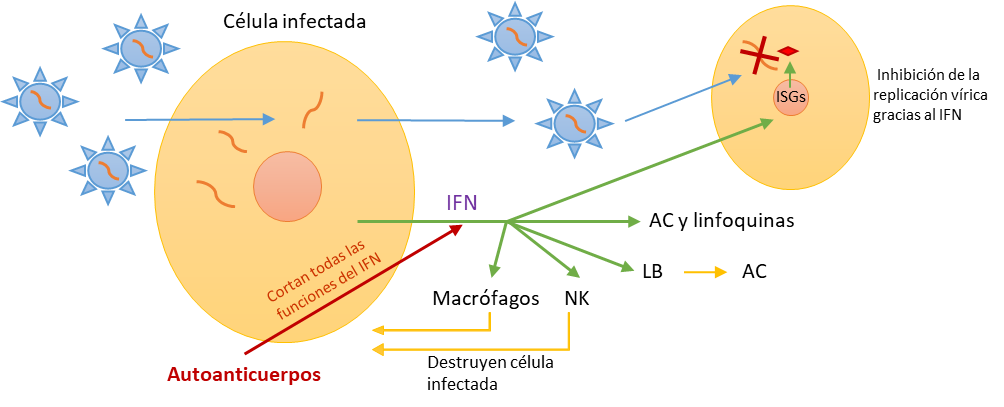
funciones que lleva a cabo el IFN.¿Pero cómo se relaciona el interferón con el COVID y los autoanticuerpos?:
En el caso de pacientes con cuadros de COVID más graves se ha visto que suele haber una deficiencia en los niveles de interferón. Esto tiene sentido, puesto que sin un mecanismo de defensa en los primeros estadios de la infección es más fácil que se agrave la situación, ya que nuestro sistema inmune no está rindiendo al 100%. Pero esto nos lleva a la siguiente cuestión, que sería:¿Qué causa la deficiencia de IFN?
Los científicos han encontrado tres principales motivos que llevan a la disminución de los niveles de esta molécula:
- La presencia de autoanticuerpos que neutralizan el interferón (especialmente en contra de IFN-a2 e IFN-w, que son dos tipos de IFN tipo I).
- Defectos genéticos en la producción del interferón.
- La inhibición de la producción de interferón causada por el propio SARS-Cov-2.
- En este artículo profundizaremos en la primera de estas razones.
2. Autoanticuerpos:
Una de las primeras dudas que nos pueden asaltar sobre los autoanticuerpos es: ¿Qué hacen ahí? ¿Por qué fabrica nuestro cuerpo armas contra sí mismo y sabotea sus propias defensas?
En condiciones normales, si nuestro organismo detecta una partícula extraña a él desencadena una respuesta inmunológica para combatirlo. Esto es lo que ocurre frente a virus, bacterias o durante un proceso alérgico. Pero el problema viene cuando, por error, nuestro cuerpo detecta como ajenas células o moléculas propias y, de igual forma que si se tratase de una infección, comienza a sintetizar anticuerpos que atacan al propio organismo. A estos los denominamos autoanticuerpos.
Existen “autoanticuerpos naturales” en todos nosotros y, aunque pueda parecer contradictorio, esto puede ser una ventaja, ya que tienen baja afinidad y no serán muy reactivos frente a nuestros tejidos, pero colaboran en la eliminación de proteínas y lípidos oxidados o células muertas.
El problema es que estos autoanticuerpos pueden iniciar respuestas autoinmunes frente a moléculas propias como el interferón y servir de “plantilla” para la fabricación de autoanticuerpos que sí tengan mucha afinidad y puedan desencadenar patologías.
Frente al interferón I:
Tras comprobar que existía una deficiencia en los niveles de IFN I en pacientes que sufrían cuadros de COVID más grave se comenzó a estudiar si existía un defecto genético en estas personas que fuese el responsable de dicha deficiencia. Fue estudiando esto que se dieron cuenta de que no solo existía este defecto genético en algunos pacientes, sino que en el 10% de los 987 sujetos con los que hicieron el estudio existían anticuerpos neutralizantes frente IFN-I que atacaban más concretamente a IFN-α IFN-ω
Frente a otras moléculas del sistema inmune:
Recientemente, la revista Nature publicó los resultados de un estudio que demostraba que no sólo existen autoanticuerpos frente al interferón I, sino que también podríamos encontrar en menor proporción autoanticuerpos que atacasen a moléculas como quimioquinas, el interferón tipo III u otras citoquinas. En lo que se traduce esto es en la inhibición de una variedad de funciones inmunológicas que van a debilitar nuestro sistema inmune y ponérselo más fácil al virus para atacar a nuestro organismo.
3. Desigualdades en cifras
La actual pandemia de COVID-19 ha alcanzado ya a 293 millones de personas, habiendo perdido la vida 5,5 millones de ellas. Estas escandalosas cifras aumentan día tras día, por lo que resulta de vital importancia (además de centrarse en la búsqueda de vacunas, tratamientos y medidas de prevención efectivas,¡) invertir en la investigación de cuál es el mecanismo patogénico que sigue el virus y de nuevos factores de riesgo, aún no descubiertos, que permitan ubicar a aquellas personas con riesgo de desarrollar una patología grave.
En esta entrada queremos obviar lo que ya conocemos todos, como las posibles complicaciones asociadas a la obesidad o el tabaquismo (factores de riesgo comunes a prácticamente todas las enfermedades) e introducir los nuevos términos que hemos explicado antes como “interferón de tipo I” y “autoanticuerpos” para explicar por qué el COVID ataca más a una parte de la población. Son numerosos los estudios recientemente desarrollados o que actualmente se están llevando a cabo que tienen como base estos dos conceptos.
Uno de los quizás más llamativos, que incita a seguir investigando, es el siguiente, publicado en la revista Science, en el que se buscó la presencia de autoanticuerpos frente al interferón de tipo I en pacientes graves, asintomáticos y controles sanos. Los datos obtenidos fueron:
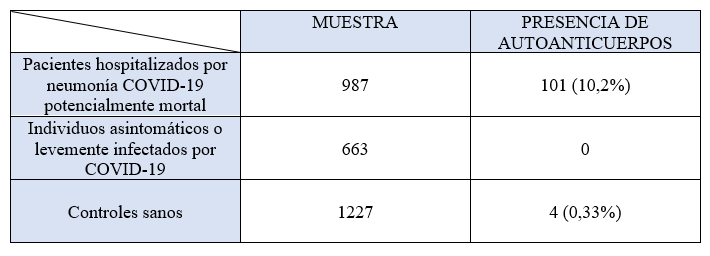
Como se puede observar las cifras son sumamente significativas, y permiten al menos, solidificar un poco la relación entre la gravedad de la patología y la presencia de autoanticuerpos.
Quizás, que los autoanticuerpos se encuentren en un 10,2% de los pacientes graves, no parece un número demasiado llamativo. Pero al extrapolar estos datos a los mundiales y considerando “casos graves” a aquellos que fallecieron (cifra que es mucho superior, ya que muchos de los casos graves sobrevivieron) encontraríamos más de medio millón de personas portadores de los mismos.
Si seguimos analizando el estudio expuesto, cabe destacar además que, de los 101 sujetos, el 94% de ellos eran varones y el 49,5% de ellos eran mayores de 65 años; estadísticas que se cumplen en estudios similares. Durante la pandemia han sido numerosos los titulares que afirmaban que los ancianos y los hombres son los “peores parados” en cuanto a los síntomas de esta patología. Son numerosas las hipótesis propuestas que justifican este hecho, pero… ¿podrían tener algo que ver los autoanticuerpos o anomalías relacionadas con el interferón de tipo I?
¿Por qué el COVID es especialmente letal en los hombres?
Como se puede observar en la figura 4, la tasa de mortalidad es superior en hombres que en mujeres en todos los rangos de edad. En esta entrada vamos a explicar una teoría que explicaría a qué se debe esto, aunque es importante mencionar que existen otras hipótesis.
Como hemos visto, ante el ataque del virus, nuestro cuerpo libera interferón, por lo que una deficiencia en esta molécula podría generar una enfermedad de peor pronóstico.
Teniendo en cuenta los tres factores que contribuyen al decrimento del interferón tipo I que hemos mencionado antes (punto 1 del artículo), el hecho de que los hombres padezcan esta enfermedad de forma más grave debe estar relacionado con, al menos, una de ellas.
En este caso, la inhibición que produce el COVID sobre la producción de interferón no va a depender del sexo; por lo que eso nos deja los autoanticuerpos y los factores genéticos como únicas alternativas para explicar este suceso.
Se ha demostrado que, en comparación con las mujeres, son muchos más los hombres que presentan autoanticuerpos que actúan inhibiendo al interferón de tipo I. Pero además, también entra en juego un factor genético, que no va a contribuir a que los hombres estén en igualdad de condiciones en la lucha frente a la COVID, y este es el gen TLR7.
Este gen se halla en el cromosoma X, del que las mujeres presentan 2 copias, pero los hombres sólo una, por lo que posibles alteraciones en la secuencia de DNA de dicho gen afectarán más a los hombres.
El gen TLR7 codifica para un receptor que recibe el mismo nombre (TLR7), y que se encuentra en las células dendríticas plasmacitoides. Estas células intervienen en la respuesta antiviral liberando interferón tipo I; y es precisamente gracias al receptor TLR7 que pueden detectar el ARN vírico e iniciar la respuesta inmune.
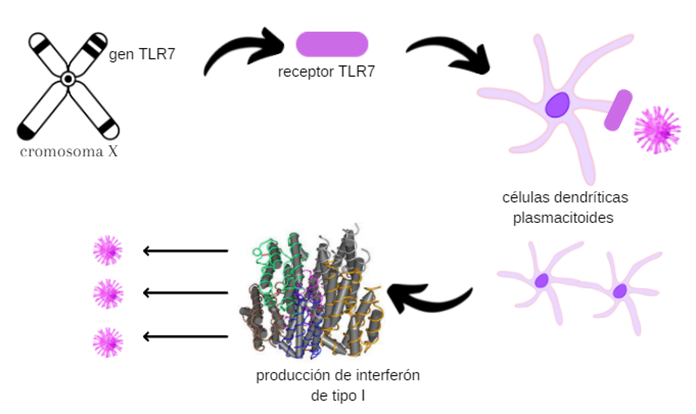
Si te apetece profundizar…
Una vez detectado el ARN viral por medio del receptor tipo toll 7 TLR7, las células dendríticas plasmacitoides (pDC) forman grupos pDC-pDC autoadhesivos que producen los interferones de tipo I. Es por ello que, mutaciones en la vía de señalización de esta citocina también están vinculadas a los casos más graves de COVID-19.
Este hecho también esta teniendo mucho impacto en el mundo de la investigación. Recientemente se ha realizado un estudio consistente en la búsqueda de variantes genéticas raras en una muestra de 1202 hombres, para estudiar la presencia de una deficiencia funcional en TLR7. Los resultados muestran que dichas variantes se encontraron en el 1,8% de pacientes menores de 60 años con patología grave, pero no fueron identificados en ninguna de las 331 personas asintomáticas o que presentaban síntomas muy leves.
¿Por qué el COVID es especialmente letal en ancianos?
En el caso de los ancianos, en un estudio publicado por Science Inmunology, se determinó que el 20% de pacientes de más de 80 años con patología grave presentaban autoanticuerpos bloqueantes del interferón I, lo que provoca por lo tanto, que el sistema inmune de estos enfermos (sumado al resto de factores de riesgo asociados con la edad) tenga menos capacidad de defensa frente a la infección.
Y ahora… ¿qué?
- Como se ha descubierto, la integridad de la respuesta del interferón de tipo I para hacer frente al COVID-19 es de vital importancia, por lo que resultaría bastante prometedor el desarrollo de posibles tratamientos con interferón específico contra la enfermedad o bien terapias dirigidas a la eliminación de estos autoanticuerpos.
- Podría ser además de gran utilidad la identificación de pacientes con mayor probabilidad de desarrollar patología grave mediante la realización de cribados pre-sintomáticos de muestras de sangre en busca de estos anticuerpos neutralizantes del interferón de tipo I.
- En el posible tratamiento basado en la transfusión de plasma de pacientes convalecientes para lograr mejoras en casos de mayor gravedad, sería importante analizar que el sujeto no sea portador de autoanticuerpos ya que estos neutralizarían esa respuesta inmunitaria inicial frente al virus.
- Estos hallazgos han tenido tanta repercusión que a pesar de que continúa en estudio, hace un año en Reino Unido se inició un ensayo a gran escala de un tratamiento consistente en la inhalación de interferón beta para su introducción directa en las vías respiratorias; el resultado esperado consistía en lograr una respuesta antiviral más fuerte, incluso en aquellos pacientes que se encontraban debilitados.
BIBLIOGRAFÍA
- Autoantibodies against type I IFNs in patients with life-threatening COVID-19. (2020, 24 septiembre). Science. https://www.science.org/doi/10.1126/science.abd4585
- Wang, E. Y. (2021, 19 mayo). Diverse functional autoantibodies in patients with COVID-19. Nature. https://www.nature.com/articles/s41586-021-03631-y?error=cookies_not_supported&code=b6092a1b-e2ed-4094-91c4-ae5871deb2c1
- Zhou, W. (2021, 26 febrero). Auto-antibodies against type I IFNs are associated with severe COVID-19 pneumonia. Nature. https://www.nature.com/articles/s41392-021-00514-6?utm_source=TrendMD&utm_medium=cpc&utm_campaign=Signal_Transduction_and_Targeted_Therapy_TrendMD_1&error=cookies_not_supported&code=e0a9c9f7-cdc3-4efe-86e7-e6b29f9795ab
- Bastard, P., Gervais, A., & le Voyeur, T. (2021, 20 junio). Autoantibodies neutralizing type I IFNs are present in ~4% of uninfected individuals over 70 years old and account for ~20% of COVID-19 deaths. Science Immunology, 6. https://www.science.org/doi/full/10.1126/sciimmunol.abl4340
- del Fresno, C. (2020, 2 octubre). Papel del interferón en la COVID-19 grave. Empíreo Diagnóstico Molecular – Diagnóstico de VIH y ETS. https://www.empireo.es/papel-del-interferon-en-la-covid-19-grave
- Sinha Dutta, S., & Henderson, E. (2021, 9 marzo). What are Autoantibodies? News Medical Life Sciences. https://www.news-medical.net/life-sciences/What-are-Autoantibodies.aspx
- Beck, D., & Aksentijevich, I. (2022). Autoantibodies against type I IFNs in patients with life-threatening COVID-19. Retrieved 6 January 2022, from https://www.science.org/doi/10.1126/science.abd4585
- Simona Pascolini, Antonio Vannini, Gaia Deleonardi, Michele Ciordinik, (2020). COVID-19 and Immunological Dysregulation: Can Autoantibodies be Useful?, from http://pubmed.ncbi.nlm.nih.gov/32989903.
- Describen dos nuevas variantes del gen TLR7 que se asocian a formas graves de la COVID-19 en hombres jóvenes y sanos – idibell. (2022). Retrieved 6 January 2022, from https://idibell.cat/es/2021/07/describen-dos-nuevas-variantes-del-gen-tlr7-que-se-asocian-a-formas-graves-de-la-covid-19-en-hombres-jovenes-y-sanos/
BIBLIOGRAFÍA DE LAS IMÁGENES:
- Figura 1: Así reacciona el sistema inmunitario frente al nuevo coronavirus. (2020, 8 mayo). Instituto Salud Carlos III. https://www.isciii.es/InformacionCiudadanos/DivulgacionCulturaCientifica/DivulgacionISCIII/Paginas/Divulgacion/InformeCoronavirusInmunidad.aspx
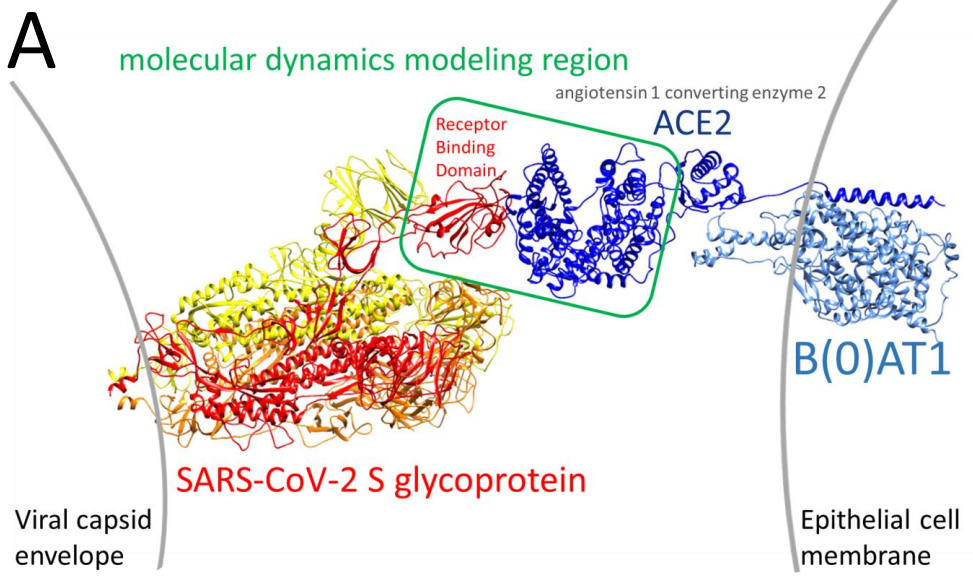
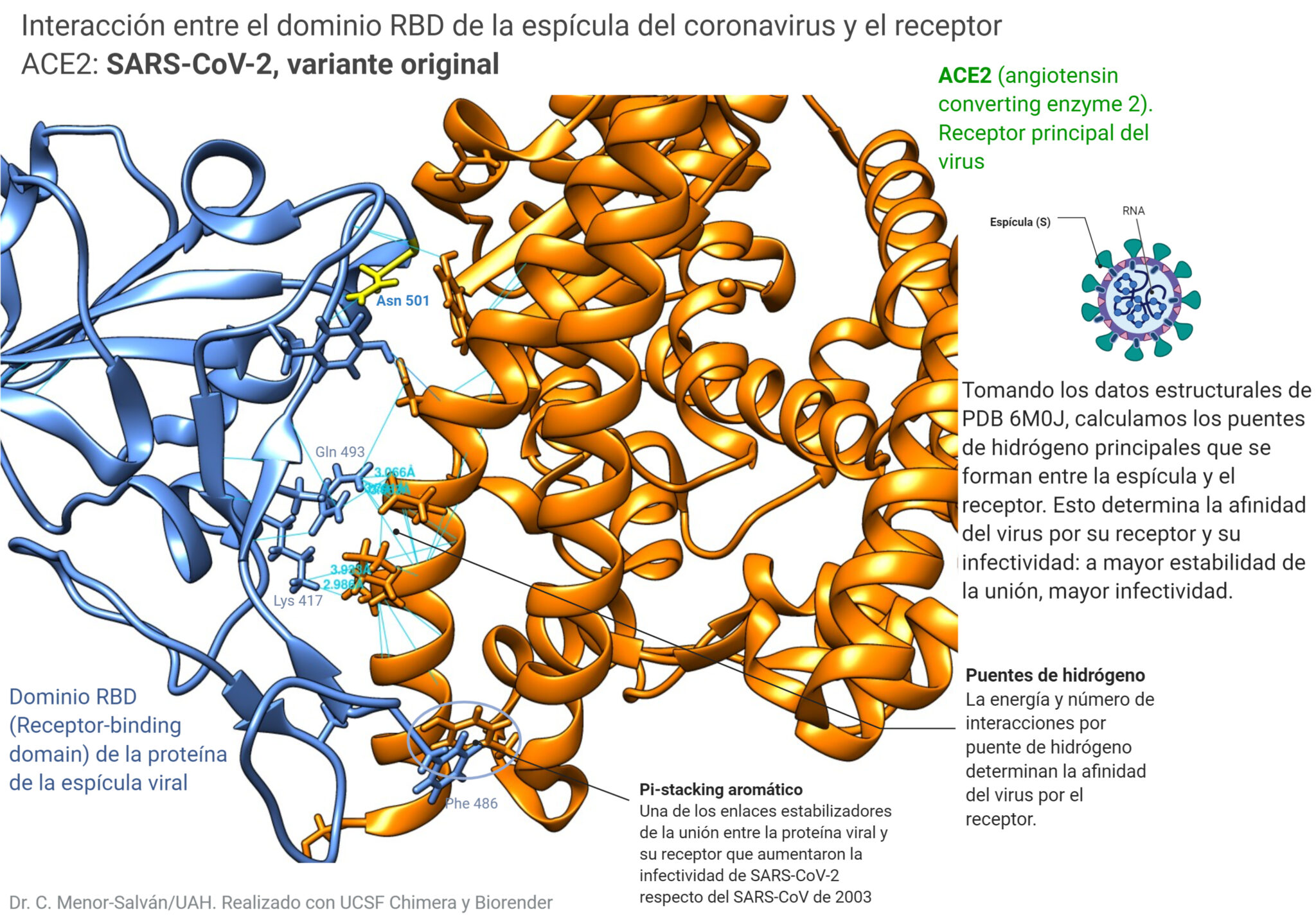
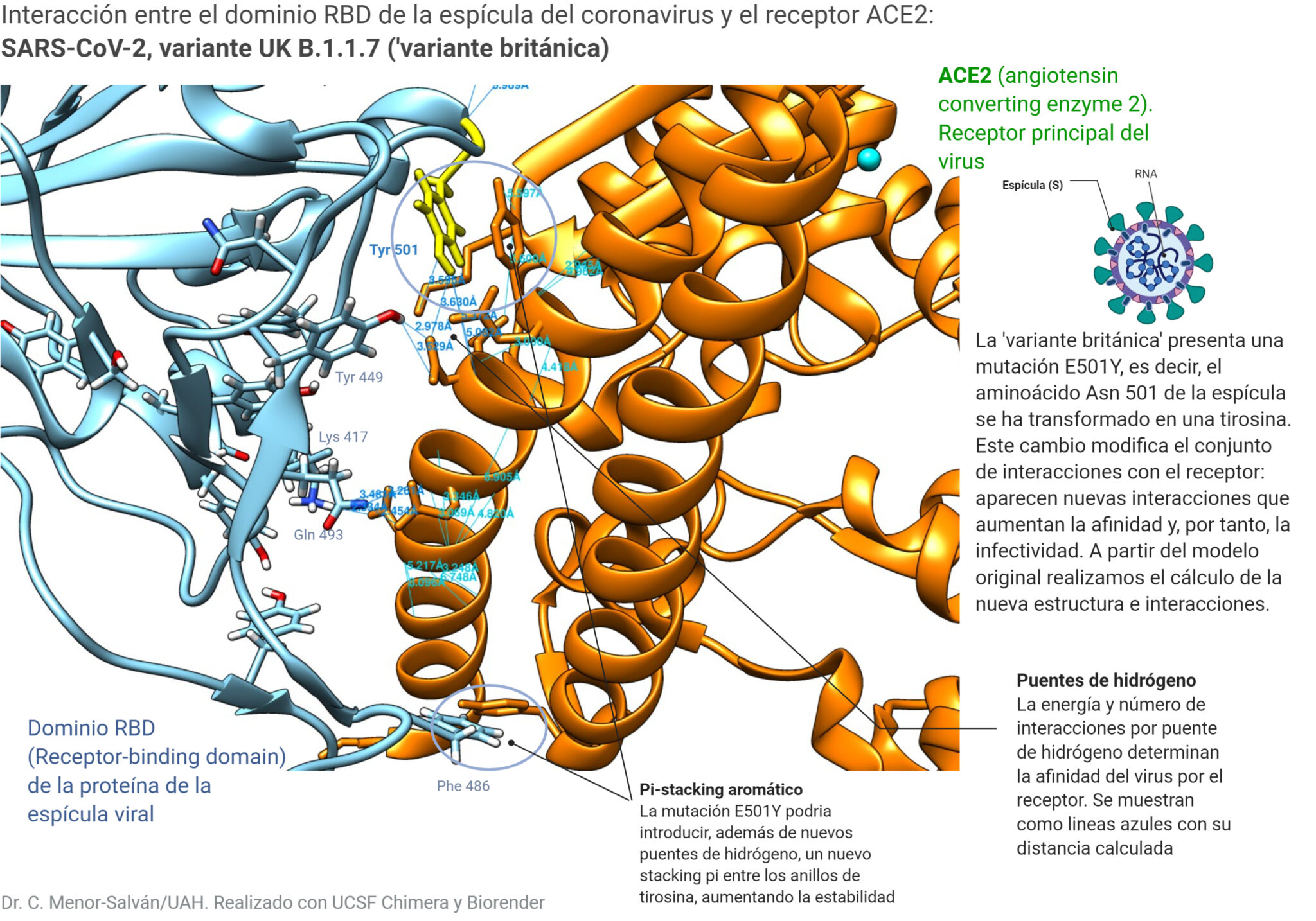
- Figuras 2, 3 y 5: Creadas por los autores
- Figura 4: Ana Blanco, Nature, Diferencia entre mortalidad por Covid de hombres y mujeres. https://www.elespanol.com/ciencia/salud/20200904/impactante-grafico-demuestra-covid-mata-hombres-mujeres/517949556_0.html