¿Se puede obtener fármacos contra el cáncer a partir de sustancias presentes en animales marinos?
Laura Saelices y Hortensia Rivera. Grado en Biología Sanitaria, Universidad de Alcalá.
Introducción:
A lo largo de la evolución, muchos organismos marinos han desarrollado numerosos productos químicos con diversos fines, como por ejemplo defensivos, protectores o de comunicación entre ellos. Es por esto que las formas de vida marinas van a ser una fuente de compuestos que podrán ser usados de forma terapéutica, por ejemplo, en el tratamiento de diversos cánceres. Para la investigación de estos fármacos va a ser fundamental la ampliación del conocimiento y conservación de la gran diversidad marina albergada en nuestro planeta.
¿Qué es el cáncer?
El cáncer es una patología biológica y genética de las células que componen los tejidos de nuestros órganos. Este conjunto de enfermedades se producen cuando los estrictos mecanismos de control que posee la célula para realizar diversos procesos como la replicación fallan, dando lugar a un acúmulo de mutaciones en genes encargados de controlar el crecimiento, la proliferación, la división o la muerte celular. (1)
Los genes que van a ser alterados van a ser de tres tipos:
- Oncogenes: su mutación produce un aumento descontrolado del crecimiento celular
- Genes supresores de tumores: cuya mutación da lugar a división incontrolada
- Genes de reparación de DNA: su mutación provocará acumulación de aberraciones en la estructura del DNA
Los tumores, tanto benignos como malignos, se clasifican dependiendo del tipo de célula que procedan, siendo los mayoritarios los carcinomas de las células epiteliales, los sarcomas de células del músculo, hueso, cartílago y tejido fibroso, y por último las leucemias y linfomas de células hematopoyéticas y del sistema inmune.
Debido a la difusión de los tumores malignos que los hace más resistentes al tratamiento local, las formas de tratarlos van a ser la cirugía, la radioterapia y la quimioterapia, siendo estos tres no excluyentes y frecuentemente usados de forma simultánea o secuencial.
En nuestro caso nos vamos a centrar en la quimioterapia, que es el uso de fármacos para destruir las células cancerosas, concretamente en el uso de sustancias producidas por organismos marinos con este fin.
Mecanismos de acción de los antitumorales de origen marino:
La gran variedad de compuestos químicos encontrados en la fauna marina poseen una amplia heterogeneidad de acción, actuando a muy diferentes niveles. Los principales mecanismos de acción antineoplásicos de estos bioactivos descubiertos son los siguientes:
- Inhibición del proceso de angiogénesis
- Inducción del proceso de muerte celular programada o apoptosis
- Inhibición de proteínas específicamente destinadas a regular el ciclo celular.
- Inactivación de topoisomerasas
- Inhibición de la formación de microtúbulos
(1)
A continuación, veremos más detenidamente alguno de estos mecanismos de actuación centrándonos en tres de estos compuestos antitumorales.
Citarabina:
La citarabina es un análogo de nucleósido de pirimidina sintético, denominado arabinósido de citosina o Ara-C, desarrollado a partir de la espongotimidina, que fue aislada en la demosponja Tectitethya crypta. Este antimetabolito se usa en el tratamiento de leucemia; en concreto se usa en su forma convencional para el tratamiento de leucemia linfocítica aguda, leucemia mieloide aguda y las fases de crisis blástica de la leucemia mieloide crónica y la leucemia meníngea, y en su forma liposomal en el tratamiento de meningitis linfomatosa. (2)
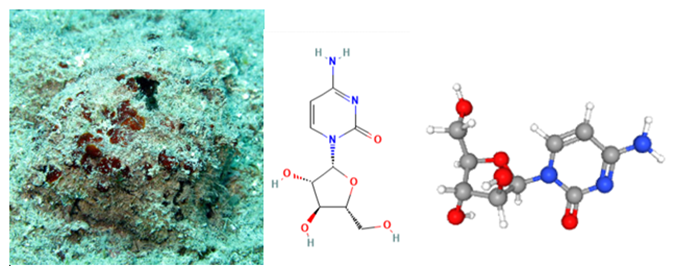
Este agente citotóxico afecta especialmente a las células que se encuentran en fase S del ciclo celular. La citarabina es, por tanto, un antimetabolito análogo de la citidina (nucleósido de citosina con anillo de ribosa), el cual tiene beta-D-arabinosa en lugar de ribosa. Este es convertido en la célula en citarabina trifosfato, que será el metabolito activo, y entonces competirá con la citidina en su incorporación al ADN. La replicación quedará parada debido a que la arabinosa induce una rotación en el ADN, lo que hará que pare el ciclo celular. Además, este compuesto también inhibe la ADN polimerasa alfa y beta, haciendo que descienda la tasa de replicación y de replicación del ADN. (3)
Además, este compuesto ha demostrado tener cierta capacidad antiviral e inmunosupresora, pero esto ha sido sólo demostrado en experimentos in vitro.
Yondelis
Este es el nombre comercial que ha recibido el antitumoral cuyo principio activo es ecteinascidina-743, un alcaloide de tetrahidroisoquinolina marina aislado de Ecteinascidia turbinata.

El mecanismo de acción de este compuesto es bastante novedoso, puesto que se une al surco menor del DNA formando aductos covalentes en la posición N2 de la guanina; esta unión al surco menor permite que el fármaco interactúe con proteínas específicas de las células cancerosas, impidiendo la copia celular y provocando roturas de doble cadena en el ADN (1,4)
Se cree que el fármaco afecta a varios factores de transcripción implicados en la proliferación celular, en particular a través del sistema de reparación por escisión de nucleótidos acoplados a la transcripción. De este modo interfiere con la división celular, los procesos de transcripción genética y la maquinaria de reparación del ADN.
En concentraciones relativamente altas también puede provocar la desorganización del ensamblaje de microtúbulos y la red de microfilamentos intermedios; provocando primero una pérdida de la organización de los microtúbulos en la porción distal, que continúa con la aparición de microtúbulos colapsados alrededor del núcleo celular.
Así mismo, se ha observado que inhibe la sobreexpresión del gen de resistencia a múltiples fármacos (MDR-1) que es un factor importante responsables de que las células desarrollen resistencia a los fármacos contra el cáncer (4).
En condiciones de laboratorio y concentraciones nanomolares, ET-743 presenta actividad frente a una variedad de líneas celulares de tumores sólidos, incluido el melanoma, tumores de pulmón, ovario y colón; siendo las células en la fase G1 del ciclo celular y las células del sarcoma de tejidos blandos, especialmente sensibles a la muerte inducida por este compuesto. (1)
Actualmente, Yondelis está autorizado para comercializarse como tratamiento para el sarcoma de tejidos blandos avanzado o metastásico y para el tratamiento del cáncer de ovario recurrente platino-sensible en combinación con otro fármaco (DOXIL/Caelyx). También se están llevando a cabo ensayos en fase II para cáncer de mama, cáncer de próstata y para tumores pediátricos. (1)
Zalypsis:
Zalypsis (PM00104) es un alcaloide sintético relacionado con el compuesto natural marino Jorumycina, del molusco Jorunna funebris, y con la familia de las Renieramycinas, de las esponjas Neopetrosia. El mecanismo de acción de este citotóxico es multifactorial e implica tanto el bloqueo del ciclo celular como la estimulación de diferentes cascadas apoptóticas. (5)

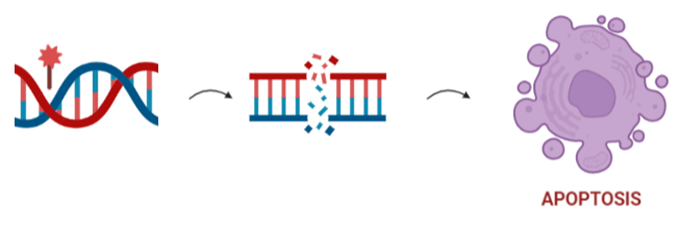
Este compuesto utiliza su grupo carbinolamina para unirse al surco menor del ADN mediante unión covalente a restos de guanina en tripletes. Esta interacción da lugar a un aducto que inhibe las fases más tempranas de la transcripción y puede dar lugar a double-stranded breaks. Debido a esto va a detener las células en la fase S. (5,6)
Además, como ya hemos comentado, Zalypsis también va a estar relacionado con algunas rutas apoptóticas, lo cual está probablemente relacionado con los daños en el ADN que provoca. Así, está relacionado con activación de cascadas dependientes de caspasas como algunas que incluyen a la enzima PARP y otras que conducen a la activación de p53. (6)
En numerosos estudios preclínicos ha demostrado una fuerte actividad contra el cáncer de mama, de próstata, gástrico y renal. Además, actualmente está en fase II en mieloma múltiple, vejiga y sarcoma de Ewing. (1)
Producción sostenible de recursos marinos
Todos estos compuestos poseen un enorme potencial económico; sin embargo aparecen en los organismos en cantidades muy escasas, lo que requiere el desarrollo de métodos de producción que aseguren el adecuado suministro y comercialización del producto sin alterar las poblaciones y ecosistemas.
Estas técnicas de producción deben ser adecuadas para cada caso, basándonos en una serie de factores como la fuente del compuesto, complejidad de la molécula, abundancia del organismo en la naturaleza, condiciones de crecimiento, etc.
Variación intraespecífica de la actividad:
Los compuestos de los que hemos estado hablando tienen una gran variabilidad tanto entre especies como dentro de un solo organismo. La biosíntesis de estos productos en los organismos en los que son producidos está muy influenciada por factores tanto externos, condiciones ambientales o presencia de depredadores, como internos, estado de desarrollo o la masa corporal. Lo que produce está variabilidad no está del todo claro pero el mayor candidato es la heterogeneidad ambiental, es decir, el contenido químico de las especies depende estrechamente de dónde y cuándo es recolectado el organismo. Por esto, es posible que se encuentren metabolitos nuevos en especies ya investigadas si las condiciones de cultivo son diferentes. (1)
Conclusiones:
Como hemos visto en los animales marinos podemos encontrar una gran cantidad de metabolitos que pueden ser de gran utilidad para la cura de enfermedades tan importantes como el cáncer. Es por esto que es importante conocer en profundidad la biodiversidad marina, además de otras razones como la conservación e investigación del potencial genético.
Como conclusión, es muy posible que, bajo el mar, muchos animales marinos tengan ya solucionados problemas que nosotros seguimos intentando resolver.
Bibliografía:
(1) Navia, A. J. L., & San Sebastián, M. M. (2015). Drogas marinas: los animales marinos como fuentes de compuestos antitumorales. AmbioCiencias: revista de divulgación, (13), 35-51.
(2) U.S. National Library of Medicine. (n.d.). Cytarabine. National Center for Biotechnology Information. PubChem Compound Database. Retrieved January 4, 2023, from https://pubchem.ncbi.nlm.nih.gov/compound/6253
(3) Betcher, D. L., & Burnham, N. (1990). Cytarabine. Journal of Pediatric Oncology Nursing, 7(4), 154-157.
(4) Trabectedin: Uses, Interactions, Mechanism of Action | DrugBank Online. (s. f.). DrugBank. https://go.drugbank.com/drugs/DB05109
(5) Petek, B. J., & Jones, R. L. (2014). PM00104 (Zalypsis®): A marine derived alkylating agent. Molecules, 19(8), 12328-12335.
(6) Ocio, E. M., Maiso, P., Chen, X., Garayoa, M., Álvarez-Fernández, S., San-Segundo, L., … & Pandiella, A. (2009). Zalypsis: a novel marine-derived compound with potent antimyeloma activity that reveals high sensitivity of malignant plasma cells to DNA double-strand breaks. Blood, The Journal of the American Society of Hematology, 113(16), 3781-3791.