¡Muerte proteica! Descubrimos una quimera destructora de proteínas: Los Protacs
Daniel Arenas González y Celia Arranz del Río.
Los PROTACs son moléculas diseñadas para unirse a proteínas diana, ubiquitinizarlas, y conducirlas al sistema de degradación proteosomal. Recientemente, se han utilizado para modular la actividad de la proteína Von Hippel-Lindau (VHL), una proteína capaz de unirse a factores de transcripción y regular la expresión génica.
PROTACs, un sistema de degradación de moléculas.
Los PROTACs (PROteolysis TArgeting Chimera) son moléculas diseñadas para desactivar proteínas específicas en el cuerpo. Es una molécula pequeña diseñada para unirse a una proteína objetivo específica y llevarla a un sistema de degradación proteica llamado sistema ubiquitina-proteasoma. Los PROTACs se componen de dos componentes: un ligando que se une a la proteína objetivo y un ubiquitina ligasa que cataliza la adición de ubiquitina a la proteína objetivo. [1], [2].
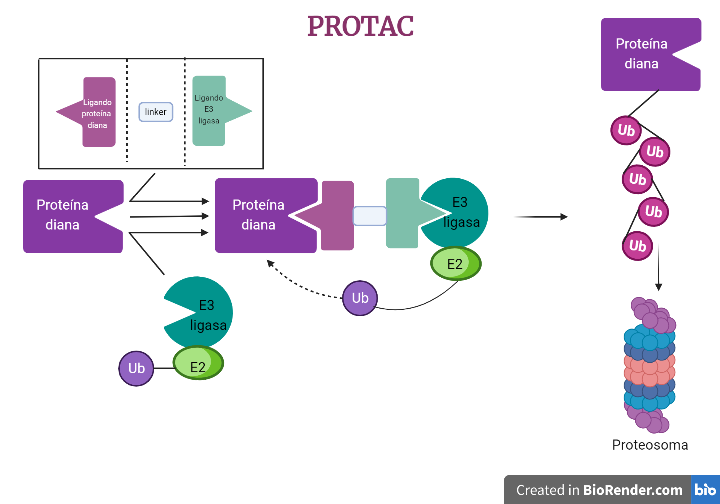
Imágenes obtenidas con BioRender. Daniel Arenas Gónzalez y Celia Arranz del Río.
Los PROTACs se pueden diseñar para unirse a proteínas específicas que se sabe que están implicadas en enfermedades concretas, y por lo tanto se están considerando como posibles tratamientos para dichas enfermedades. También se utilizan en investigación científica para entender el papel de diferentes proteínas en el cuerpo y cómo pueden ser moduladas para tratar enfermedades.[3]
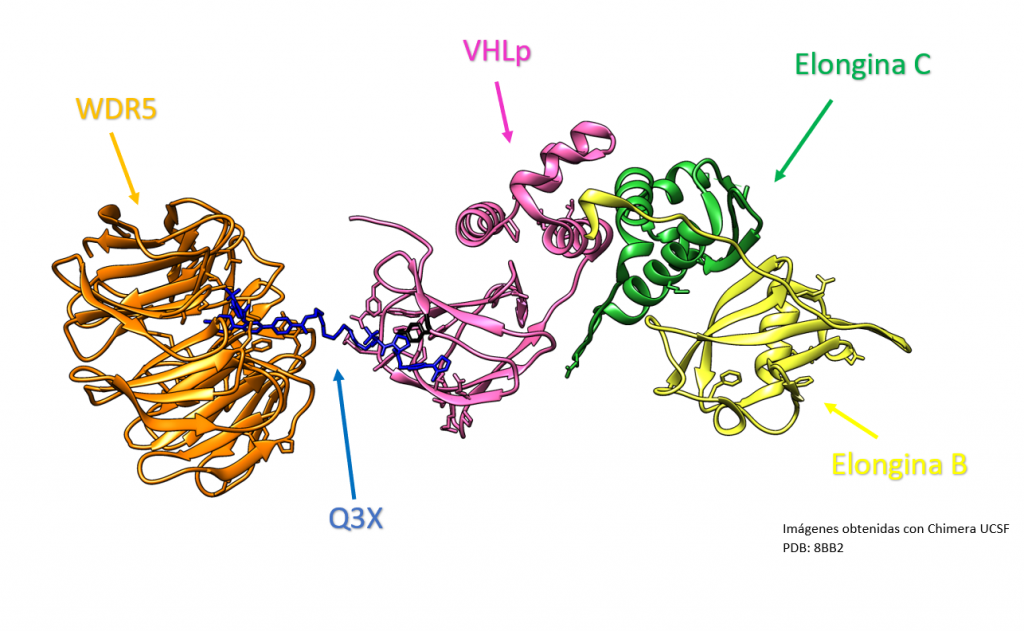
Creado con UCSF Chimera por Daniel Arenas González y Celia Arranz del Río.
Los PROTACs se han utilizado en investigación para modular la actividad de la proteína VHL, de la que hablaremos a continuación. Por ejemplo, se han desarrollado PROTACs que pueden unirse a la proteína VHL y llevarla al sistema de eliminación de proteínas del cuerpo, lo que puede tener efectos terapéuticos en el cáncer causado por pVHL. Esto se logra mediante el mecanismo de acción de los PROTACs descrito anteriormente, es decir, mediante la unión de la proteína objetivo (en este caso, la proteína VHL) a una molécula de deglución, que luego lleva a la proteína objetivo al sistema de eliminación de proteínas del cuerpo.[3],[4]
Creado con UCSF Chimera por Daniel Arenas González y Celia Arranz del Río.
Comparación entre el complejo HIF-1a-pVHL-Elongina B-Elongina C (PROTAC) y el complejo SCF.
Por un lado, WDR5 es una proteína que puede ser utilizada como componente de un PROTAC para unirse a una proteína objetivo y marcarla para su degradación por el sistema de ubiquitinación.
WDR5 tiene un dominio beta propeller. Es frecuente encontrar el dominio beta propeller en proteínas que se utilizan como componentes de PROTACs.
Por otro lado, SCF (complejo de ubiquitina ligasa E3) es un complejo proteico que se encarga de marcar las proteínas para su degradación por el sistema de ubiquitinación. El complejo SCF está compuesto por cuatro proteínas: una proteína E3 ligasa, una proteína adaptadora que se une a la proteína objetivo, una proteína F-box que se une a la proteína adaptadora y una proteína que se une a ubiquitina.[5],[6]
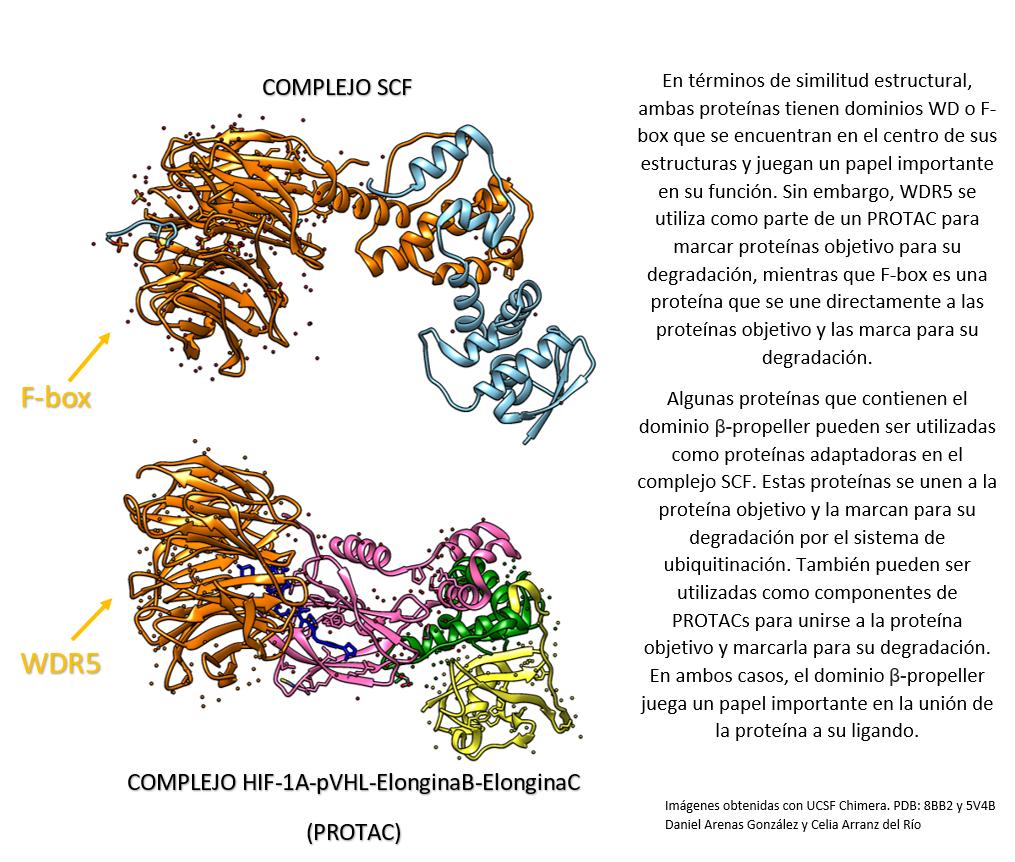
Creado con UCSF Chimera por Daniel Arenas González y Celia Arranz del Río.
La proteína Von Hippel-Lindau (VHL).
La proteína VHL (Von Hippel-Lindau) es una proteína codificada por el gen VHL y se encuentra en el núcleo de las células.
Se puede unir a factores de transcripción para regular la expresión génica y a proteínas que tienen un papel en la regulación del ciclo celular y en la reparación del ADN, como la proteína p53. Esto puede ser importante para evitar el crecimiento anormal de las células, que puede llevar a enfermedades como el cáncer. [6]
La proteína VHL es un componente del complejo proteico VCB, que también incluye elongina B, elongina C y cullin-2. Tiene actividad de ubiquitina ligasa E3 y dirige la degradación dependiente del proteasoma de sus proteínas objetivo.
- La proteína VHL interactúa con CUL2, y esta interacción depende de la integridad del complejo VBC trimérico.
- La proteína VHL interactúa con ADRB2. En condiciones normales de oxígeno esta interacción depende de la hidroxilación de ADRB2 y la subsiguiente ubiquitinación y degradación mediadas por VCB. Sin embargo, bajo hipoxia, la hidroxilación, interacción con VHL, la ubiquitinación y la posterior degradación de ADRB2 disminuyen significativamente.
- Además, VHL interactúa con RNF139, USP33 y PHF17, y se encuentra en un complejo compuesto por LIMD1, VHL, EGLN1/PHD2, TCEB2 y CUL2. [7]
Vía VHL-HIF.
La pVHL también interactúa, a través de su dominio beta, con el factor inducible por la hipoxia (HIF1A). Su interacción está regulada mediante la hidroxilación de un residuo de prolina por la enzima HIF-1alfa prolil hidroxilasa dependiente de oxígeno. [8]
HIF es una proteína de expresión constitutiva y ubicua en los tejidos. La regulación de la actividad de este factor de transcripción depende del oxígeno y ocurre a varios niveles de su fisiología molecular (hidroxilación, proteólisis, transporte nuclear, etc.).
- En normoxia (niveles de oxígeno normales). En condiciones de normoxia, las subunidades HIF-alfa se unen rápidamente a la prolilhidroxilasa, que las ubiquitiniza, haciendo posible que la enzima E3-ligasa o VHL las reconozca y activando así la proteólisis de HIF mediante la vía del proteosoma. .
- En hipoxia o anoxia (niveles de oxígeno mínimos o ausencia de oxígeno). En condiciones hipóxicas, la enzima prolil hidroxilasa no ubiquitiniza al factor HIF-1alfa, impidiendo su reconocimiento por parte de la enzima VHL (E3-ligasa) y, por tanto, su proteólisis. El factor HIF comienza a acumularse en el citoplasma y se transloca al núcleo, donde se transcribirá y originará un ARNm que puede ser traducido. [9],[10].
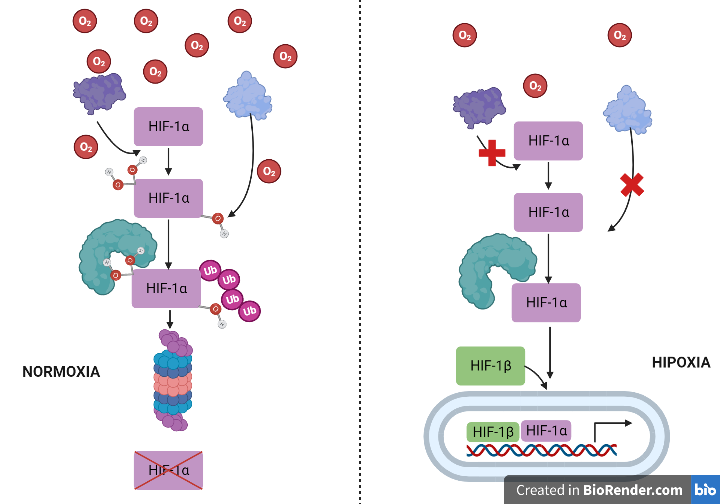
Imagen creada con Biorender. Daniel Arenas González y Celia Arranz del Río.
Mutación VHL Y98N
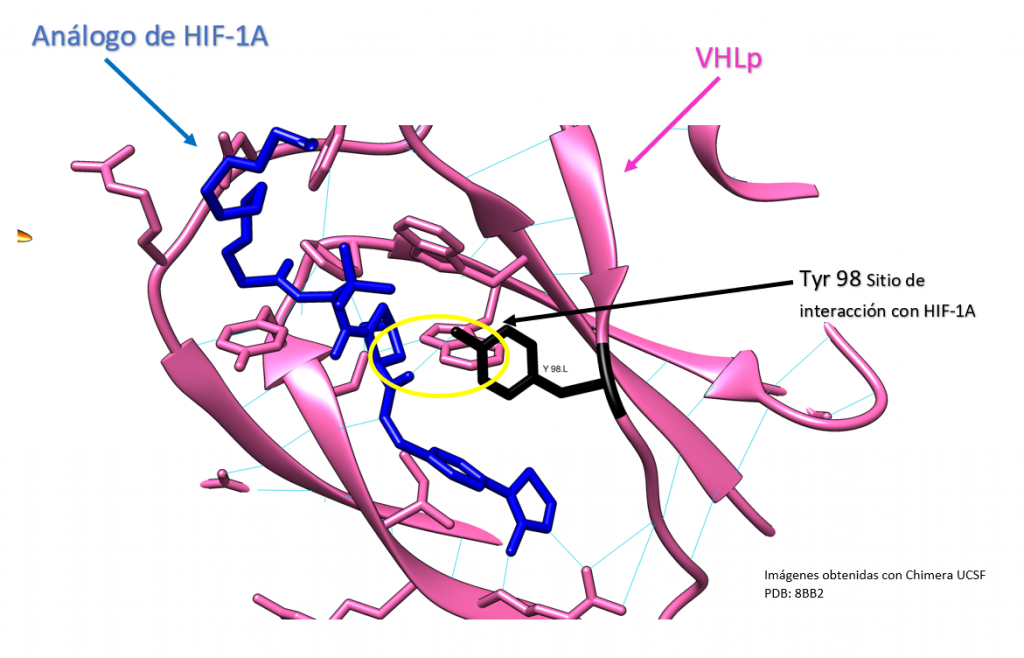
Creado con UCSF Chimera por Daniel Arenas González y Celia Arranz del Río.
La proteína VHL es una proteína clave en el ciclo celular y en la regulación de la respuesta del cuerpo a los cambios en el oxígeno. En la posición 98 de la proteína VHL hay una tirosina, que es un aminoácido importante en su estructura y función. Sin embargo, cuando hay una mutación que cambia la tirosina por asparragina en esa posición. La capacidad de la proteína VHL para unirse al factor de transcripción HIF1A puede verse afectada.
El HIF1A es una proteína que se une a ADN y regula la expresión de ciertos genes. Cuando hay una falta de oxígeno en las células, el HIF1A se activa y ayuda a las células a adaptarse al cambio. La proteína VHL normalmente ayuda a regular la actividad del HIF1A, impidiendo que se una a ADN cuando hay suficiente oxígeno. Sin embargo, si hay una mutación en la proteína VHL que impide que se una al HIF1A, el HIF1A puede seguir activo incluso cuando hay suficiente oxígeno, lo que puede llevar a cambios en la expresión génica y potencialmente a problemas de salud.
En resumen, la mutación que cambia la tirosina por asparragina en la posición 98 de la proteína VHL puede afectar la capacidad de la proteína VHL para regular la actividad del HIF1A, lo que puede tener consecuencias para la salud. [11]
La importancia de las mutaciones.
Una mutación que cambia una arginina por una asparragina en una proteína puede tener diversos efectos en la estructura y función de la proteína.
- La arginina es un aminoácido con un grupo amino positivamente cargado y un grupo carboxilo negativamente cargado, lo que le da una cierta reactividad química y le permite participar en interacciones con otros aminoácidos y moléculas.
- La asparragina, por otro lado, es un aminoácido con un grupo amino negativamente cargado y un grupo carboxilo positivamente cargado, lo que le da una carga eléctrica y una reactividad química diferentes.
En general, una mutación que cambia una arginina por una asparragina puede afectar la estructura tridimensional de la proteína y, por lo tanto, su función. Por ejemplo, la arginina puede participar en interacciones de puentes salinos y en la formación de estructuras secundarias como hélices alfa, mientras que la asparragina puede tener dificultades para hacerlo. También puede haber cambios en la afinidad de la proteína por otras moléculas o en su estabilidad estructural debido a la mutación.
En resumen, la mutación de arginina a asparragina puede afectar la estructura y función de la proteína de diversas maneras y puede tener efectos en el organismo que dependen de la proteína afectada y de su papel en el cuerpo.[12]
iASPP, el oncogen que se une a VHL y evita la degradación de HIF-1α.
iASPP es un oncogen inhibidor de la proteína simuladora de apoptosis de p53. iASPP y HIF-1α se unen a la misma región de VHL.
La unión de VHL con iASPP evita que se una con HIF-1α, lo que aumenta la estabilidad y señalización de la proteína HIF-1α en las células cancerosas. Se ven promovidas la angiogénesis, la reprogramación metabólica y la glucólisis).
Se ha comprobado que iASPP contribuye a la activación constitutiva de HIF-1α en cáncer, y, por tanto, la modulación de la expresión de iASPP o su interacción con VHL es una estrategia terapéutica potencial con la que modular las actividades de la vía HIF. [13],[14]
La enfermedad de Von Hippel-Lindau (VHL), un trastorno genético.
El gen VHL, ubicado en el cromosoma 3, codifica para la proteína de Von Hippel-Lindau. Es un gen supresor de tumores y su mutación conduce al desarrollo de cáncer.
La enfermedad de Von Hippel-Lindau fue descrita por primera vez y por separado por Von Hippel en 1911 y por Lindau en 1926. Su incidencia se estima aproximadamente en 1/36000 nacido vivos. [8],[15]
Es un trastorno genético hereditario autosómico dominante caracterizada por la aparición a una edad temprana de tumores muy vascularizados. Se pueden clasificar en lesiones del SNC (hemangioblastomas del SNC y retinianos) y en lesiones viscerales (carcinomas renales, feocromocitomas y tumores neuroendocrinos pancreáticos).
La mayoría de los síndromes de VHL se acaban sometiendo a operación quirúrgica. En el caso de los feocromocitomas es conveniente usar previamente a la cirugía un bloqueador adrenérgico preoperatorio (el más común es la fenoxibenazamida). [9][10],[16]
Bibliografía.
Autores. Título. Revista. Vol. página inicial-página final (año).
- Smith, B. E., Wang, S. L., Jaime-Figueroa, S., Harbin, A., Wang, J., Hamman, B. D., & Crews, C. M. Differential PROTAC substrate specificity dictated by orientation of recruited E3 ligase. Nature Communications, 10(1), (2019). https://doi.org/10.1038/s41467-018-08027-7
- An S, Fu L. Small-molecule PROTACs: An emerging and promising approach for the development of targeted therapy drugs. EBioMedicine (553-563), 36, (2018).
- Liu, J., Ma, J., Liu, Y., Xia, J., Li, Y., Wang, Z. P., & Wei, W. PROTACs: A novel strategy for cancer therapy. Seminars in Cancer Biology, 67, 171–179, (2020). https://doi.org/10.1016/J.SEMCANCER.2020.02.006
- Kraemer, A., Doelle, A., Knapp, S., Structural Genomics Consortium. Structure of human WDR5 and pVHL:ElonginC:ElonginB bound to PROTAC with PEG linker (conformation #2), (2022) doi: 10.2210/pdb8BB2/pdb
- Iwai, K., Yamanaka, K., Kamura, T., Minato, N., Conaway, R. C., Conaway, J. W., Klausner, R. D., & Pause, A. Identification of the von Hippel-lindau tumor-suppressor protein as part of an active E3 ubiquitin ligase complex. Proc. Natl. Acad. Sci. U.S.A., 96(22), 12436–12441, (1999). https://doi.org/10.1073/pnas.96.22.12436
- Yalla, K., Elliott, C., Day, J. P., Findlay, J., Barratt, S., Hughes, Z. A., Wilson, L., Whiteley, E., Popiolek, M., Li, Y., Dunlop, J., Killick, R., Adams, D. R., Brandon, N. J., Houslay, M. D., Hao, B., & Baillie, G. S. FBXW7 regulates DISC1 stability via the ubiquitin-proteosome system. Molecular Psychiatry, 23(5), 1278–1286, (2018). https://doi.org/10.1038/MP.2017.138
- Foxler, D. E., Bridge, K. S., James, V., Webb, T. M., Mee, M., Wong, S. C. K., Feng, Y., Constantin-Teodosiu, D., Petursdottir, T. E., Bjornsson, J., Ingvarsson, S., Ratcliffe, P. J., Longmore, G. D., & Sharp, T. v. The LIMD1 protein bridges an association between the prolyl hydroxylases and VHL to repress HIF-1 activity. Nature Cell Biology, 14(2), 201–208, (2012). https://doi.org/10.1038/ncb2424
- Chittiboina P, Lonser R. Von Hippel-Lindau disease. Handbook of Clinical Neurology, 139-139, 132, (2015).
- Ben-Skowronek I, Kozaczyk S. Von hippel-lindau syndrome. Hormone Research in Paediatrics, 145-152, 84 (3), (2015).
- Julio Pérez Márquez. Patología Celular. Factores nutricionales. Hipoxia y anoxia. Sensores celulares de oxígeno, (2022).
- Knauth, K., Bex, C., Jemth, P., & Buchberger, A. Renal cell carcinoma risk in type 2 von Hippel-Lindau disease correlates with defects in pVHL stability and HIF-1alpha interactions. Oncogene, 25(3), 370–377, (2006). https://doi.org/10.1038/sj.onc.1209062
- Nelson, D. L., Cuchillo Foix, C. M., Lehninger, A. L., & Cox, M. M. Lehninger: Principios de Bioquímica (4a. ed.). Barcelona: Omega, (2005).
- Dong Zhao , Shanliang Zheng , Xingwen Wang, Hao Liu, Kunming Zhao, Li Li and Ying Hu. iASPP is essential for HIF-1α stabilization to promote angiogenesis and glycolysis via attenuating VHL-mediated protein degradation. Springer Nature Limited, (2022).
- Tanimoto K, Makino Y, Pereira T, Poellinger L. Mechanism of regulation of the hypoxia-inducible factor-1 alpha by the von Hippel-Lindau tumor suppressor protein. EMBO J. 2000;19:4298–309.
- de Heer EC, Jalving M, Harris AL. HIFs, angiogenesis, and metabolism: elusive enemies in breast cancer. J Clin Investig. 130:5074–87, (2020).
- Elias, R., Zhang, Q., & Brugarolas, J. The von Hippel-Lindau Tumor Suppressor Gene: Implications and Therapeutic Opportunities. Cancer Journal (Sudbury, Mass.), 26(5), 390–398, (2020). https://doi.org/10.1097/PPO.0000000000000480