Toxinas Proteicas: Ricina
Por Amara Seeruttun y Marcos Souto, 1º Biología Sanitaria, Bioquímica, UAH
1. Introducción
La ricina es una proteína obtenida a partir de las semillas de la planta de aceite de ricino (Ricinus communis) y tiene efectos altamente tóxicos sobre una amplia variedad de animales, entre los que se incluyen los insectos y los propios seres humanos. Su elevada toxicidad se debe a la pequeña cantidad que se requiere de esta para causar resultados letales; un miligramo de ricina puede acabar con la vida de una persona adulta y una sola molécula puede matar una célula (Morrison, 2021). Tales efectos dirigen la tendencia al uso terrorista, habiéndose detenido recientemente a un ciudadano iraní sospechoso de preparar un ataque en Alemania (ElMundo, 2023).

Contexto histórico
Actualmente, se piensa que la planta de la que se extrae la ricina (Ricinus communis L.) procede de África y Asia; sin embargo, existen pruebas de que a lo largo de la historia también ha sido fabricada o cultivada en muchas otras zonas y países del mundo con diversos fines.
El uso de la enzima se origina en la misma era prehistórica y las evidencias muestran su aplicación como veneno en palos de madera. Las semillas de ricino y otras partes de la planta también se usaron en el antiguo Egipto con objetivos farmacológicos, empleándose como abortivo, laxante o incluso como medicamento para niños supuestamente diabéticos. En la medicina occidental griega, figuras como Hipócrates también recetaron aceites de ricino por sus efectos laxantes y desintoxicantes, pero siempre en proporciones pequeñas. El ricino también aparece en la medicina tradicional oriental, pues en China se recomendaban las propiedades antihelmínticas de la enzima o su uso para el tratamiento de úlceras y heridas crónicas.
Más recientemente, la toxicidad de la semillas de ricino empezó a ser investigada a finales del siglo XIX en Estrasburgo, para así acabar adquiriendo un papel considerable en la medicina popular de todo el mundo. Si bien se llega a emplear en África para tratar enfermedades cutáneas y oculares, su importancia actual reside en las terapias oncogénicas y en el refuerzo del sistema inmune. Desgraciadamente, el uso de la ricina en la actualidad deriva de su alta toxicidad y por eso también es empleado en gran medida como agente biológico en guerras y actos terroristas, entre los que se incluyen intentos de asesinato de varios líderes mundiales.
(Polito et al., 2019)
2. Función biológica
La ricina es responsable de la inactivación de los ribosomas y, por tanto, de su síntesis proteica. Así, tanto los organismos procariotas como los eucariotas están expuestos a los efectos dañinos de esta molécula; sin embargo, los ribosomas bacterianos y los vegetales son menos susceptibles a la ricina y a dichos efectos (Cornell, 2001). El recorrido de esta enzima comienza en el paso a través de la membrana plasmática de la célula y continúa en el citosol, donde se movilizará para alcanzar los ribosomas del retículo endoplasmático e inhibiendo su acción por depurinación. Como se ha llegado a mencionar, una sola molécula de ricina es capaz de depurinar unos 1500 ribosomas por minuto, teniendo fatales efectos para la célula y para el organismo (Morrison, 2021).
Todo este proceso confiere a la ricina sus efectos perjudiciales y derivadas de estos, han ido surgiendo diversas aplicaciones biomédicas y biotecnológicas. Estas últimas incluyen tanto la fabricación de armas químicas como la destinación terapéutica.
Además, se cree que la síntesis de la ricina en la propia planta ha evolucionado para desempeñar un papel específico en la defensa contra animales, patógenos e insectos; sin embargo, no hay evidencias concretas sobre esto.
La ricina es sintetizada en el endosperma de las semillas de Ricinus communis y almacenada en la vacuola. Cuando germina, la toxina es hidrolizada en pocos días.
La síntesis de la ricina comienza como una preproricina que contiene las cadenas A y B, y donde se encuentra además una secuencia señal NH2-terminal que va a dirigir el transporte de la proteína al lumen del retículo endoplasmático, donde va a sufrir diferentes modificaciones para formar la proricina, entre ellas la formación de cinco puentes disulfuro a medida que se pliega la proteína.
Después la proricina es transportada al Aparato de Golgi, donde se producen más modificaciones, y finalmente es transportada a la vacuola. Ahí es activada por la acción de endopeptidasas que liberan las cadenas A y B, dejándolas unidas por solo un puente disulfuro, finalizando así la síntesis de la toxina.
La proricina transportada desde el retículo hasta la vacuola es catalíticamente inactiva. De esa forma se evita que la ricina pueda envenenar a la planta accidentalmente en caso de que alguna molécula acabase en el citoplasma.
3. Estructura y Mecanismo
Estructura
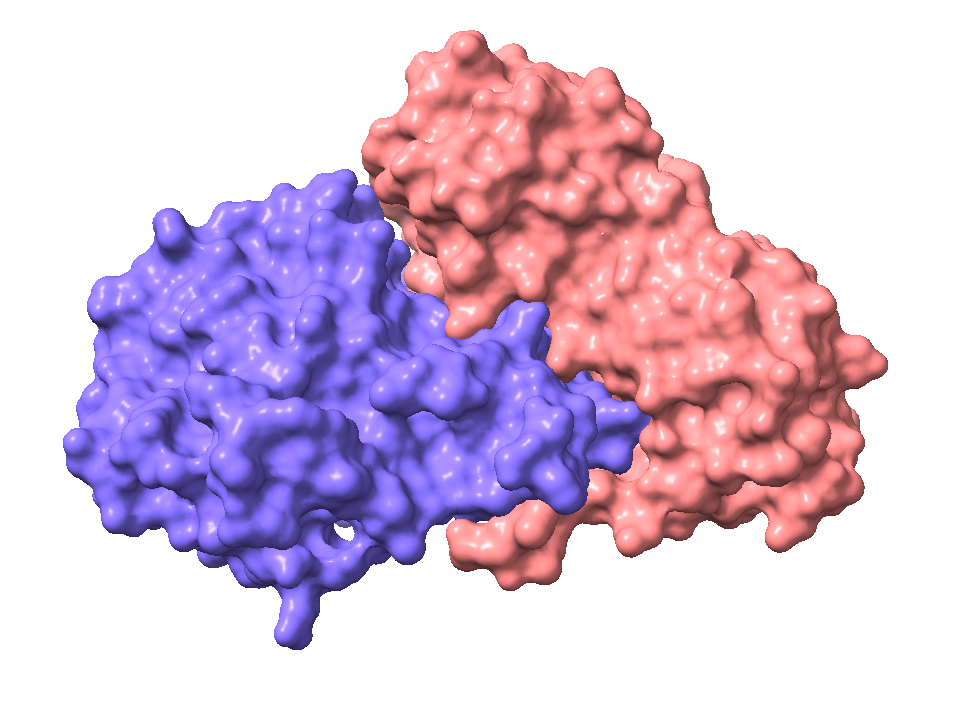
Imagen creada por Amara Seeruttun con ChimeraX a partir de PDB 2AAI
La ricina es una toxina proteica (65kDa) perteneciente al grupo de proteínas inactivadoras de ribosomas (RIPs) de tipo 2, caracterizadas por presentar dos subunidades, una con capacidad enzimática y otra con propiedad de lectina.
La cadena A (RTA) tiene función enzimática N-glicosidasa, e inhibe la síntesis de proteínas en los ribosomas por eliminación del residuo de adenina del ARNr 28S. Consta de 267 aminoácidos (30-32 kDa) que se pliegan en 3 dominios dando lugar a una proteína globular con un centro activo donde se encuentran los residuos Tyr 80, Tyr, 123, Glu177, Arg180, Trp211, que van a ser responsables de esa actividad N-glicosidasa.
La cadena B (RTB) es una lectina, por lo que se va a unir a hidratos de carbono en la superficie de la membrana, preferiblemente la galactosa. Se compone de 262 aminoácidos (32-34 kDa) que se pliegan para formar dos dominios, cada uno con cuatro subdominios, donde solo dos de ellos, tienen capacidad de unión a la galactosa.
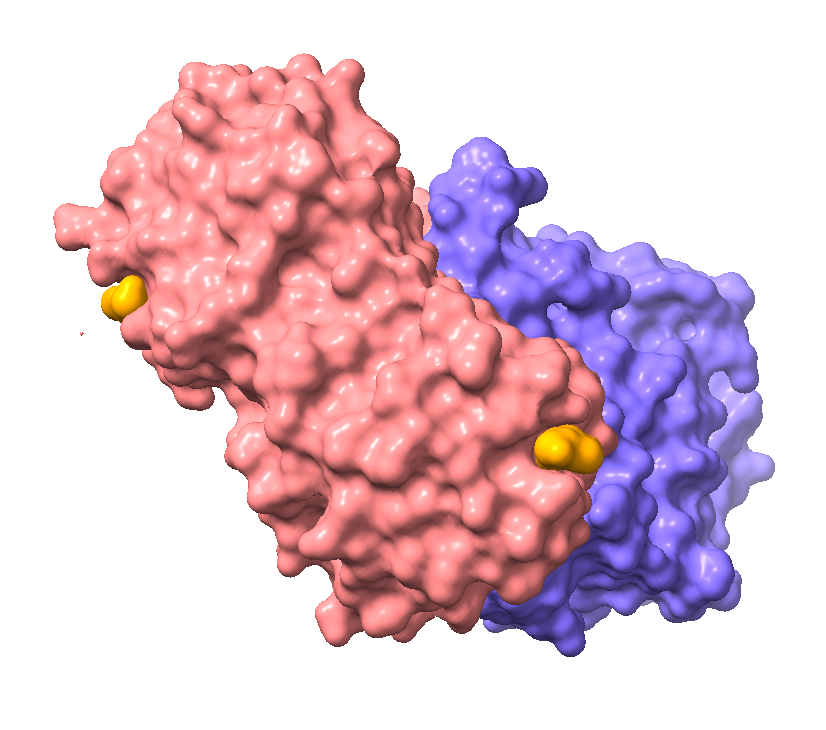
Imagen creada por Amara Seeruttun con ChimeraX a partir de PDB 2AAI
La cadena A y la cadena B están unidos por un puente disulfuro entre la cisteína 259 de la RTA y la cisteína 4 de la RTB.
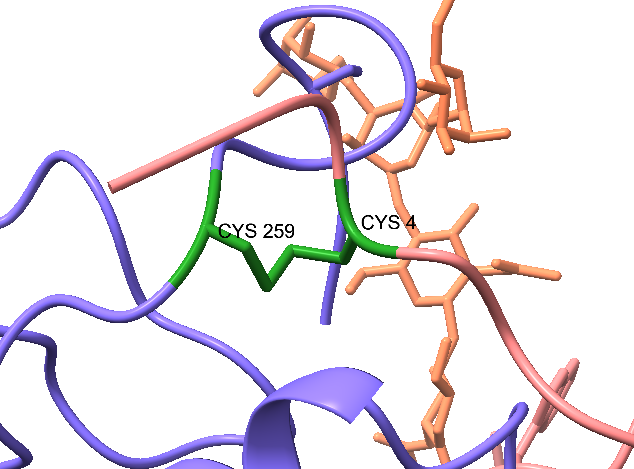
Imagen creada por Amara Seeruttun con ChimeraX a partir de PDB 2AAI
La ricina es sintetizada como una única cadena polipeptídica que se rompe para formar las cadenas A y B. Si no se separase formando esas dos cadenas, se ve que el precursor aún podría unirse a la galactosa, pero no sería capaz de actuar sobre el ARN 28S.
Mecanismo
Primero se produce la unión de la toxina a los glucolípidos y glucoproteínas de la superficie de la membrana, lo que va a desencadenar un proceso de endocitosis de la ricina.
Una vez dentro de la célula, parte de los endosomas que contienen ricina serán devueltos a la membrana plasmática, otra parte será transportado a lisosomas para ser degradados, y solo una pequeña proporción llegará al aparato de Golgi.
Cuando llegue ahí se realizará el transporte al retículo endoplasmático, donde es necesario la presencia del RTB para unirse a restos de galactosa. Una vez en el lumen del retículo, se produce la rotura del enlace disulfuro que unía las dos cadenas, y la translocación de la RTA al citoplasma, donde actuará sobre los ribosomas eliminando una molécula de adenina del ARNr 28S en una secuencia específica de GAGA.
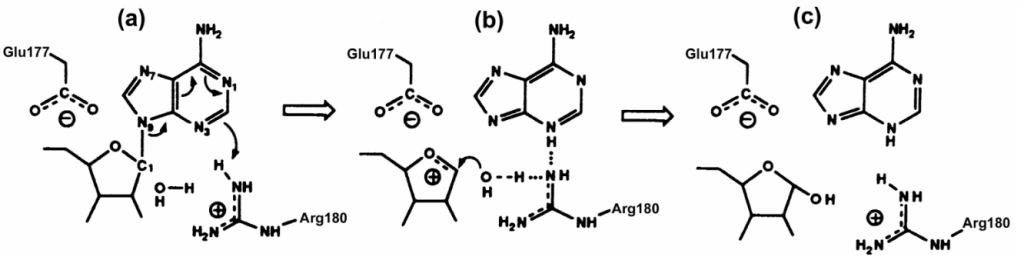
Los aminoácidos responsables de la actividad enzimática se encuentran en el centro activo y van a ser el Glu177, y la Arg180. También van a actuar los restos de Tyr80 y Tyr123.
Primero actúan la Tyr80 y Tyr123 que crean una situación de “stacking” con sus grupos aromáticos y la adenina del ARNr 28S, encajándola y estabilizando la estructura.
A continuación, la Arg180 va a protonar el N-3 de la adenina, provocando la ruptura del enlace entre N-9 de la adenina, y el C-1´ de la ribosa, haciendo que se transforme en un ion oxicarbonio, cuya carga positiva se va a estabilizar por la carga negativa del Glu177.
Por último, se produce la captación de un átomo de hidrogeno de una molécula de agua por la Arg180, neutralizando su carga y a su vez formando un ion hidroxilo que se va a unir al C-1´ del ion oxicarbonio, neutralizando su carga positiva, y liberándolo.
4. Implicaciones Biomédicas
Las diversas aplicaciones que presenta la ricina derivan principalmente de sus propiedades tóxicas y de los efectos que tiene en los animales, concretamente en los seres humanos. Dichos efectos fisiopatológicos dependen a su vez de la concentración de dosis y del tiempo de exposición. De esta forma, los dos principales usos de la enzima son como elemento terapéutico y como agente biológico en guerras y atentados terroristas. En ambos casos se deben tener en cuenta las distintas vías de intoxicación por las que la ricina llega a las células del organismo:
Vía dérmica
Se considera que la vía dérmica no permite a la ricina llegar al interior del cuerpo y tampoco causar efectos demasiado dañinos.
Vía parenteral
Existen al menos tres casos reportados de intoxicación por ricina a través de esta vía, causando en cada uno efectos más o menos similares. El suministro de la enzima por vía parenteral ha llegado a causar síntomas como cefaleas, fiebre, taquicardias, inflamación de nódulos linfáticos, acidosis metabólica y equimosis, mialgia en las extremidades, opresión en el pecho, etc. En algunos de esos casos también se llegó a la necrosis del tejido donde se produjo la inyección o incluso el fallo multiorgánico.
Esta vía de intoxicación también ha resultado efectiva en asesinatos selectivos, como el del periodista búlgaro, Georgi Markov.
Vía digestiva
Las intoxicaciones por esta vía normalmente provienen de la ingesta de las semillas de ricino y de estudios in vivo de animales, a los que se les suministra por vía oral. En algunos países de América y África es normal el uso de las semillas para la fabricación de collares y de otros objetos destinados al uso infantil, por lo que hay riesgo de ingesta por parte de los niños pequeños. En cambio, también existe su uso en medicina natural como purgante, emético, anticonceptivo y como tratamiento de la lepra y la sífilis.
Vía inhalatoria
Hasta la actualidad solamente se sabe de un caso de inhalación accidental de ricina, caso en el que el paciente llegó a presentar síntomas como fiebre, dolor en el pecho, tos, disnea, náuseas y artralgia. También se ha llegado a usar en el estudio in vivo de roedores y primates.
Esta vía también se ha llegado a usar en ataques terroristas o bélicos selectivos, pero lo normal es que tanto la vía inhalatoria como la digestiva afecten a grandes grupos.
En el ámbito biomédico, la ricina se está investigando para poder usarse en terapias oncogénicas, pues la capacidad de inactivar la actividad ribosómica de las células cancerígenas anularía la síntesis de proteínas que necesitan para seguir proliferando de forma descontrolada. Por eso se están intentando sintetizar inmunotoxinas derivadas de la ricina que solamente ataquen a las células afectadas y no a las sanas, pues de ser así podría acabar en un fallo multiorgánico. También se emplea la enzima en la proliferación de linfocitos y en el refuerzo del sistema inmune, ya que su alta toxicidad para los macrófagos conduciría a la producción de citocinas inflamatorias cicatrizantes.
5. Referencias
Departamento de Ciencia Animal de la Universidad de Cornell. 2001. Toxina de ricina de la planta de ricino, Ricinus communis. Departamento de Ciencia Animal de la Universidad de Cornell.
ElMundo (8 de enero, 2023). Detenido en Alemania un ciudadano iraní sospechoso de preparar un atentado con ricina y cianuro. https://www.elmundo.es/internacional/2023/01/08/63ba8aaa21efa0991d8b4576.html
Grela, P., Szajwaj, M., Horbowicz-Drożdżal, P., & Tchórzewski, M. (2019). How ricin damages the ribosome. Toxins, 11(5), 241.
Hernández Díaz, P., Martín González, O., Rodríguez de Pablos Vélez, Y., & Ganem Báez, F. A. (1999). Aplicaciones de las lectinas. Revista Cubana de Hematología, Inmunología y Hemoterapia, 15(2), 91-95.
Lord, J. M., Roberts, L. M., & Robertus, J. D. (1994). Ricin: structure, mode of action, and some current applications. The FASEB journal, 8(2), 201-208.
Morrison, R. Ricina: el veneno más terrorífico en la historia de la humanidad. https://es.kineshma.net/Ricin-3108
Olsnes, S. (2004). The history of ricin, abrin and related toxins. Toxicon, 44(4), 361-370.
PDB-101: Educational resources supporting molecular explorations through biology and medicine. Christine Zardecki, Shuchismita Dutta, David S. Goodsell, Robert Lowe, Maria Voigt, Stephen K. Burley. (2022) Protein Science31: 129-140 doi:10.1002/pro.4200
Pita, R., Anadón, A., & Larrañaga, M. M. (2004). Ricina: una fitotoxina de uso potencial como arma. Revista de toxicología, 21(2-3), 51-63.
Polito, L., Bortolotti, M., Battelli, M. G., Calafato, G., & Bolognesi, A. (2019). Ricin: An ancient story for a timeless plant toxin. Toxins, 11(6), 324.
The RCSB PDB «Molecule of the Month»: Inspiring a Molecular View of Biology D.S. Goodsell, S. Dutta, C. Zardecki, M. Voigt, H.M. Berman, S.K. Burley (2015) PLoS Biol 13(5): e1002140. doi:10.2210/rcsb_pdb/mom_2013_5
UCSF ChimeraX: Structure visualization for researchers, educators, and developers. Pettersen EF, Goddard TD, Huang CC, Meng EC, Couch GS, Croll TI, Morris JH, Ferrin TE. Protein Sci. 2021 Jan;30(1):70-82.