VIH: Estructura, mecanismos de acción y proyectos de vacunas
Helena Pérez López e Iván Pérez Jara Biología Molecular 3º Biología Sanitaria
¿QUÉ ES EL VIH?
El VIH o Virus de la Inmunodeficiencia Humana es un virus perteneciente a la familia Retroviridae, en particular del género Lentivirus, que se caracteriza por largos períodos de incubación e infecciones persistentes en el tiempo. Estos virus no son oncogénicos y su genoma está formado por un RNA monocatenario bastante extenso. Existen dos especies de VIH, el de tipo 1 y el de tipo 2, siendo el primero mucho más común, aunque cabe destacar que también existen muchos otros grupos, subtipos y cepas de este virus que tienen diferencias genéticas entre ellos. Su mecanismo de acción se caracteriza por el ataque al sistema inmune del hospedador y en particular por la destrucción de linfocitos T-CD4, lo que causa a largo plazo una enorme susceptibilidad a patógenos oportunistas.

La mayoría de las personas que contraen VIH en el mundo se contagian de VIH-1 (aproximadamente un 95% de los contagiados) y su progresión es más rápida que la del VIH-2, cuya recuperación es más complicada y el cual es poco común fuera de África Occidental; se sabe que tiene cierta resistencia a antirretrovirales e incluso puede no reaccionar ante ninguno de los que existen actualmente en el mercado, ya que tiende a presentar 3 mutaciones que afectan a la transcriptasa inversa o retrotranscriptasa (mutaciones K65R, Q151M y M184V).
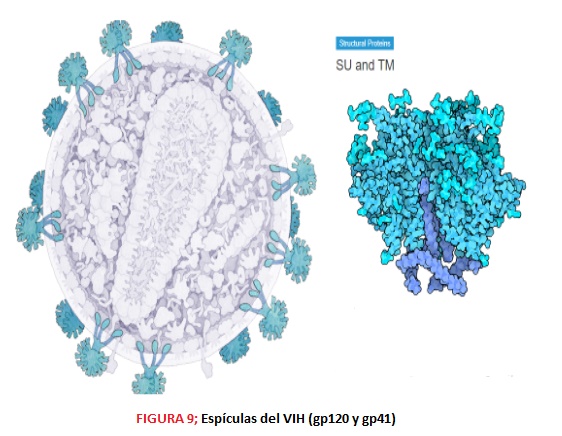
ESTRUCTURA En cuanto a su estructura, el virión del VIH tiene una morfología esférica, aproximadamente de 90-120 nm y consta de varias capas. En la zona más externa encontramos una bicapa lipídica formada por 72 espículas, codificadas por las glicoproteínas gp120 y gp41, que favorecen la unión e interacción de los viriones con las células diana del organismo. Estas glicoproteínas, gp120 de superficie y gp41 con dominio transmembrana, se producen gracias a las proteasas del hospedador, que lisan la polipoproteína gp160.
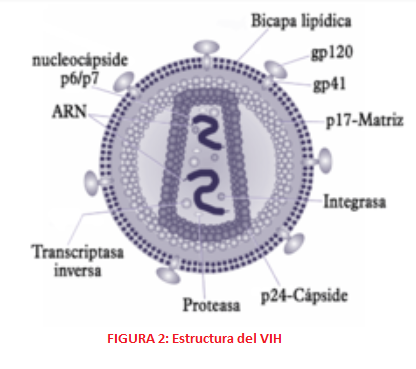
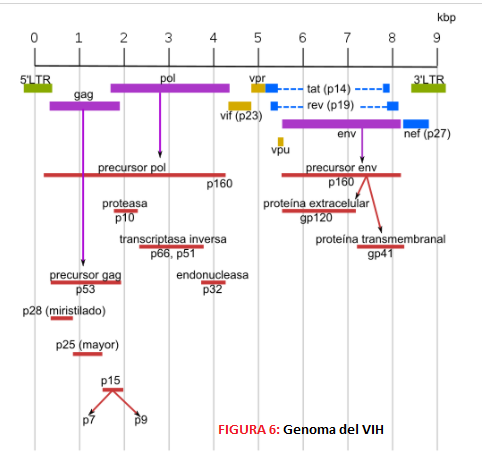
La capa intermedia es una cápside de estructura icosaédrica y en la zona central se encuentra la nucleocápside que contiene una estructura tubular con el material genético viral en su interior en forma de dos cadenas idénticas de RNA. Este RNA consta de diferentes genes, seis genes reguladores o accesorios (nef, tat, rev, vpr, vif y vpu) y tres genes estructurales (pol, gag, env). Estos últimos son especialmente importantes ya que son las dianas moleculares de la vacuna Mosaico (Ad26.Mos4.HIV y gp140 bivalente).
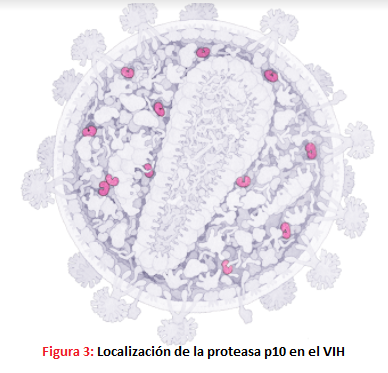
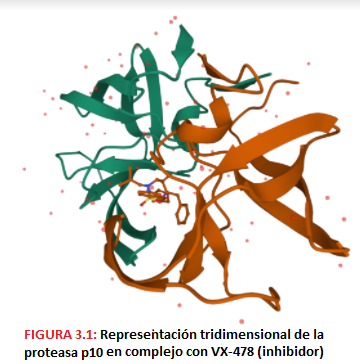
- El gen Pol codifica para una poliproteína precursora Pol que dará lugar a las enzimas virales. Estas son: -La proteasa p10, una aspartil-proteasa que corta a las proteínas Gag y Pol.
-La transcriptasa inversa o P51, que transcribe el RNA viral monocatenario a DNA bicatenario. Es una DNA polimerasa que tiene actividad tanto dependiente de RNA (en la primera síntesis) como de DNA.
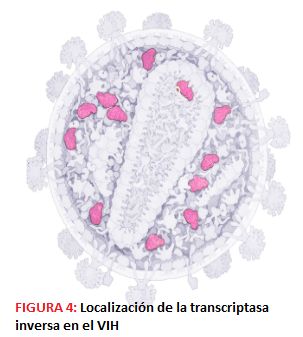
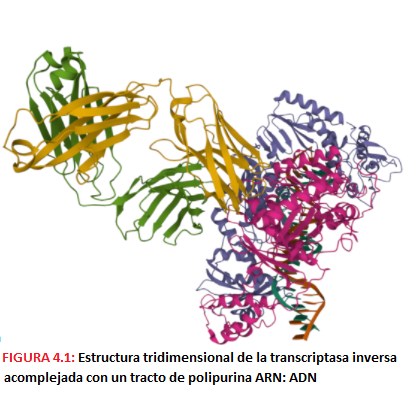
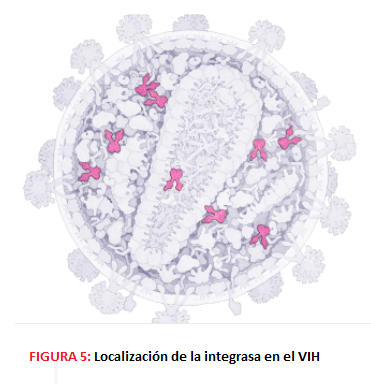
-La P31 o integrasa, con actividad exonucleasa, endonucleasa y ligasa que se encarga de integrar el DNA viral en el genoma de la célula hospedadora; no es dependiente de ATP.
-La enzima P15 RNAsa, cuya función es eliminar el RNA del dúplex RNA-DNA que se forma al actuar la retrotranscriptasa para permitir la síntesis de la segunda cadena de DNA; esta RNAsa se encuentra en la subunidad p66 de la transcriptasa inversa, ya que colabora con ella.
2. El gen Gag al traducirse da lugar a una poliproteína Gag o p55, que durante la traducción se asocia a la membrana del hospedador por la miristilación de su extremo amino terminal y en la maduración se procesa por una proteasa, formando una serie de proteínas: -Proteína p17: proteína de la matriz que favorece el anclaje a membrana y dirige el complejo de pre-integración hacia el núcleo. También se encarga de estabilizar la propia envoltura. -Proteína p24: forma parte de la cápside. -Proteína p7, proteína de la nucleocápside que permite el reconocimiento y la integración del RNA al virión recién formado y facilita la retrotranscripción. -Proteína p6, es parte de la nucleocápside y permite la incorporación de la proteína accesoria vpr al virión y la gemación del virión y la membrana de la célula hospedadora.
3. El gen Env codifica la proteína Env o Gp160, encargada de la formación de las 72 espículas y la envoltura (bicapa lipídica) a partir de elementos de la membrana del hospedador. Tras la glicosilación y la escisión de esta proteína se obtienen: -Proteína gp41, proteína transmembrana que forma parte de las espículas -Proteína gp120, cuya función es la fijación de las células CD4; además se une de forma no covalente a gp41 y forma la cabeza externa de las espículas.
4. En cuanto a los genes reguladores, estos dan lugar a dos proteínas reguladoras, que son la proteína Tat, transactivador transcripcional que regula la expresión de los genes del VIH al unirse a la región TAR, y la proteína Rev, factor regulador de la expresión del VIH que controla la exportación de mRNA hacia el citoplasma. Es decir, ambas proteínas son clave para la expresión génica viral y su acción sinérgica incrementa dicha expresión.
5. Destaca también la existencia de una serie de proteínas accesorias con funciones variadas, como son: -Proteína Vif (p23), que favorece la infectividad y la maduración de la partícula viral anulando la acción del factor ApoBEC3G. -Proteína Vpr (p15), queayuda en la inserción del complejo de pre-integración en el núcleo. -Proteína Vpu (p16), proteína única en el VIH-1 encargada de promover la degradación de la proteína CD4 en el RE y la liberación de los viriones. -Proteína Nef (p27), inductora de la producción de quimiocinas que favorece la activación de células T y desregula la expresión del MHC-1 y de los linfocitos CD4.
6. Dentro del genoma viral existen también otras secuencias redundantes, las LTR (Long Terminal Repeats), que están en los extremos del genoma cuando el virus se encuentra en estado de provirus y que favorecen la integración del genoma vírico y la regulación de la transcripción y la poliadenilación.
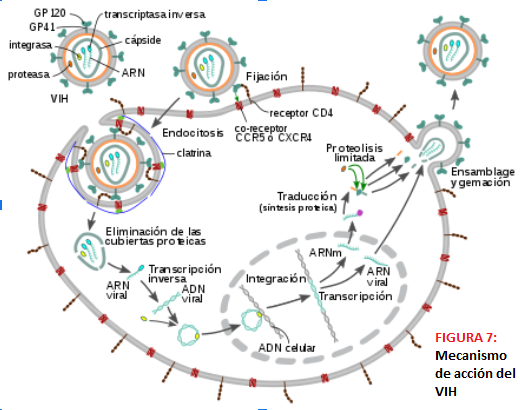
MECANISMO DE ACCIÓN DEL VIH El VIH no tiene capacidad de autorregulación, por lo que necesita infectar a una célula que actúe de hospedadora para poder continuar su ciclo vital; estas células invadidas suelen ser mayoritariamente linfocitos T CD4+; no obstante, también pueden infectar otras células que cuenten con los receptores CD4 y los correceptores de quimiocinas CCR5 y CXCR4, como son las dendríticas, los macrófagos, las células de la microglía,etc.
La primera etapa de su ciclo biológico comprende la penetración del virus y la integración en el genoma celular. La entrada del VIH en la célula se produce entonces por dos interacciones de los anteriormente citados receptores (CD4, CCR5 y CXCR4) en la membrana celular diana con la gp120 viral, produciéndose lo que se denomina acoplamiento. Primero interacciona la gp120 con el receptor CD4, se produce un cambio conformacional que permite la interacción con los correceptores y posteriormente se produce otro cambio conformacional que da lugar al plegamiento de gp41. Esto permite la fusión de la membrana celular con la envoltura lipídica del virus, que da paso a la inserción de la nucleocápside y la decapsidación del genoma vírico.
Tras la fijación, la penetración y la liberación viral nos encontramos entonces con el RNA vírico en el citoplasma celular, listo para ser transcrito por la transcriptasa inversa, de tal modo que se obtenga un dúplex DNA-RNA. Posteriormente, se separa esta doble cadena y se elimina la hebra de RNA, se forma gracias a la transcriptasa inversa otra hebra de DNA (actividad DNA sintetasa DNA dependiente) y se forma DNA de doble cadena; parte de este se integra en el genoma de la célula hospedadora que se encuentra en el núcleo celular gracias a los extremos cohesivos formados por la integrasa, aunque cabe destacar que hasta un 90% del DNA viral en linfocitos infectados no está integrado en el genoma celular. Se finaliza de esta manera la primera etapa del ciclo biológico del VIH.
Durante la segunda mitad de su ciclo biológico se sintetizan los componentes virales, se ensamblan y salen los viriones. A partir de este momento el VIH puede permanecer latente, replicarse y transcribirse con normalidad o sufrir una replicación masiva y aumentada.
El inicio de la transcripción del provirus se da dependiendo de factores virales y celulares que interaccionan con zonas de las regiones LTR; una vez estimulado el promotor viral comienza la transcripción gracias a la RNA polimerasa II de la célula diana, y el transcrito obtenido pasa del núcleo al citoplasma con ayuda de Rev (proteína viral). Este transcrito es un mRNA complejo con intrones y exones que se ha procesado antes de ir hacia el citoplasma, ya que en este dará comienzo la traducción, obteniéndose poliproteínas que tras su procesamiento darán lugar a proteínas víricas funcionales que se ensamblan junto con RNA viral para formar viriones.
Estas nucleocápsides saldrán de la célula hospedadora mediante un proceso de gemación a través de la membrana plasmática, constituyendo viriones al formar su envoltura lipídica con parte de la membrana de la célula de la que están saliendo; estos viriones son partículas maduras que pueden infectar otras células.
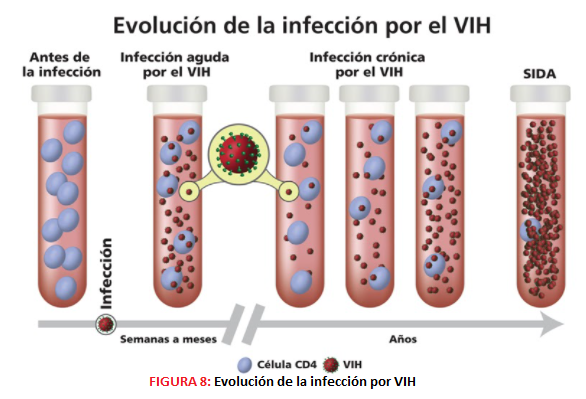
FASES DE LA INFECCIÓN POR VIH La infección por VIH se desarrolla en etapas y debe ser tratada rápidamente para evitar la proliferación del virus, ya que en estados avanzados se puede dar el Síndrome de inmunodeficiencia adquirida (SIDA). El VIH va destruyendo de manera gradual el sistema inmunitario de la persona infectada, ya que ataca a los linfocitos T CD4+ y a otros tipos de células inmunitarias. Existen tres fases durante la infección por VIH, que son:
-Infección aguda. Esta primera etapa se manifiesta tras 2-4 semanas desde el contacto con el virus y se caracteriza por la aparición de síntomas generales, similares a los de la Influenza. Durante esta etapa la carga viral es muy alta ya que la tasa de reproducción y propagación del virus es muy rápida. -Infección crónica. Es una fase de latencia que puede durar hasta 10 años o más, y en ella los afectados suelen ser asintomáticos ya que la tasa de reproducción del virus es muy baja. -SIDA. Etapa final de la infección por VIH en la cual el sistema inmune está prácticamente destruido y el afectado es susceptible a contraer infecciones oportunistas y cáncer por la inmunodeficiencia que padece. Esta fase se caracteriza por la alta carga viral que presentan los enfermos y es diagnosticada cuando el paciente tiene un recuento de células CD4 de menos de 200/mm3 o si presentan ciertas infecciones oportunistas, y la esperanza de vida no suele ser mayor de 3 años.
DETECCIÓN DEL VIH Y FÁRMACOS ACTUALES No existen manifestaciones clínicas inmediatas de la infección por este virus sea cuál sea la vía de transmisión (sexual, sanguínea o perinatal), por lo que las pruebas para su detección se realizan bajo sospecha de haber contraído el virus o en personas en riesgo de contraerlo (que provengan de zonas con una alta prevalencia de VIH, parejas de individuos que ya lo han contraído,etc); estas pruebas varían desde pruebas rápidas para la detección de anticuerpos de VIH hasta pruebas moleculares, tal y como la PCR anidada, la RT-PCR, ELISA… En cuanto a los fármacos, actualmente hay una gran variedad de fármacos existentes en el mercado que evitan la infección por VIH y la progresión y empeoramiento de la enfermedad, y en muchos casos se utilizan varios al mismo tiempo para mejorar su efectividad en lo que se llama TARGA o Terapia Antirretroviral de Gran Actividad. Estas terapias consisten en el uso de medicamentos que bloquean al virus en diferentes etapas de su ciclo biológico, es decir, se utilizan distintas clases de medicamentos que actúen de manera complementaria para evitar la multiplicación del virus y para evitar que se dé el Síndrome de inmunodeficiencia adquirida o SIDA. Los fármacos usados se clasifican según la proteína viral a la que afecten, por lo que encontramos inhibidores de la proteasa, de la integrasa, inhibidores de la fusión viral e inhibidores de la retrotranscriptasa análogos (como la Zidovudina) o no análogos de nucleósidos. El objetivo de estos medicamentos es conseguir que las personas infectadas reduzcan la carga viral significativamente hasta que sea indetectable mediante pruebas, de tal modo que no puedan tampoco transmitir el virus por la baja carga viral que presentan. A lo largo de los años también se han investigado posibles vacunas contra este retrovirus, y a continuación se explicará con detalle el mecanismo de actuación de la última vacuna que se está estudiando para evitar contraer el HIV.
VACUNA FRENTE AL VIH Si bien la accesibilidad a la terapia antirretroviral y la profilaxis previa a la exposición permiten reducir la carga viral, gracias a que bloquean su replicación, no consiguen eliminar por completo el virus del organismo. Es por esto que a día de hoy existen proyectos destinados a producir una vacuna que consiga tanto prevenir la infección por VIH como reducir la carga viral en aquellos pacientes previamente infectados. Pese a que la idea general de la vacuna está clara, han suscitado serios problemas que dificultan la creación de una vacuna segura y eficaz que cumpla ambas condiciones, por lo tanto, los ensayos clínicos realizados han tenido un resultado negativo, es decir, han fracasado. Los problemas derivados del VIH que complican estos experimentos son debidos, principalmente, a la capacidad del virus para replicarse continuamente de forma muy rápida y al ser indetectable por nuestro sistema inmune. A continuación, detallaremos más el proceso:
- Variabilidad genética: El VIH es un virus que presenta una amplia tasa de replicación, por lo tanto, al haber un mayor número de copias es normal que surjan un mayor número de mutaciones. Normalmente, los anticuerpos que se producen son específicos, es decir, la respuesta inmunitaria no se podría producir en las diferentes cepas que vayan surgiendo, debido a los pequeños, pero significativos cambios que producen estas mutaciones. Como consecuencia, el diseño de una vacuna que proteja de todas las variantes está suponiendo un gran reto a lo largo de estos años de investigación.
- Evasión de la respuesta inmune (la capa de glucanos): La proteína de pico viral trimétrica Envelope (Env) es la única diana antigénica que presenta la superficie del VIH, la cual es responsable de la maquinaria de fusión del propio virus. Como os contamos anteriormente, el trímero Envelope está constituido por 3 protómeros que se encuentran asociados de forma no covalente. Esta unión ocurre entre gp120 y las subunidades gp41 con el dominio transmembrana, ambos formados después de la escisión postraduccional de gp160 y la posterior glicosilación.
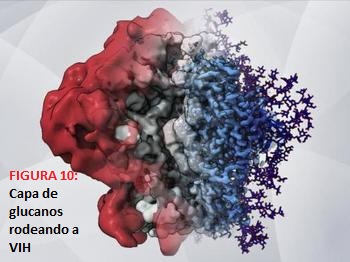
Por lo tanto, se produce un encubrimiento de la superficie por glucanos, lo que conlleva a un mecanismo de evasión de la respuesta inmune, puesto que, los azúcares sintetizados han sido formadas por nuestro propio organismo. Esto se debe a que el virus no es capaz de realizarlo por sí mismo, de tal manera que el sistema inmunitario no los detecta como extraños, así que no son destruidos y pasan desapercibido, es decir, como si presentase un “disfraz”.
Como consecuencia de ambos problemas, nuestro sistema inmune humoral es incapaz de generar anticuerpos ampliamente neutralizantes para la gran diversidad de cepas que el VIH presenta.
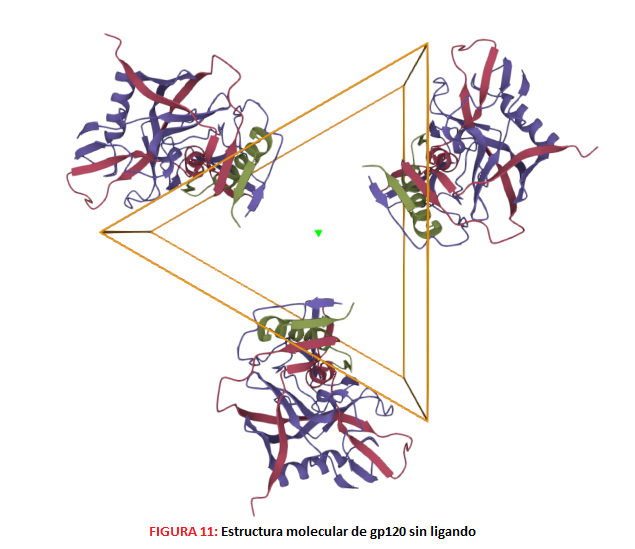
MECANISMOS DE ACCIÓN DE LAS VACUNAS 1.- Desarrollo de Ab ampliamente neutralizantes. Debido a la gran diversidad de secuencias de la proteína Env del VIH, podemos diferenciar distintos niveles según el grado de sensibilidad a la neutralización que presenten las diferentes cepas, permitiendo realizar así una clasificación de las mismas. Para ello, debemos de tener en cuenta que el trímero Env es metaestable (se encuentra en aparente equilibrio, pero puede cambiar a un estado más estable) y presenta un estado conformacional “abierto”, uno “intermedio” y otro “cerrado”.
Lo importante de esta clase de vacunas es que la respuesta de células TCD 8 está dirigida a regiones conservadas dentro de proteínas internas, es decir, a la proteína estructural Gag, así que, la glicosilación de Env no supondría una confusión a la hora de diseñar la vacuna. Por otro lado, los epítopos de células T son secuencias de péptidos lineales a diferencia de las estructuras terciarias y cuaternarias de los bnAbs, facilitando respuestas protectoras más amplias al ser más efectivas.
PROYECTOS Y ESTUDIOS A DÍA DE HOY A pesar de que ha habido 7 tipos de vacunas utilizadas en sus respectivos proyectos y estudios, hoy en día no han demostrado ser capaces ni de tratar ni prevenir la infección. De igual manera se están realizando numerosos estudios aún no finalizados. A continuación, explicaremos más detalladamente aquellos que tienen más repercusión y oportunidad de éxito:
- MOSAICO: Es un ensayo de eficacia con el objetivo de evaluar un vector de adenovirus cebado con inmunizaciones de refuerzo de proteína Env recombinante. Se trata de un ensayo multicéntrico que recluta participantes de varios países. En este caso, para evitar problemas relacionados con la seroprevalencia de Ab5 preexistentes se eligió el serotipo 26 (Ad26) para desarrollar la vacuna del vector Ab recombinante. Básicamente, Mosaico utiliza una vacuna tetravalente con vector de Ad26 (AD26.Mos.Hiv) cuyo contenido son partes iguales de 2 vectores de mosaico Gag-Pol Ad26 distintos y 2 vectores de mosaico Env Ad26 junto a un refuerzo de proteína Env gp140. En este caso, los antígenos mosaico tienen una serie de secuencias de VIH recombinantes computacionalmente con el fin de albergar la gran diversidad de secuencias de proteína del VIH, además de provocar respuestas de células T más fuertes y amplias. Tras probar esta vacuna en monos rhesus se confirmó cierta protección frente a SHIV (el virus de la inmunodeficiencia en simios), gracias a la asociación de Ab de unión a Env. En resumen, la vacuna tetravalente logró un mayor éxito que la vacuna trivalente anteriormente estudiada, obteniendo respuestas de células T CD4 específicas de antígenos y anticuerpos superiores. Concretamente, género respuestas de unión de IgG dirigidas a gp120 e IgG3 específica de Env de subtipo C en el 66% de los que recibieron las 4 dosis. Actualmente, el proyecto sigue realizándose.
- MODERNA: La vacuna de Moderna es una vacuna de ARNm basadas en Env cuyo objetivo es generar respuestas robustas específicas de antígenos, a partir de estimular la actividad de células inmunes conocidas como células B de la línea germinal. La estimulación de estas células B especiales puede producir anticuerpos ampliamente neutralizantes que permitirían combatir al VIH. Fundamentalmente, estos bnAbs producidos por nuestro sistema inmunológico podrían tanto protegernos de las cepas más peligrosas como de posibles nuevos subtipos que surjan, debido a la rápida replicación del virus y, como consecuencia, la rápida tasa de mutación. Dentro de las células B de la línea germinal hay diversos tipos, pero son muy raras y cada una de estas células contiene un plano de un anticuerpo y realiza dos procesos:
- Una hipermutación somática con el objetivo de generar células hijas capaces de generar anticuerpos con versiones ligeramente diferentes, facilitando así su actuación frente a otro tipo de cepas.
- La expansión clonal. es decir. las células portadoras de la variante más exitosa producen muchas copias de sí mismo para enfrentarse a la infección.
En el VIH, la proteína que es reconocida será la gp120 de Env, en otras palabras, es la herramienta que utiliza el virus para acoplarse a la célula diana para infectarla. La importancia que tiene esta proteína es que se ha mantenido evolutivamente, por lo tanto, va a ser el target principal de este tipo de vacunas. Conociendo esto, el mecanismo de actuación de la vacuna de Moderna es sencillo. Utiliza como antígeno, la proteína OD-GT8 6 omer, la cual se parece a la parte de acoplamiento de gp120. Esta proteína ha sido probada en ratones dando como resultado una estimulación acompañada de una hipermutación somática de células B de la línea germinal, produciendo el bnAb llamado VRC 01.
¿Cuál es el problema de realizar experimentos con OD-GT8 6 omer? Su fabricación es costosa y tardía. Para ello Moderna ha implementado las instrucciones necesarias para su formación en forma de ARN mensajero para que sea nuestro cuerpo quién la fabrique, en vez de hacerlo artificialmente y añadirlo después. De esta manera, inyectamos el ARNm, protegido por una envuelta, que sería capaz de ingresar a la célula. Una vez en la célula, el ARNm que contiene la información para producir la proteína OD-GT8 6 omer saldría de la envoltura para dirigirse a los ribosomas libres donde se traduce. Por consiguiente, se generan proteínas que quedan en la superficie celular y que son reconocidas por las células del sistema inmune estimulando en específico a las células B de la línea germinal y produciendo bnAbs preparados para combatir cualquier posible infección en un futuro.
Estos avances y técnicas que ha desarrollado Moderna han sido capaces de llevarse a cabo gracias a las vacunas frente COVID. Estas vacunas también usan este mecanismo de ARNm, pero utilizando otro tipo de proteína que es similar a la proteína espiga de la superficie del SARS-COV2. Cabe reconocer que otro hecho importante es que este ARNm no entraría en el núcleo de la célula, puesto que, la síntesis de la proteína se realiza en los ribosomas libres y, por ende, no cambia el ADN de las células.
BIBLIOGRAFÍA
- Santana, Alfredo, Domínguez, Casimira, Lemes, Angelines, Molero, Teresa, & Salido, Eduardo. (2003). Biología celular y molecular del virus de inmunodeficiencia humana (VIH). Revista de Diagnóstico Biológico, 52(1), 07-18. REVISIONES Biología celular y molecular del virus de inmunodeficiencia humana (VIH).
- Rice A. P. (2017). The HIV-1 Tat Protein: Mechanism of Action and Target for HIV-1 Cure Strategies. Current pharmaceutical design, 23(28), 4098–4102. The HIV-1 Tat Protein: Mechanism of Action and Target for HIV-1 Cure Strategies | Bentham Science
- https://www.formulacionquimica.com/
- Jeong Hyun Lee, Shane Crotty, HIV vaccinology: 2021 update, Seminars in Immunology, Volume 51, 2021, 101470, ISSN 1044-5323, https://doi.org/10.1016/j.smim.2021.101470. (https://www.sciencedirect.com/science/article/pii/S1044532321000014)
- Hargrave, A., Mustafa, A. S., Hanif, A., Tunio, J. H., & Hanif, S. (2021). Current Status of HIV-1 Vaccines. Vaccines, 9(9), 1026. https://doi.org/10.3390/vaccines9091026
- https://www.iavi.org/our-science/bnabs-for-hiv-prevention
- Scanlan, C., Offer, J., Zitzmann, N. et al. Exploiting the defensive sugars of HIV-1 for drug and vaccine design. Nature 446, 1038–1045 (2007). https://doi.org/10.1038/nature05818
- Montefiori, David C. a ; Roederer, Mario b ; Morris, Lynn c ; Marinero, Michael S. d Niveles de neutralización del VIH-1, Opinión actual sobre el VIH y el SIDA: marzo de 2018 – Volumen 13 – Número 2 – p 128-136 doi: 10.1097 / COH.0000000000000442. https://journals.lww.com/co-hivandaids/Fulltext/2018/03000/Neutralization_tiers_of_HIV_1.6.aspx
ÍNDICE DE IMÁGENES
- FIGURA 1, 3, 4, 5 y 9: https://cdn.rcsb.org/pdb101/learn/resources/structural-biology-of-hiv/index.html
- FIGURA 2: https://es.wikipedia.org/wiki/Archivo:HI-viri%C3%B3n.png (Image: Hiv gross german.png de Daniel Beyer. Adaptado por Luis Fernández García.)
- FIGURA 3.1: https://www.rcsb.org/3d-view/1HPV/1
- FIGURA 4.1: https://www.rcsb.org/3d-view/1HYS/1
- FIGURA 5.1: https://www.rcsb.org/3d-view/1EX4/1
- FIGURA 6: Genoma del VIH. Fuente: AMELI M, Gladys I y GUTIERREZ G, Cristina del R. «Infección por VIH-1 en pacientes no progresores a largo tiempo». INHRR, Dic. 2007, vol.38, no.2, p.55-61. ISSN 0798-0477.
- FIGURA 7: https://es.wikipedia.org/wiki/Archivo:HIV-replication-cycle-es.svg
- FIGURA 8: https://hivinfo.nih.gov/es/understanding-hiv/fact-sheets/las-fases-de-la-infeccion-por-el-vih
- FIGURA 10: https://www.scripps.edu/news-and-events/press-room/2020/20201023-ward-glycan.html
- FIGURA 11: https://www.rcsb.org/3d-view/3DNN/1
.