El Fotosistema I
Pawel Kocieda Aleksandrowicz, Luna María Ortiz García. Biología Sanitaria. UAH
INTRODUCCIÓN
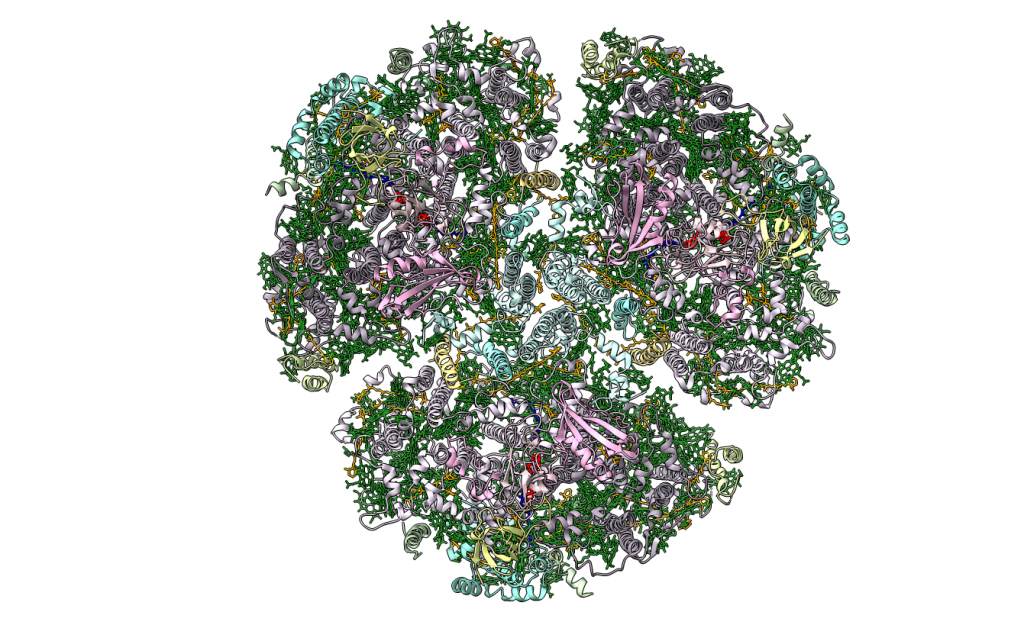
La fotosíntesis oxigénica es el principal método de conversión de la luz solar en energía química en la Tierra, y es catalizada por cuatro complejos de proteínas de membrana distintos: el fotosistema I, fotosistema II, el complejo citocromo b6f y la F-ATPasa. Aquí nos vamos a centrar en el primero de estos.
El fotosistema I, conocido también por P700 o PSI, es uno de los dos fotosistemas presentes en la membrana tilacoidal de los cloroplastos que se encargan de absorber los fotones de la luz y transformar la energía luminosa en energía química para llevar a cabo la fotosíntesis. Funciona como una plastocianina/ferredoxina oxidorreductasa dependiente de la luz, y genera un complejo molecular extremadamente reductor.
ESTRUCTURA
Pigmentos Fotosintéticos:
Antes de comenzar a explicar las unidades funcionales que componen el fotosistema, es importante mencionar el papel indispensable de los pigmentos fotosintéticos (que son los componentes básicos ambos fotosistemas existentes). Estos son lo que hacen posible la fotosíntesis, estando encargados de captar la energía luminosa.
¿Y cómo actúan los pigmentos?
Cuando un fotón impacta con un electrón de un pigmento fotosintético, éste electrón se excita a un nivel de energía superior; a una posición más alejada del núcleo. Cuando la molécula de pigmento vuelve a su estado de reposo, cede la energía a otra molécula de pigmento vecina. Esto es lo que ocurre en el pigmento antena (que detallaremos más adelante).
La energía recogida se transmite de un pigmento vecino a otro hasta que llega a una clorofila (primer dador de electrones), cuyo electrón no volverá a su estado de reposo sino que será dado a otra molécula (denominada primer aceptor de electrones).
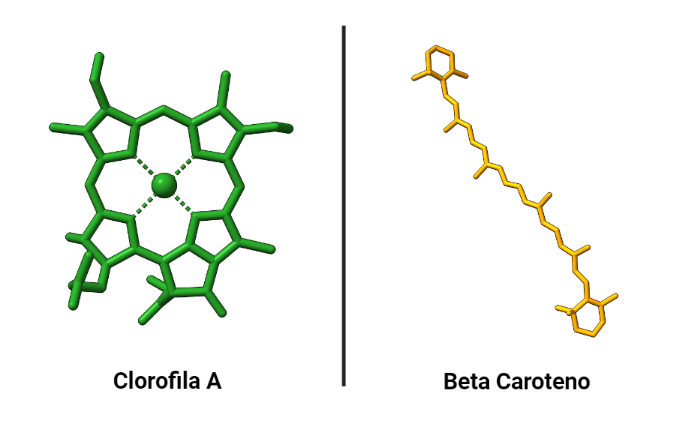
Los pigmentos más importantes de los fotosistemas son las clorofilas (clorofilas a y b) que le otorgan su caracteristico color verde; aunque encontramos también pigmentos secundarios como los carotenoides como β-caroteno (de color rojo), xantofilas (de color amarillo), etc. Éstos absorben luz de longitud de onda diferente a las clorofilas (lo que a su vez explica su distinta coloración).
Complejo Central:
El complejo central es la localización de la gran mayoría de moléculas de pigmento, que se encuentran formando una red de pigmentos antena que absorben la energía de la luz y la transfieren al centro de reacción.
Está compuesto por 14 subunidades, de las cuales PsaA y PsaB son las que se unen al complejo de reacción P700; es decir, las dos moléculas especiales de clorofila a del centro de reacción se sitúan en el heterodímero PsaAB.
Además del par especial, el dímero PsaAB contiene una serie de portadores electrónicos individuales: A0 , A1 y Fx . A0 es una molécula específica de clorofila a que acepta un electrón energizado de P700 y lo transfiere a A1 , que ya se identificó como una filoquinona (vitamina K1). Luego, el electrón se transfiere de A1 a una serie de centros de hierro-azufre (Fx , FA y FB ).
Este proceso lo volveremos a mencionar de nuevo cuando desarrollemos el centro de reacción P700, y de manera muy breve en la fotofosforilación acíclica.
Complejo LHC (Light Harvesting Complex):
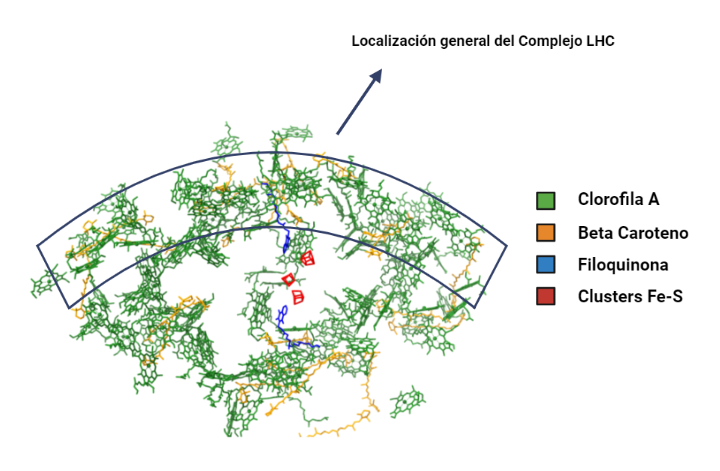
Además de las clorofilas presentes en el interior del complejo central, el fotosistema está equipado con un sistema antena periférico, que consiste en un conjunto de proteínas y pigmentos fotosintéticos adicionales que contribuyen a la absorción eficiente del espectro visible de la luz y transfiere energía al centro de reacción.
A nivel estructural, este complejo está conformado por cuatro subunidades que se repiten, denominadas LHCa 1-4, que son polipéptidos que se unen al cuerpo central del fotosistema por los pigmentos de éste y se disponen formando como una media luna.
Centro de reacción P700:
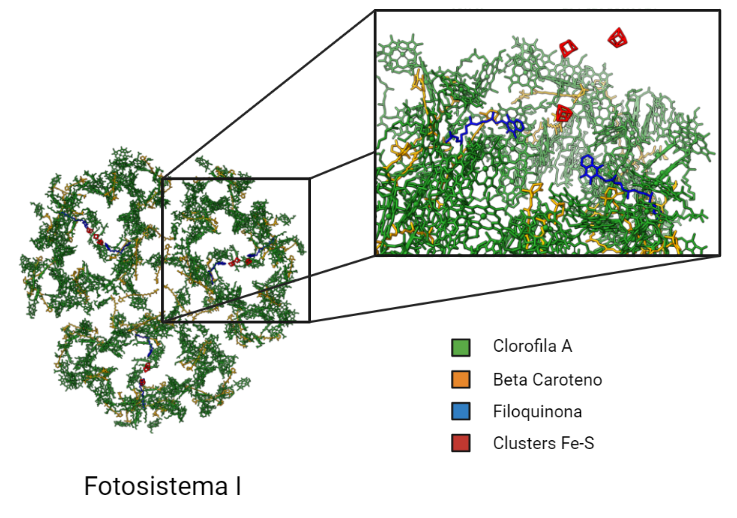
Denominado así porque capta la luz cuya longitud de onda es menor o igual a 700 nanómetros, está constituido por un par de moléculas de clorofila a que se excitan cuando la energía procedente de los pigmentos antena llegan a ellas.
Cuando esto ocurre, tiene lugar la formación de un estado excitado extremadamente reductor, P700*. Al tener un potencial electroquímico tan negativo (aprox. -1.4 V), es capaz de transferir electrones a través de una cadena de transportadores compuesta por los portadores del dímero PsaAB( A0 , A1 y Fx).
A0 transfiere un electrón a una molécula de filoquinona (Qk o vitamina K1), provocando que ésta se reduzca y forme quinol, que se reoxida transfiriendo el electrón a una cadena de centros hierro-azufre (Fe-S). Al final éste electrón es cedido a la ferredoxina, una pequeña proteína con hierro-azufre externo al complejo PSI.
Este proceso de transferencia de electrones termina con la actuación de esta última molécula, que llevará a cabo la reducción del NADP+ a NADPH.
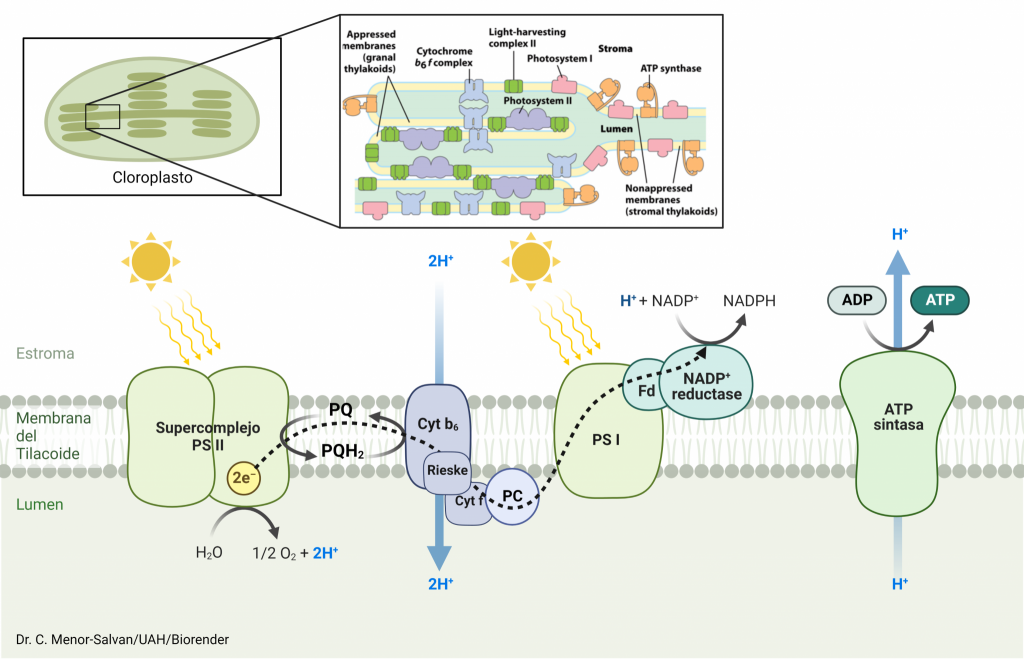
PROCESOS DE LA FOTOSÍNTESIS EN LOS QUE INTERVIENE PSI
Conocida la estructura y los procesos internos que se llevan a cabo en este complejo supramolecular, el cual es esencial para que se lleve a cabo la fotosíntesis oxigénica (dada en plantas superiores y algas verdes, entre otros organismos), pensamos: ¿cómo y cuándo interviene PSI en la fotosíntesis?
El fotosistema I solamente interviene en la fase luminosa de la fotosíntesis. A su vez, dependiendo del tipo de fase luminosa que se lleve a cabo, el complejo actúa de diferente manera:
Fotofosforilación Acíclica
En este proceso interviene el fotosistema II acoplado al fotosistema I. No nos vamos a parar en la finalidad de este tipo de fotofosforilación, sino únicamente en la función realizada aquí por el complejo que estamos estudiando.
Cuando incide la luz sobre el PSI, los pigmentos antena de éste se excitan a un estado energético mayor y transmiten esa energía por resonancia hasta llegar al centro de reacción, que contiene un pigmento diana (la clorofila a P700), la cual pierde dos electrones. Estos electrones pasan por una cadena de cofactores: primero son transmitidos a la filoquinona, que queda totalmente reducida. Ésta va a entregar estos electrones a los diferentes complejos de hierro-azufre de forma escalonada, para que ellos los transfieran a la ferredoxina (el electrón se cede a la ferredoxina por el último centro Fe4S4), una pequeña enzima que cataliza la reducción del NADP+ para formar NADPH.
El pigmento diana recupera esos electrones perdidos (para llevar a cabo este proceso múltiples veces) por la plastocianina, que cede al fotosistema los dos electrones procedentes del citocromo b6f.
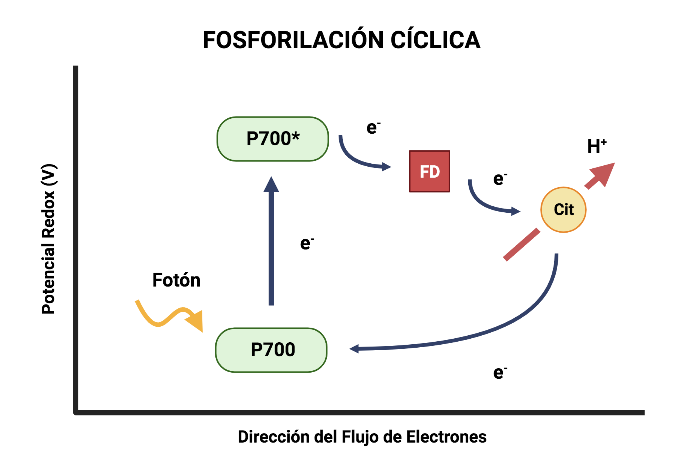
Fotofosforilación Cíclica
En este proceso solo interviene el PSI. Como no interviene el fotosistema II, únicamente se obtiene ATP del flujo de electrones y no se forman ni NADPH ni O2.
Se lleva a cabo de la siguiente manera: los electrones son elevados desde la clorofila P700 hasta el aceptor de electrones primario del fotosistema, pero no siguen la serie de portadores electrónicos que llevan al NADP+, sino que se desvían hacia la cadena de transporte de electrones que conecta a los fotosistemas I y II, y continúan cuesta abajo por esa cadena volviendo a la clorofila P700. En este recorrido se produce ATP.
El fotosistema I capta un fotón que permite la liberación de un electrón del centro de reacción P700, el cual es cedido a la clorofila A0, luego a la filoquinona (Q), y por último a la ferredoxina (Fd). Esta última molécula cede el electrón al complejo b6f, donde se produce suficiente energía para transportar los H+ en contra del gradiente electroquímico, y producir ATP como en la fotofosforilación acíclica. El complejo b6f cede los electrones a la plastocianina, que los lleva hasta el hueco dejado en el P700, para que puedan volver a ser excitados por un fotón y reiniciar la fotofosforilación cíclica.
IMPLICACIONES BIOTECNOLÓGICAS
En el mundo moderno hay una gran necesidad de nuevas formas de nuevas fuentes energéticas de orígenes limpios y renovables. Uno de los métodos más comunes es la utilización de la luz solar, que produce 175.000 TJ (terajulios) de energía fotónica al año, por medio de paneles solares. Sin embargo, estos tienen otros efectos medioambientales, pues la obtención de los materiales necesarios para producirlos es muy contaminante.

Una alternativa que está en desarrollo es la utilización de procesos fotosintéticos para obtener energía, para lo cual las propiedades del Fotosistema I son muy útiles. No sólo presenta capacidad de producir gran poder reductor (el mayor que se puede encontrar en la naturaleza); sino también se puede encontrar en grandes cantidades, es fácil de purificar y no es tóxico en ninguna manera. Además, debido a la diversidad de especies fotosintéticas, algunas presentan variaciones del Fotosistema I con diferentes propiedades que pueden ser beneficiosas. Por ejemplo, el Fotosistema I de T. elongatus es muy termoestable.
Sin embargo, existen problemas a la hora de utilizar FSI en producción energética. Pese a que su eficiencia ha estado aumentando continuamente, esta es aún relativamente pequeña comparada a la de métodos fotovoltaicos tradicionales. Esto se debe a factores propios del FSI, como su limitación en el espectro de luz que puede absorber o la poca superficie que cubre de los electrodos, pero también a que es una rama de investigación relativamente reciente y poco desarrollada.
Aún así, cabe esperar que con el tiempo la utilización del fotosistema I será más y más viable conforme se perfeccione el proceso, permitiéndonos producir energía verdaderamente verde.
BIBLIOGRAFÍA
- Nelson, N. y Yocum, CF (2006). Estructura y función de los fotosistemas I y II. año Rev. Plant Biol. , 57 , 521-565.
- Fotosíntesis. McKee T, & McKee J.R.(Eds.), (2016). Bioquímica. Las bases moleculares de la vida,5e.McGrawHill.https://accessmedicina.mhmedical.com/Content.aspx?bookid=1960§ionid=148096471.
- Ho, Thi Thu Hoai, et al. «Photosystem I light-harvesting proteins regulate photosynthetic electron transfer and hydrogen production.» Plant Physiology 189.1 (2022): 329-343.
- Caffarri, Stefano, et al. «A comparison between plant photosystem I and photosystem II architecture and functioning.» Current Protein and Peptide Science 15.4 (2014): 296-331
- Amunts, Alexey, and Nathan Nelson. «Plant photosystem I design in the light of evolution.» Structure 17.5 (2009): 637-650.
- Yang, Huixia, et al. «Molecular mechanism of photosystem I assembly in oxygenic organisms.» Biochimica et Biophysica Acta (BBA)-Bioenergetics 1847.9 (2015): 838-848.
- Teodor, Alexandra H., and Barry D. Bruce. «Putting photosystem I to work: truly green energy.» Trends in biotechnology 38.12 (2020): 1329-1342.
- https://pdb101.rcsb.org/motm/22, consultado 20-12-2022.
- https://chemevol.web.uah.es/wp/estructuras-moleculares/el-fotosistema-i-y-los-colores-del-otono/. consultado el 10-01-2023.


