Por Claudia de Diego y Lucía Espinilla
Biología Sanitaria UAH
Introducción
Las enzimas son un tipo de biomoléculas, concretamente proteínas, cuya función en la célula es facilitar o realizar determinadas reacciones químicas. Por ello, son catalizadores biológicos, sintetizados por las células de los seres vivos, que se encargan de llevar a cabo reacciones metabólicas.
La luciferasa es una enzima del tipo oxidativa, la cual es empleada para la reacción metabólica denominada como bioluminiscencia. El sustrato de esta enzima es el que se conoce como luciferina.
La bioluminiscencia es un proceso que se da en algunos organismos vivos, como lo son ciertos artrópodos, hongos y sobre todo organismos que viven en ecosistemas marinos y que lo emplean para ciertos fines biológicos.
En el proceso de la bioluminiscencia se produce una reacción química que genera luz, es decir, es un tipo de quimioluminiscencia. Sin embargo, dicha reacción solo se da en respuesta a distintos estímulos que no son permanentes y que tampoco provocan siempre la misma respuesta.
Papel biológico
Al estudiar los organismos habitantes en nuestro planeta, se han podido observar distintas especies tanto de animales, como de plantas, hongos y bacterias, los cuales presentan una capacidad muy peculiar basada en la producción y emisión de luz. A estos individuos tan excepcionales se les denomina bioluminiscentes.
Cabe destacar que la gran mayoría de estos organismos habitan en las profundidades de los océanos, en medio bentónico, y por ello ha resultado más complicado su estudio.
Aunque en algunos casos no se ha podido descifrar la funcionalidad de la bioluminiscencia e incluso pueda resultar que es un gasto de energía enorme que, a priori no merece la pena emplear para no recibir nada a cambio, la realidad es que siempre tiene una función específica.
Muchos organismos utilizan esta capacidad como medio de camuflaje, para su comunicación con otros individuos, como señal de alarma, con el fin de atraer individuos del género opuesto o, en el caso de algunos organismos depredadores, como anzuelo para cazar a sus presas.
Un ejemplo de especie que posee todas estas funciones, son las luciérnagas. Estos insectos presentan los órganos en los que se pueden producir las reacciones de bioluminiscencia en la parte baja del abdomen como se muestra en la imagen siguiente.

El caso del pez Melanocetus johnsoni, es uno de los organismos depredadores que utiliza su antena bioluminiscente para la captura del alimento. El extremo de su antena emite luz, la cual atrae a otros peces y facilita su ingesta.

En las luciérnagas la luz es emitida por su propio cuerpo. Por el contrario, en el caso de los peces abisales, la reacción se produce por medio de una simbiosis entre bacterias bioluminiscentes. Estos peces tienen una vesícula en la que se acumulan estas bacterias que llevarán a cabo dichas reacciones de bioluminiscencia.
Otro ejemplo de organismo bioluminiscente que llama mucho la atención por la gran luminosidad y el impactante color de esta, es Noctiluca scintillans. En algunas zonas del mar, en sitios como las Islas Maldivas, se observa la luz emitida por estos dinoflagelados.

Estructura
El color de la luz que es emitida por los organismos que emplean la luciferasa para la bioluminiscencia depende en gran medida de los aminoácidos que rodean la luciferina, y por lo tanto, de su estructura.
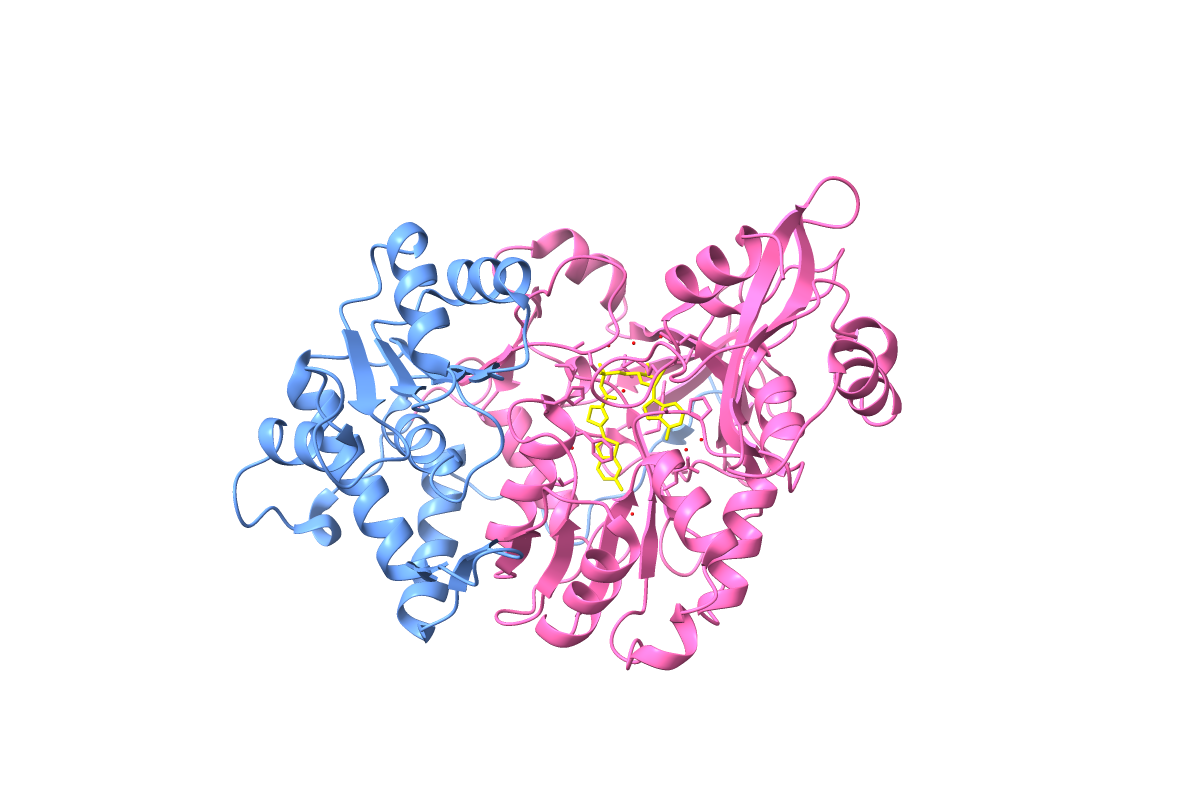
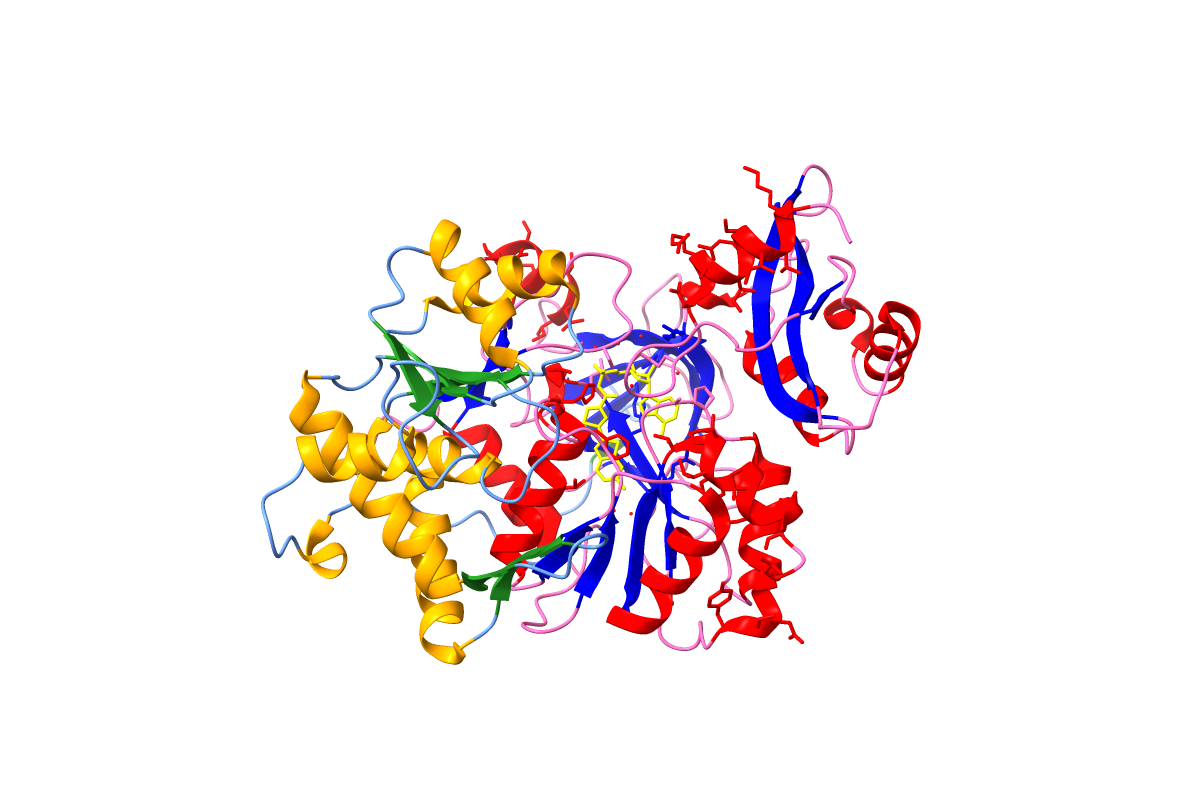
La estructura de esta proteína consiste en un plegamiento, que es único de la luciferasa, resultando en dos dominios: el dominio N-terminal y el dominio C-terminal.
En primer lugar, el dominio N-terminal es el que está representado mediante el color azul en la Figura 4 y consta de 7 láminas beta rodeadas por 7 hélices alfa.
Por otro lado, el dominio C-terminal es el representado por el color rosa en la Figura 4. Este consta de 17 láminas beta y 13 hélices alfa y se pliega en una estructura compacta que está conectada al dominio N-terminal mediante un bucle desordenado. Por lo tanto, este dominio es mucho más grande que el dominio descrito anteriormente.
Se propone que el centro activo se compone de residuos de las superficies de ambos dominios. Al unirse la enzima al sustrato, los dominios se mueven hasta quedar juntos y formar dicho centro activo.
Mecanismo
La creación de luz no es un proceso fácil para los organismos en los que es preciso su emisión. Además, debido a que no todas las luciferasas de los distintos organismos presentan exactamente la misma estructura primaria, se va a requerir de un pH distinto (no van a diferir en exceso) y también se van a ver diferencias en lo relacionado con algunos parámetros cinéticos. Aún observándose estas desigualdades, el esquema de la reacción será siempre el mismo.
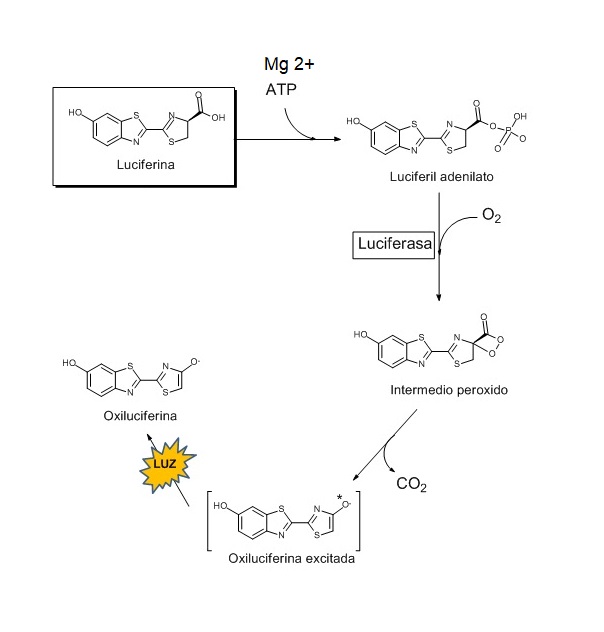
La reacción tiene lugar por pasos. En primer lugar, un catión de magnesio y ATP actúan sobre la luciferina para formar luciferil adenilato. Después, este compuesto se oxida por medio de la luciferasa para formar un intermedio peróxido.
Posteriormente, se produce una reacción de descarboxilación cuyo producto es un estado excitado de la oxiluciferina. Esta nueva forma de la proteína se tautomeriza entre la forma ceto y la forma enol. La reacción finalmente emite un fotón de luz cuando la oxiluciferina excitada vuelve a su estado fundamental.
Un único fotón de luz requiere aproximadamente la ruptura de ocho moléculas de ATP en el organismo del animal, es decir, que es necesario un gran aporte energético para que se produzca la reacción.
Por lo tanto, la luciferasa está implicada en una reacción muy energética del tipo oxidativa, para la cual además de ATP, se necesita oxígeno. Es por ello por lo que esta proteína está mayoritariamente presente en los peroxisomas de la célula, los cuales son los orgánulos responsables de llevar a cabo este tipo de reacciones dependientes de oxígeno.
Con este gasto de energía es posible consumir la luciferina, que es la forma genérica de denominar al sustrato que se oxida en la reacción mediante la catálisis de la enzima luciferasa.
Esta reacción libera luz, que puede ser de diferente color dependiendo del animal y de la composición química que tenga la luciferina.
Se sugiere que la luz emitida tiene un tono más rojo cuando la oxiluciferina utiliza su forma ceto. Sin embargo, cuando se encuentra en su forma enol, la luz que genera el animal es de un color más verdoso.
Es un proceso altamente eficiente en el ámbito energético, lo que significa que prácticamente toda la energía empleada en la reacción es transformada en luz.
Papel biomédico
Mediante la transferencia a un ser vivo del gen que se codifica para la síntesis de la luciferasa, se puede dotar a este de la capacidad de producir bioluminiscencia. Así, se han obtenido plantas, gusanos y hasta ratones bioluminiscentes. Pero este proceso no se hace sin un fin concreto, sino que hay un propósito importante para darle a un ratón la capacidad de brillar en la oscuridad.
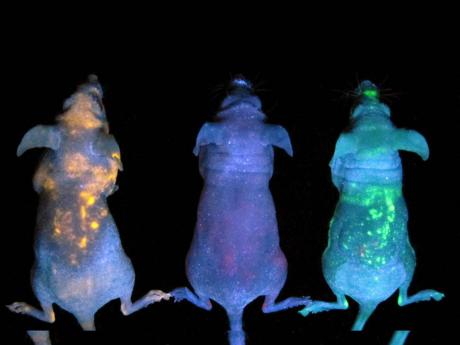
Se ha ideado un modo de usar la luciferasa para que se pueda rastrear la molécula biológica de la cual se quiera realizar el estudio, y emita una señal luminosa si está presente.
En biomedicina, a un animal transgénico que contenga un gen humano que exprese determinada proteína o esté ligado a una patología, se le puede introducir, adyacentemente, el gen de la luciferasa. De ese modo, las células que expresan el gen introducido también expresarán la luciferasa, brillarán en la oscuridad y será posible identificarlas a simple vista.
En biología y medicina, un ejemplo de esta aplicación, sería en el diagnóstico del cáncer, y de esta manera monitorear la proliferación de la metástasis y las respuestas de los tumores a los distintos tratamientos.
También sería aplicable a los procesos de infección viral, así como en el efecto de los fármacos sobre los virus.
Otro de los usos que se le puede dar a esta enzima es en el estudio de procesos patológicos en tejidos de mamíferos, para lo cual es preferible la bioluminiscencia roja debido a la baja absorción de la luz de las longitudes de onda más largas de la hemoglobina, la mioglobina y la melanina presentes en esos tejidos.
Cabe destacar que la bioluminiscencia de los organismos también va a ser de gran importancia en otros ámbitos. Por ejemplo, es también muy utilizada para la detección de contaminación medioambiental.
Bibliografía
Baldwin, T. O. (1996). Firefly luciferase: the structure is known, but the mystery remains. Structure, 4(3), 223–228. https://doi.org/10.1016/S0969-2126(96)00026-3
Contag, C. H., & Bachmann, M. H. (2002). Advances in In Vivo Bioluminescence Imaging of Gene Expression. Annual Review of Biomedical Engineering, 4(1), 235–260. https://doi.org/10.1146/annurev.bioeng.4.111901.093336
David Vargas Tejeda y Víctor Meza Carmen. (s.f.). ¿Luz en las profundidades del océano? Un descubrimiento para la biomedicina. Saber Más, Revista de Divulgación.
de la Ciencia, N. (2015, julio 24). Usar la luz de las luciérnagas para diagnósticos médicos rápidos, fáciles y baratos. Noticias de la Ciencia.
Goodsell, D. S. (2006). Luciferase. RCSB Protein Data Bank. https://doi.org/10.2210/rcsb_pdb/mom_2006_6
Gould, S. J., & Subramani, S. (1988). Firefly luciferase as a tool in molecular and cell biology. Analytical Biochemistry, 175(1), 5–13. https://doi.org/10.1016/0003-2697(88)90353-3
Guadarrama Tenorio, D., Torres Ramos, D. L., & Aristil Sánchez, S. I. (2017). El Uso de la Proteína Luciferasa como una Alternativa para la Detección Oportuna de Cáncer.
Hakkila, K., Maksimow, M., Karp, M., & Virta, M. (2002). Reporter Genes lucFF, luxCDABE, gfp, and dsred Have Different Characteristics in Whole-Cell Bacterial Sensors. Analytical Biochemistry, 301(2), 235–242. https://doi.org/10.1006/ABIO.2001.5517
Hastings, J. W. (1996). Chemistries and colors of bioluminescent reactions: a review. Gene, 173(1), 5–11. https://doi.org/10.1016/0378-1119(95)00676-1
Ilyina, A. D., Cerda, F. R., Estrada, B. C., Dukhovich, A. F., Gaona, L. G. J., Garza, G. Y., & Rodríguez, M. J. (1998). Sistema Bioluminiscente Luciferina-Luciferasa de las Luciérnagas. Parte I: Propiedades Bioquímicas y Catalíticas de la Enzima Luciferasa. Journal of the Mexican Chemical Society, 42(3), 99-108.
Khan, F. (2021, 22 de septiembre). The Luciferase Reporter Assay: How it Works & Why You Should Use it. Bitesize Bio.
Menor Salvan, C. (2013, 19 de julio). La luciérnaga y la magia de los peróxidos. – Noticias de un Espía en el Laboratorio. Noticias de un Espía en el Laboratorio – Fotomicrografía y Divulgación en Astrobiología, Bioquímica y Ciencias de la Tierra.
Toro, V. (2022, 25 de febrero). ¿Cómo producen la luz los seres bioluminiscentes? El País.
Univision. (2018, 2 de abril). Bioluminiscencia: Linterna
Vázquez Tatay, M. E. (1997). Diseño y construcción de vectores con genes de luciferasa eucarióticos como sistema informador. Aspectos aplicados.


