ACE2: UN ALIADO DEL COVID
Por Beatriz Sendra y Nerea Villegas, Biología Sanitaria UAH.
1. INTRODUCCIÓN
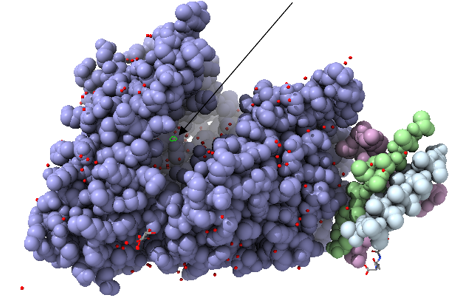
La ACE2 o enzima convertidora de angiotensina-2, es una carboxipeptidasa dependiente de zinc que se expresa en la membrana (Figura 1). Esta enzima tiene como principal función la participación en el sistema de renina-angiotensina, inhibiendo la angiotensina II por vía zimógeno que ha sido previamente activada por la ACE, provocando entre otras cosas, la bajada presión arterial. (24)
Se trata de una proteína que se encuentra integrada en la membrana plasmática (22) y se expresa en numerosos tipos celulares, entre los que cabe destacan los endotelios del corazón y vasos sanguíneos (sistema cardiovascular), las células epiteliales de los pulmones y la superficie de las células del riñón (9, 17, 27). Esta amplia distribución puede ser causa de la gran especificidad de sustrato que tiene la ACE2 y le permite participar en muchas rutas peptídicas (24).
Además de su función en el sistema de renina-angiotensina, la ACE2 funciona también como facilitador del transporte de aminoácidos y tiene un papel importante en la recepción del síndrome respiratorio agudo severo (SARS-CoV-2).
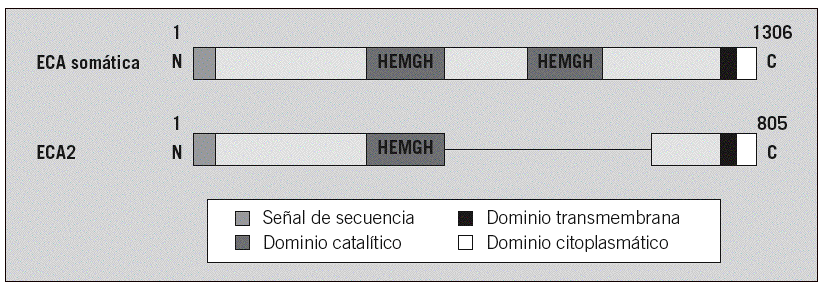
El descubrimiento de la ACE2 ha sido reciente, hace apenas 20 años y fue posterior al descubrimiento de la ACE, a pesar de la gran correlación que existe en la actividad de ambas en el sistema de renina-angiotensina (6, 24). La ACE2 fue el primer homólogo de la ACE (4, 22). (Figura 2)
Este trabajo se centra en las funciones del ACE2 y en la relevancia que tiene en relación al COVID. Para ello, se ha estructurado en 5 grandes secciones. La Sección 2 está dedicada a la estructura y mecanismos de la catálisis de la ACE2. La Sección 3 se centra en las principales funciones de esta proteína. Seguidamente, en la Sección 4 se comentan las implicaciones biomédicas fundamentales. En la Sección 5 se resumen algunas de las conclusiones más importantes. Se termina el trabajo con la relación de referencias que se han consultado, y en las que esencialmente nos hemos basado, para el desarrollo del contenido.
2. ESTRUCTURA Y MECANISMOS
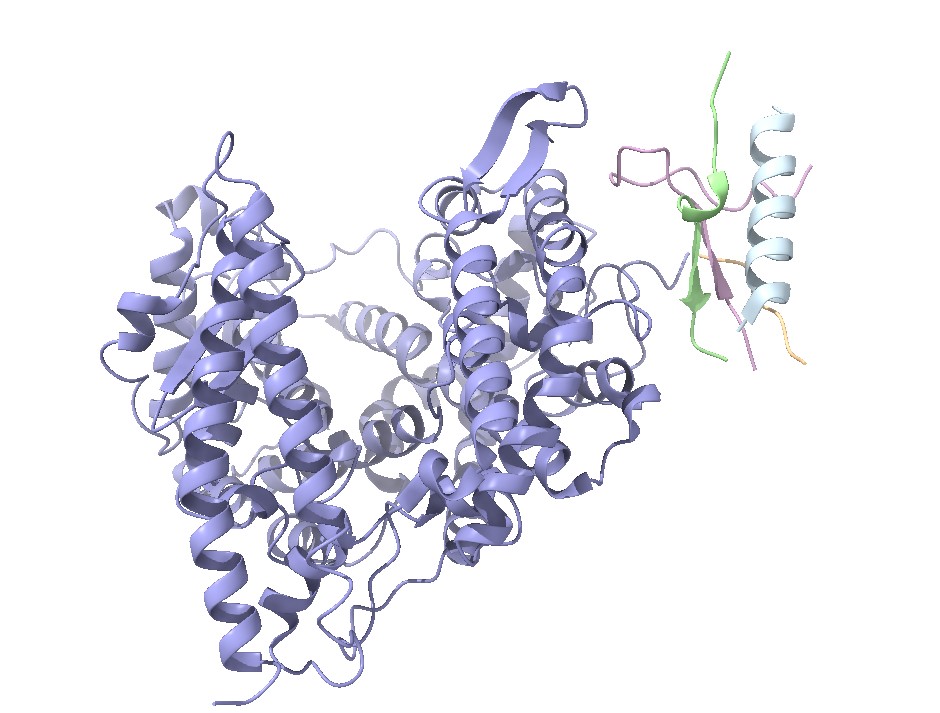
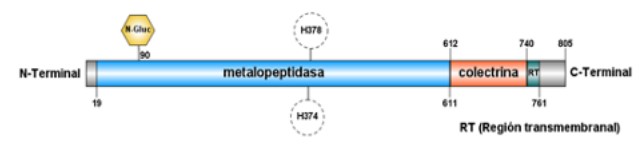
Como ya se ha comentado en la introducción, la ACE2 es una proteína transmembrana que atraviesa una sola vez la membrana (unipaso), y que está compuesta por 805 residuos de aminoácidos. Tiene tres dominios principales: extracelular, transmembrana e intracelular. El dominio extracelular esta formados por dos dominios: el dominio metalopeptidasa y el dominio de colectrina. (Figura 3)
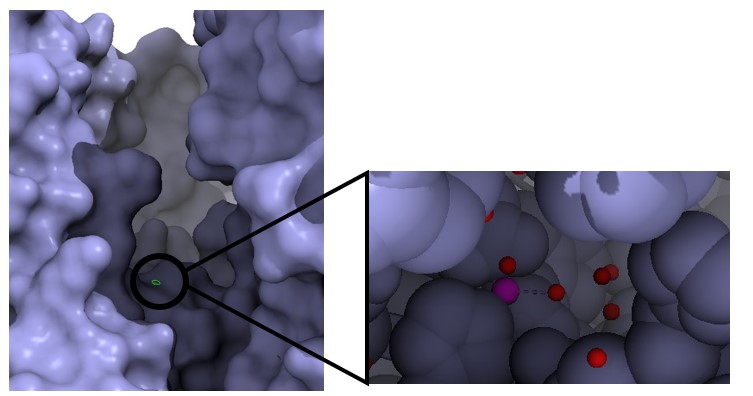
El dominio metalopeptidasa se localiza en el extremo N-terminal y está formada principalmente por estructuras de alfa-hélice, aunque también contiene algunas beta-láminas. Además, es el que más glicosilaciones sufre durante su postraducción. Es en este dominio donde se une el cofactor Zn, el cual participa en la catálisis de la proteína. Los residuos de unión a este cofactor forman la secuencia consenso de la proteínas y se corresponde con HEXXH siendo H histonas, E glutamina y X cualquier aminoácido con carga. Esta secuencia consenso es común en todas las metalopeptidasa de la familia M2. (23)
Por otro lado, encontramos el dominio colectrina más cercano al extremo C-terminal el cual está compuesto por beta-láminas. Es en este dominio donde se encuentra el sitio de unión del virus SARS-CoV-2. Además, seguido de él se encuentra el dominio transmembrana constituido mayoritariamente por estructura de alfa-hélice. Este dominio transmembrana es el que menos residuos abarca de todos pues únicamente los aminoácidos situados entre las posiciones 741-761 atraviesan la membrana. (2, 12, 14) (Figura4)
El último dominio, el dominio intracelular, se encuentra en el extremo C-terminal y contiene varios motivos lineales, como motivos de señal que interaccionan con proteínas con importante participación en vías de endocitosis y autofagia. (2)
El centro activo de esta proteína se encuentra en el dominio extracelular metalopeptidasa y es en él donde se encuentra el sitio de unión del zinc. (Figura 5)
Las principales modificaciones postraduccionales son las N-glicosilaciones en las asparaginas. Una de esas glicosilaciones, en concreto la de la asparagina 90, puede reducir la infección por SARS-CoV-2. Además, para mantener estable la estructura, se forman puentes disulfuro entre cisteínas. (14)
En cuanto a las isoformas, la ACE 2 tiene dos. Una de ellas no es funcional como carboxipeptidasa mientras que la otra no es funcional como receptor del coronavirus.
La ACE2 presenta una actividad catalítica que se caracteriza por tener un pH de trabajo óptimo de 6,5 y además ser potenciado por la presencia de aniones monovalentes, lo que la relaciona con la actividad de la ACE. Los aniones monovalentes que potencian la actividad de la ACE2 son el anión cloruro(Cl-)y fluoruro (F-), ambos aumentan la actividad de la ACE2 como unas 10 veces. En cambio, existen otros aniones monovalentes como el anión bromuro, que no afectan a la actividad de la proteína.
La actividad proteolítica ya mencionada consiste únicamente en la eliminación del extremo C-terminal (residuo), y es por ello que se dice que es una carboxipeptidasa. La actividad proteolítica de la hidrólisis de péptidos no tiene la misma eficiencia catalítica con todos los péptidos por igual. Uno de los sustratos con los que tiene más afinidad es con la angiotensina II, integrante del sistema de renina-angiotensina. (25)
3. FUNCIONES
La ACE2 realiza una gran variedad de funciones. Sin embargo, las más importantes se pueden resumir en tres : la participación en el sistema renina-angiotensina; la recepción del SARS-Cov2 y el transporte de aminoácidos.
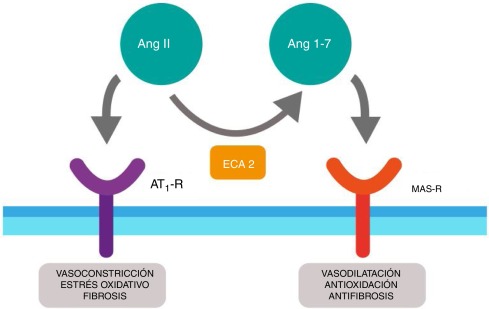
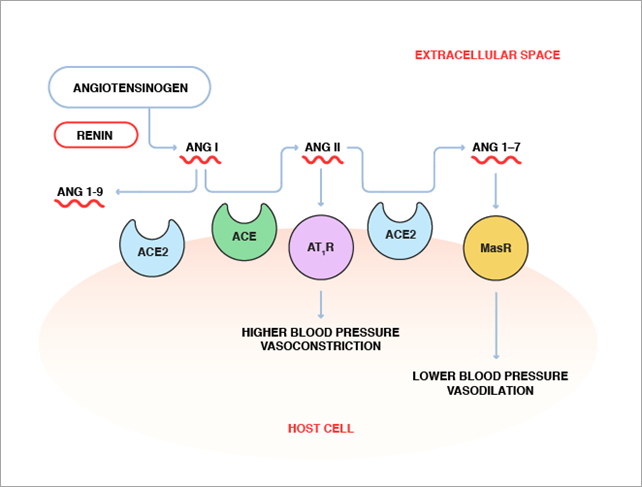
En primer lugar, la ACE2 tiene como principal función su participación en el sistema renina-angiotensina. Se trata de un conjunto de reacciones llevadas a cabo en la sangre que tienen una relevancia muy importante en el equilibrio de la homeostasis y regulación de la presión arterial. (Figura 6)
El sustrato angiotensinógeno es un zimógeno liberado a la circulación del hígado que es activado y transformado por la enzima renina a la angiotensina I. La renina es secretada por unas células de los glomérulos de los riñones cuando se reduce el flujo sanguíneo renal. La angiotensina I es cortada por la ACE en la superficie endotelial de los vasos sanguíneos dando lugar a la angiotensina II. Este paso puede ser inhibido por el fármaco IECA debido a que es un inhibidor de la ACE. En condiciones normales, la angiotensina II, interacciona con el receptor AT-1, estimulando una serie de reacciones intercelulares de vías de señalización que desencadenan una serie de respuestas celulares entre las que destacan el aumento de la presión arterial, inflamación y fibrosis. Este paso puede ser inhibido por la ARA-II ya que esta molécula es un inhibidor de la angiotensina 2.
Sin embargo, los efectos que causa la angiotensina II necesitan ser regulados y es por eso que el sistema cuenta con otra vía que provoca efectos contrarios, que pueden ser inducidos cuando se bloquea el receptor AT-1 por la acción de la ARB. En esta vía interviene la ACE2, desactivando y degradando la angiotensina II en angiotensina (1-7), que va a ser reconocida por el receptor MAS, provocando una serie de reacciones intercelulares que desarrollaran un conjunto de respuestas celulares con efecto contrario a las producidas por la vía AT1, como la bajada de la presión arterial, antiinflamación y antifibrosis (Figura 7)
La ACE2 puede degradar también la Angiotensina I a angiotensina (1-9) (el cual a su vez es transformado en angiotensina (1-7) por la ACE), pero la eficiencia catalítica de esta degradación es muy inferior que la que tiene con la degradación de la angiotensina II. (2, 20)
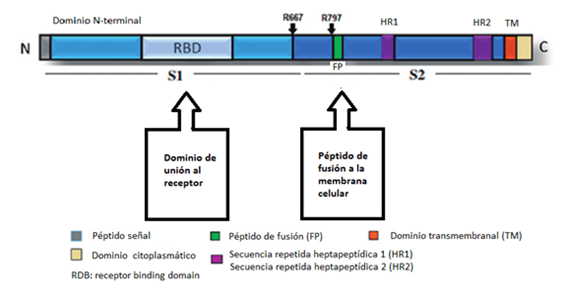
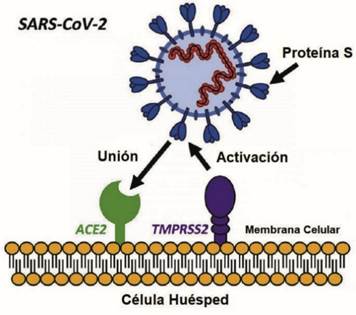
En segundo lugar, funciona como receptor del SARS-CoV2 y también del SARS-CoV. Como cualquier otro virus, necesita de la maquinaria de la célula para poder reproducirse y por ello necesitan entrar a la célula. En el caso del SARS-CoV2, ingresa en la célula usando ACE2 como receptor. La ACE2, detecta un dominio de unión al receptor (RBD) que contiene al que se une a través de su dominio del extremo C-terminal (región del dominio extracelular), formándose el complejo RBD-ACE2 (28). Así es como interacciona la espícula del virus con la ACE2.
La proteína de la que proviene la espícula S del SARS-COV-2 consta de dos subunidades. En la primera (S1) se localiza el dominio RBD previamente mencionado que está relacionado con la unión al dominio receptor de la ACE2, y el reconocimiento de virus. La segunda subunidad (S2) está relacionada con la fusión de las membranas, la del virus con la de la célula diana. (Figura 8)
La entrada del virus a la célula huésped se da gracias a la interacción de la proteína S de la espícula del virus y la ACE2 y está regulada por la proteína TMPRSS2. Esta actúa como una proteasa cuando el virus se une a la ACE2. Lo que hace es cortar en un par de puntos concretos de la S2 de la espícula, de forma que se produce la fusión de las membranas, promoviendo la entrada del virus a la célula. (13, 16) (Figura 9)
La gran afinidad que tiene la unión de la espícula con el dominio extracelular de la ACE2, junto a la intervención de la proteína TMPRSS2, provoca la fusión del virus con la membrana y la entrada de éste por endocitosis. Una vez dentro, el virus libera su material genético para su respectiva replicación. El uso de la ACE2 por parte del virus hace que la ACE2 pierda su función. Por ello, la ACE2 no podrá degradar la Angiotensina II en angiotensina (1-7). Esto desencadenará, entre otras cosas, daño pulmonar vinculado con la enfermedad de la COVID-19 (21).
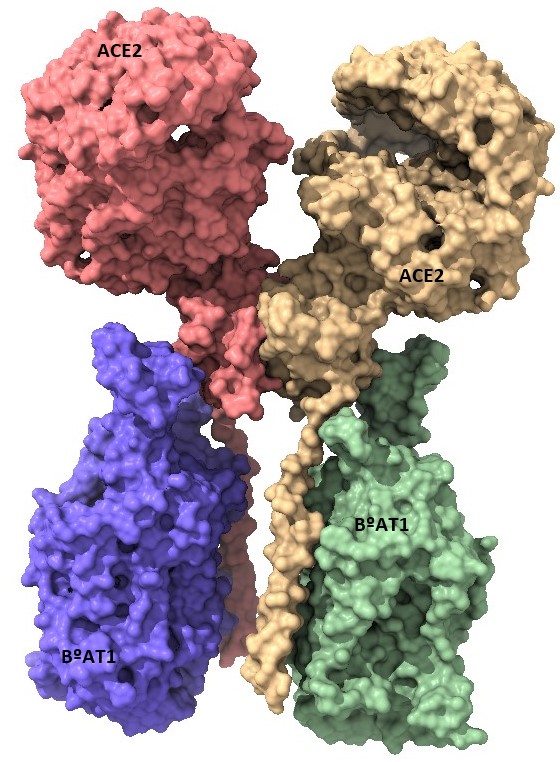
Por último, la ACE2, aunque en menor medida, se expresa también en el tracto gastrointestinal particularmente en los enterocitos absorbentes del íleon y el colon (15). Es por ello que, la ACE2 esta también implicada en el transporte de aminoácidos neutros del lumen intestinal al interior celular. Sin embargo, este transporte solo lo lleva acabo asociada al transportador de aminoácidos neutros dependiente de sodio (B 0 AT1) (10). (Figura 10)
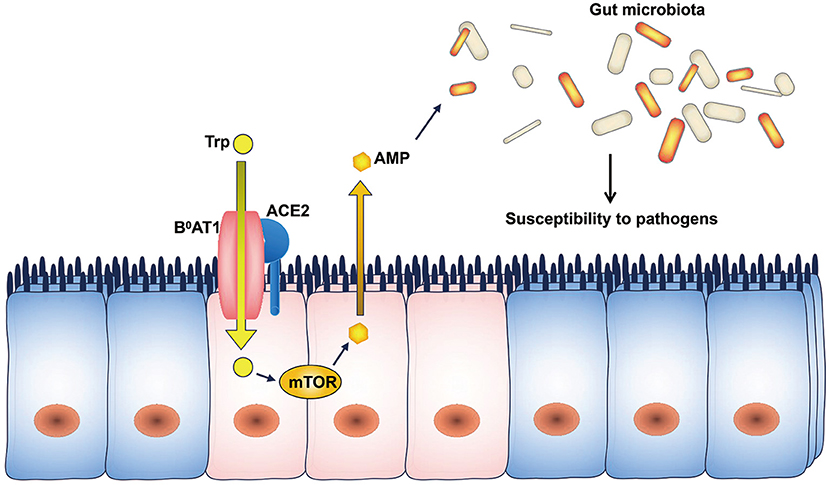
La razón de esta función es que esta proteína surgió por duplicación y fusión de genes siendo homóloga de ACE en el dominio catalítico y de colectrina en el dominio proximal de membrana. La colectrina es una proteína que se expresa en las células del riñón y que unida a B 0 AT1 actúa como transportador de aminoácidos. El problema es que esta proteína no es expresa en las células intestinales y por ello, es la ACE2 unida por su dominio colectrina a B 0 AT1 la que lleva a cabo esa función (10).
El complejo ACE2- B 0 AT1 se ensambla en forma de heterodímero, uniéndose el transportador al dominio colectrina de la ACE2. Sin embargo, el transporte de aminoácidos es solamente activo cuando se une dos heterodímeros del complejo anterior (2). (Figura 11)
Uno de los aminoácidos más importante absorbidos por el complejo ACE2- B 0 AT1 es el triptófano. Se trata de un aminoácido esencial que incorporamos con nuestra dieta y cuyo metabolismo regula la flora intestinal (10).
4. IMPLICACIONES BIOMÉDICAS
El sistema de la ACE2 protege contra infartos miocardios, la hipertensión, la diabetes… . Pero si la ACE2 interacciona con el SARS-COV-2, queda inactiva de su función principal, provocando un mayor riesgo de sufrir dichos problemas (6).
Dentro de los dos coronavirus (SARS-COV-1 y SARS-COV-2) ha existido una diferencia en cuanto a la gravedad que se ha producido de forma general entre las personas que han sufrido un tipo u otro. Aunque tanto la evolución del SARS-COV-1 como del SARS-COV-2 está bastante relacionada, el dominio de unión con el receptor (RBD) de uno y otro es distinto. La diferencia radica en una serie de residuos de aminoácidos que son esenciales para la interacción de la espícula que aportan una mayor afinidad con la ACE2 (2). Dentro de la alteración de dichos residuos, la más destacada es una sustitución de una Valina (SARS-COV-1) por una Lisina (SARS-COV-2) (14). Esta diferencia de residuos en los dominios de unión al receptor hace que la afinidad que tienen cada virus por el receptor ACE2 cambie, y esto demuestra la diferencia de patogenicidad de un virus y otro (6, 16).
Dentro del SARS-COV-2, tampoco ha sido la misma la gravedad del virus en todas las personas. Una mayor o menor infección causada por el virus se ha podido ver determinada por numerosos aspectos, algunos de los cuales se comentan a continuación.
Por un lado, aquellos pacientes con una enfermedad cardiovascular pueden haber sufrido una enfermedad causada por el SARS-COV-2 mucho más severa ya que dicha enfermedad cardiovascular podría estar asociada con una mayor presencia de ACE2, lo que va a promover a niveles superiores la recepción del virus, y con ello una mayor gravedad de la enfermedad. Además, en estos casos se podrá desarrollar linfopenia (escasez de glóbulos blancos en la sangre) o también linfopenia acompañada de inmunosupresión, lo que va a provocar que la enfermedad sea aún más grave. Asimismo, se podrán sufrir también por estas consecuencias, aunque es algo independiente de contraer el virus, infecciones bacterianas entre otras (3). El ejemplo más claro de enfermedad cardiovascular de riesgo frente al coronavirus es la hipertensión. Los pacientes hipertensos regulan su presión arterial a través de fármacos como IECA, un inhibidores de ACE o ARA-2, un inhibidor de angiotensina 2. Estos fármacos son los responsable de un aumento de la expresión de ACE2 en las células, lo que provoca una mayor entrada del virus y gravedad de la infección (19).
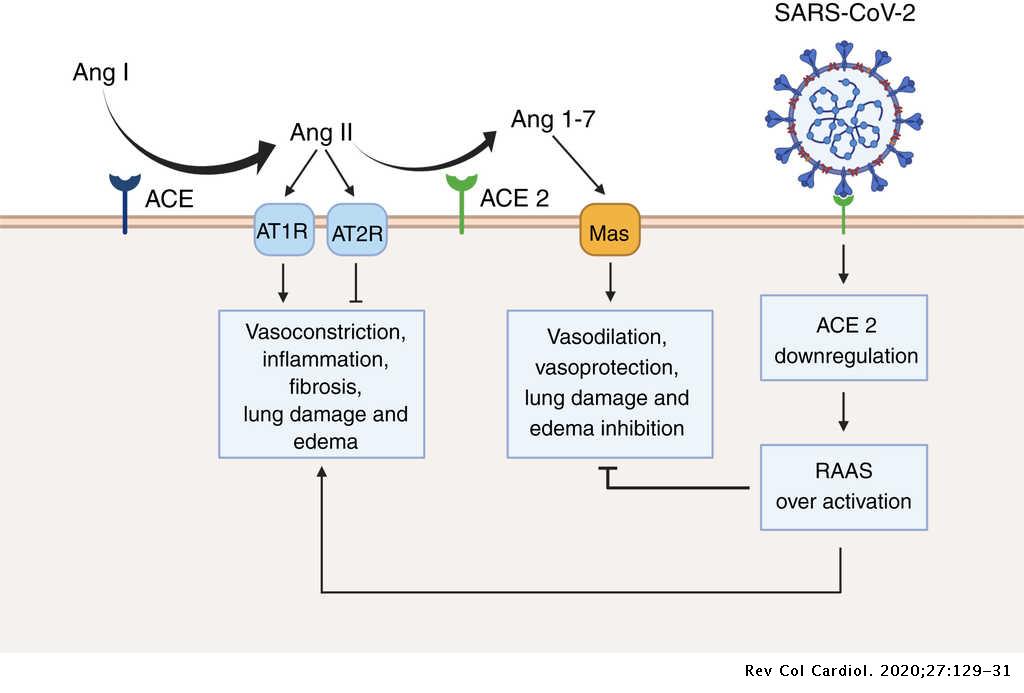
Además, la unión de SARS-COV-2 con ACE2 desregula el sistema angiotensina-renina al inhibir la función de esta proteína en el sistema e impedir que la angiotensina 2 se transforme en angiotensina (1-7). Esta inhibición deriva en una aumento de la angiotensina 2 en aquellos tejidos infectados por el coronavirus lo que se traduce, entre varias consecuencias, en un aumento de la presión arterial que en los pacientes hipertensos puede traer consecuencias letales (7). (Figura 12)
Por otro lado, la diferencia en la tasa de letalidad también puede explicarse por la posibilidad que tiene el SARS-COV-2 de recombinarse activamente, pudiendo generar variantes de sí mismo a la misma vez que está infectando al huésped. Alguna de las variantes pueden ser más patógenas que otras.
Otro determinante en la virulencia del SARS-COV-2 son los factores genéticos , clínicos y medioambientales. Por ejemplo, a edad avanzada, existe una mayor probabilidad de sufrir el virus con mayor gravedad (3).
Por otra parte, en (18) se realiza un estudio que determina la que puede ser la causa de que algunos hombres sufren la enfermedad con mayor infecciosidad que las algunas mujeres. Sin embargo, no se ha visto una gran diferencia en la cantidad de ACE2 en mujeres y hombres sin la enfermedad. No obstante, en caso de tener enfermedades como la hipertensión o insuficiencia cardíaca, sí que aumenta la cantidad de niveles séricos de ACE2. Además, este aumento es mayor en los hombres que en las mujeres, posiblemente a causa de la presencia de determinadas hormonas sexuales. Esta mayor expresión de ACE2 en los hombres puede ser la causa por la que, en algunas ocasiones, la patogenicidad del virus es mayor en hombres. No obstante, esta es una hipótesis que sigue siendo estudiada. (18)
Una vez comentados algunos aspectos relacionados con el grado de gravedad de la enfermedad en distintos colectivos, a continuación nos centramos más efectos y consecuencias que pueden derivarse de la enfermedad.
Como se ha mencionado anteriormente, la ACE2 puede encontrarse en células del tracto gastrointestinal. Por lo tanto, no es sorprendente que el sistema digestivo presente un riesgo de ser infectado por COVID provocando síntomas digestivos como diarrea, náuseas, vómitos o disminución del apetito. En el estudio realizado en (5) a pacientes infectados por SARS-CoV-2, se observó que los que presentaban estos síntomas (además de los síntomas más habituales como fiebre o tos) eran los pacientes de mayor gravedad , mientras que los casos más leves se correspondían con los síntomas más habituales.
Cabe señalar las siguiente posibles explicaciones de la aparición de estos síntomas digestivos. En el caso de las células intestinales infectadas por COVID, las ACE2 de estas pierden su función de transportador de aminoácidos al no poderse unir la proteína BºAT1 a esta. De esta forma, la absorción de aminoácidos se desregula provocando infección intestinal. En el caso del triptófano, su incorrecta absorción es lo que provoca en los pacientes de COVID la colitis grave. (10) (Figura 13)
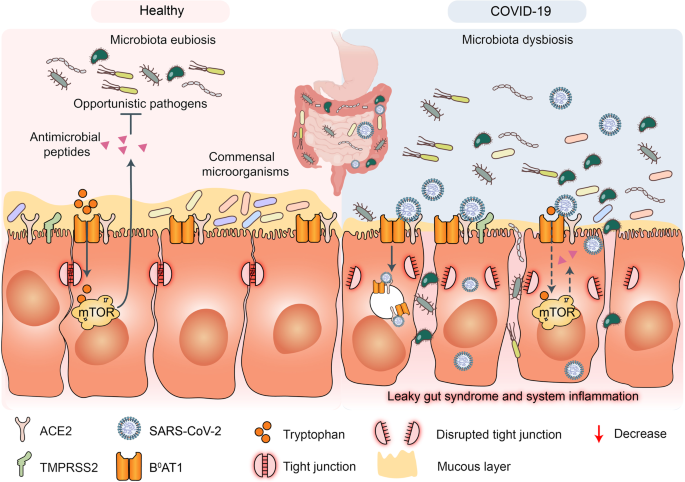
La inactividad de transporte de aminoácidos puede resultar también en una disminución de péptidos antimicrobianos y, en consecuencia, en una alteración de la flora intestinal provocando inflamación. La flora intestinal se ha encontrado alterada en algunos pacientes con COVID-19, como una disminución de la bacteria Lactobacillus. Además, diversos estudios , entre los que cabe mencionar (19), revelaron que ACE2 también se encuentra en las células epiteliales del esófago, lo que explicaría la esofagitis causada por COVID-19 (15).
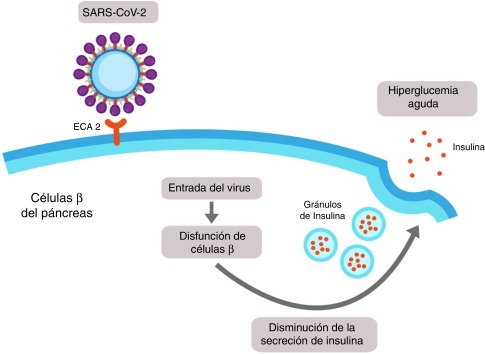
Por otro lado, se ha encontrado una relación entre el SARS-COV-2 y la hiperglucemia, que está relacionada con la mayor o menor expresión de la ACE2.
Además de en las células alveolares, la ACE2 puede encontrarse expresada en las células del páncreas, concretamente en las de los islotes. El SARS-COV-2 normalmente se une a las ACE2 de las membranas de las células alveolares pero si hay una elevada expresión de ACE2 en el páncreas, el SARS-COV-2 podrá usarlos para entrar en las células del páncreas. Ingresará en dichas células provocando una disminución de producción y secreción de insulina, dando lugar finalmente a una hiperglucemia aguda. (Figura 14)
Para finalizar, queremos comentar que una posible solución podría ser la metformina, ya que activa la AMPK, que provoca la fosforilación de ACE2 de forma que la unión del SARS-COV-2 no sea tan efectiva. Por otro lado, indicar que todo aquello que pueda provocar que la expresión de la ACE2 aumente, será inadecuado para los pacientes diabéticos que contraigan el SARS-COV-2 como se puede leer en (13).
5. CONCLUSIÓN
En este trabajo, después de analizar algunas de las referencias más importantes sobre la ACE2, se ha visto que es una proteína transmembrana que requiere la presencia del cofactor zinc para funcionar como carboxipeptidasa. Asimismo, se observa que tiene un papel fundamental en el sistema de la renina-angiotensina, en el mecanismo de entrada del SARS-CoV-2 y en el transporte de aminoácidos. También, es una proteína relevante en el ámbito biomédico por su relación con la enfermedad del SARS-CoV-2, la hipertensión y la diabetes, entre otras patologías.
6. REFERENCIAS
(1). Bosso, M., Thanaraj, T. A., Abu-Farha, M., Alanbaei, M., Abubaker, J., & Al-Mulla, F. (2020). The two faces of ACE2: the role of ACE2 receptor and its polymorphisms in hypertension and COVID-19. Molecular Therapy-Methods & Clinical Development, 18, 321-327.
(2). Carrillo, C. J. A. (2021). La enzima convertidora de angiotensina 2 en hipertensión, diabetes y obesidad, y su participación en la vulnerabilidad ante el virus SARS-COV-2. Revista de Educación Bioquímica, 39(4), 121-130.
(3). de León, J. D. L. P., Cárdenas-Marín, P. A., Giraldo-González, G. C., & Herrera-Escandón, Á. (2020). Coronavirus–COVID 19: Más allá de la enfermedad pulmonar, qué es y qué sabemos del vínculo con el sistema cardiovascular. Revista Colombiana de cardiología, 27(3), 142-152.
(4). Donoghue M, Hsieh F, Baronas E, Godbout K, Gosselin M, Stagliano N, Donovan M, Woolf B, Robison K, Jeyaseelan R, Breitbart RE, Acton S. A novel angiotensin-converting enzyme-related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1-9. Circ Res. 2000 Sep 1;87(5):E1-9.
(5). Febres-Ramos, R. J. (2022). Características clínicas del sistema digestivo en COVID-19. Horizonte Médico (Lima), 22(3)
(6). Gheblawi, M., Wang, K., Viveiros, A., Nguyen, Q., Zhong, J. C., Turner, A. J., Raizada, M.K., Grant, M. B. & Oudit, G. Y. (2020). Angiotensin-converting enzyme 2: SARS-CoV-2 receptor and regulator of the renin-angiotensin system: celebrating the 20th anniversary of the discovery of ACE2. Circulation research, 126(10), 1456-1474.
(7). González, M. A. (2020). Bloqueadores del sistema renina-angiotensina: enemigos o amigos en pacientes con COVID-19. Revista Venezolana de Endocrinología y Metabolismo, 18(1), 1-3
(8). González-Rayas, J. M., Rayas-Gómez, A. L., García-González, J. J., González-Yáñez, J. M., Hernández-Hernández, J. A., & López-Sánchez, R. D. C. (2020). COVID-19, ACE-inhibitors and angiotensin receptor blockers: The need to differentiate between early infection and acute lung injury. Revista Colombiana de Cardiología, 27(3), 129-131.
(9). Hamming I, Timens W, Bulthuis MLC, Lely AT, Navis GJ, & van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A frst step in understanding SARS pathogenesis. J Pathol. 2004; 203(2): 631–7.
(10). Hashimoto T, Perlot T, Rehman A, Trichereau J, Ishiguro H, Paolino M, Sigl V, Hanada T, Hanada R, Lipinski S, Wild B, Camargo SM, Singer D, Richter A, Kuba K, Fukamizu A, Schreiber S, Clevers H, Verrey F, Rosenstiel P, Penninger JM. ACE2 links amino acid malnutrition to microbial ecology and intestinal inflammation. Nature. 2012 Jul 25;487(7408):477-81.
(11). He, Y., Wang, J., Li, F., & Shi, Y. (2020). Main clinical features of COVID-19 and potential prognostic and therapeutic value of the microbiota in SARS-CoV-2 infections. Frontiers in Microbiology, 11, 1302.
(12). Li W, Moore MJ, Vasilieva N, & Sui J. Angiotensinconverting enzyme 2 is a functional receptor for the SARS coronavirus. Nature. 2003; 426:450-4
(13). Lima-Martínez, M. M., Boada, C. C., Madera-Silva, M. D., Marín, W., & Contreras, M. (2021). COVID-19 y diabetes mellitus: una relación bidireccional. Clinica E Investigacion En Arteriosclerosis, 33(3), 151-157.
(14). Lubbe, L., Cozier, G. E., Oosthuizen, D., Acharya, K. R., & Sturrock, E. D. (2020). ACE2 and ACE: structure-based insights into mechanism, regulation and receptor recognition by SARS-CoV. Clinical Science, 134(21), 2851-2871.
(15). Ma, C., Cong, Y., & Zhang, H. (2020). COVID-19 y el sistema digestivo
(16). Pastrian-Soto, G. (2020). Presencia y expresión del receptor ACE2 (Target de SARS-CoV-2) en tejidos humanos y cavidad oral. Posibles rutas de infección en órganos orales. International journal of odontostomatology, 14(4), 501-507.
(17). Patel VB, Parajuli N, & Oudit GY. Role of angiotensin-converting enzyme 2 (ACE2) in diabetic cardiovascular complications. Clin. Sci. 2014; 126(7): 471–82.
(18). Salah, H. M., & Mehta, J. L. (2021). Hypothesis: sex-related differences in ACE2 activity may contribute to higher mortality in men versus women with COVID-19. Journal of Cardiovascular Pharmacology and Therapeutics, 26(2), 114-118.
(19). Salazar, M., Barochiner, J., Espeche, W., & Ennis, I. (2020). COVID-19, hipertensión y enfermedad cardiovascular. Hipertensión y riesgo vascular, 37(4), 176-180.
(20). Soler, M. J., Lloveras, J., & Batlle, D. (2008). Enzima conversiva de la angiotensina 2 y su papel emergente en la regulación del sistema renina-angiotensina. Medicina clinica, 131(6), 230-236.
(21). South, A. M., Diz, D. I., & Chappell, M. C. (2020). COVID-19, ACE2, and the cardiovascular consequences. American Journal of Physiology-Heart and Circulatory Physiology.
(22). Tipnis, S. R., Hooper, N. M., Hyde, R., Karran, E., Christie, G., & Turner, A. J. (2000). A human homolog of angiotensin-converting enzyme: cloning and functional expression as a captopril-insensitive carboxypeptidase. Journal of Biological Chemistry, 275(43), 33238-33243.
(23). Towler P, Staker B, Prasad SG, Menon S, Tang J, Parsons T, Ryan D, Fisher M, Williams D, Dales NA, Patane MA, Pantoliano MW. ACE2 X-ray structures reveal a large hinge-bending motion important for inhibitor binding and catalysis. J Biol Chem. 2004 Apr 23;279(17):17996-8007.
(24). Turner, A. J., & Nalivaeva, N. N. (2022). Angiotensin-converting enzyme 2 (ACE2): Two decades of revelations and re-evaluation. Peptides, 170766.
(25). Vickers C, Hales P, Kaushik V, Dick L, Gavin J, Tang J, Godbout K, Parsons T, Baronas E, Hsieh F, Acton S, Patane M, Nichols A, Tummino P. Hydrolysis of biological peptides by human angiotensin-converting enzyme-related carboxypeptidase. J Biol Chem. 2002 Apr 26;277(17):14838-43.
(26). Wang, B., Zhang, L., Wang, Y. et al. Alterations in microbiota of patients with COVID-19: potential mechanisms and therapeutic interventions. Sig Transduct Target Ther 7, 143 (2022).
(27). Xia H, & Lazartigues E. Angiotensin-converting enzyme 2: Central regulator for cardiovascular function. Curr Hypertens Rep. 2010; 12(3): 170–5.
(28). Yan, R., Zhang, Y., Li, Y., Xia, L., Guo, Y., & Zhou, Q. (2020). Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. Science, 367(6485), 1444-1448.
(29). Zhou Angela. ACE2: Targeting a Potentially Important Receptor in Disease Pathogenesis (2022). Disponible en este enlace.



[…] faltaba en las células HeLa. Otras formas de coronavirus utilizan una molécula, llamada ACE2, enzima convertidora de angiotensina-2, para ingresar a las células. Las partículas ACE2 rodean la superficie de algunas células […]