Por Lucía Rodríguez y Sonia Ramírez. 1º Biología Sanitaria, UAH
INTRODUCCIÓN
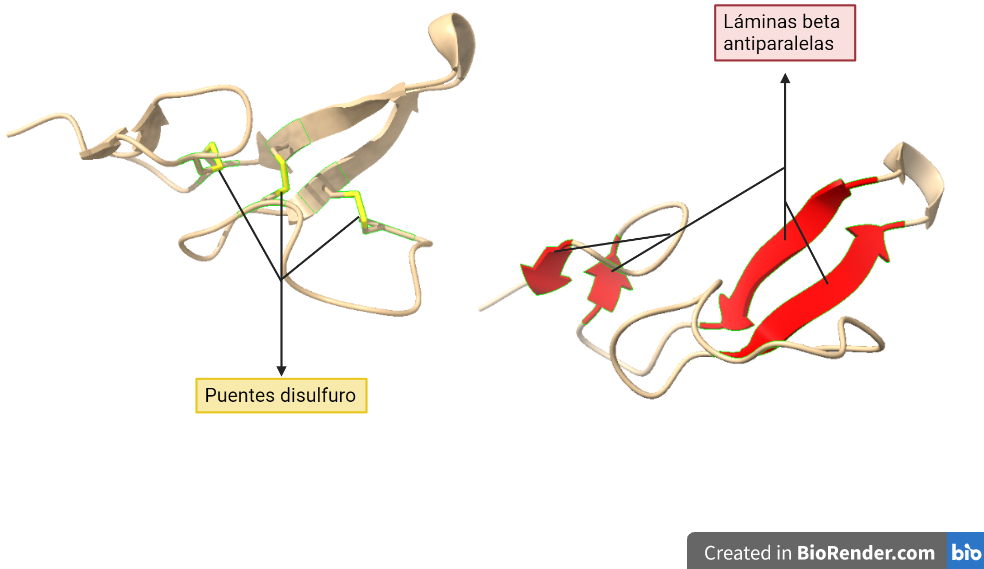
El factor de crecimiento epidérmico (EGF) es una proteína que activa o inactiva la proliferación celular en tejidos. Está compuesto por aminoácidos, entre los cuales destaca la cisteína al crear puentes disulfuro.
La importancia del EGF reside mayoritariamente en su receptor (EGFr), ya que al unirse inician una cascada de señales que desencadenan vías de crecimiento celular. Esto podría causar cáncer si se genera una mutación o incluso quistes renales provocando nefroptosis.
Sin embargo, es esencial para la regeneración cutánea tras una herida, y está presente en líquidos imprescindibles para el desarrollo embrionario y la supervivencia de nuestra especie.
ESTRUCTURA Y COMPOSICIÓN
El EGF, codificado en un gen del cromosoma 4, está compuesto de 53 aminoácidos y 6 residuos de cisteína, formando tres puentes disulfuro. Tiene un peso molecular de 6,2 KDa. Al unirse con los receptores, va a activar vías como las PI3K/AKT, RAS/ERK y JAK/STA.
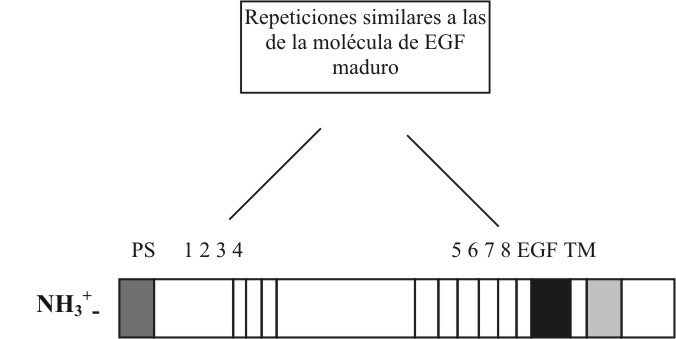
El EGF tiene un precursor, el cual posee secuencias parecidas a las del EGF maduro, las cuales tienen alrededor de 40 aminoácidos. El maduro solo va a formar el 5% del precursor.
25 aminoácidos, hidrófobos la mayoría, son los que tienen el dominio transmembrana, formando alfa-hélices. El dominio intracelular contiene la actividad tirosina-quinasa, llevando a cabo la transducción de señales de procesos bioquímicos.
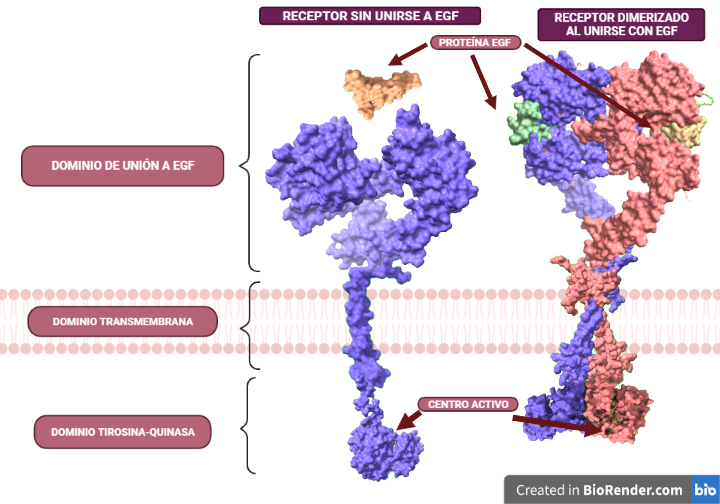
En cuanto al receptor del EGF, EGFR, se caracteriza por ser una glicoproteína con un dominio extracelular con un grupo amino, que es por donde se une el ligando. En esta región es donde hay tres dominios. Al unirse el receptor con el ligando, se va a dar la dimerización de los dos monómeros que posee. Si no está unido, se pliega sobre sí mismo.
En cuanto a los dominios, el del interior de la célula es el dominio quinasa. Después, posee el dominio transmembrana y por último, el dominio extracelular, que es el que se va a unir al ligando, a la proteína EGF.
PAPEL BIOLÓGICO
El factor de crecimiento epidérmico (EGF) se incluye dentro de la familia de proteínas que activan la proliferación celular. Es decir, que actúan sobre el crecimiento de las células epiteliales en los tejidos. Esta proteína promueve el crecimiento, la proliferación y la diferenciación celular gracias a la unión con su receptor, el receptor del factor de crecimiento epidérmico (EGFr).
En concreto, se encargan de la regulación del desarrollo de células cutáneas mediante la interacción con su receptor específico de membrana. Son sintetizadores transmembrana gracias a su estructura con hélices alfa; las cuales tienen una característica hidrófila que les permite acoplarse entre los lípidos de la membrana celular.
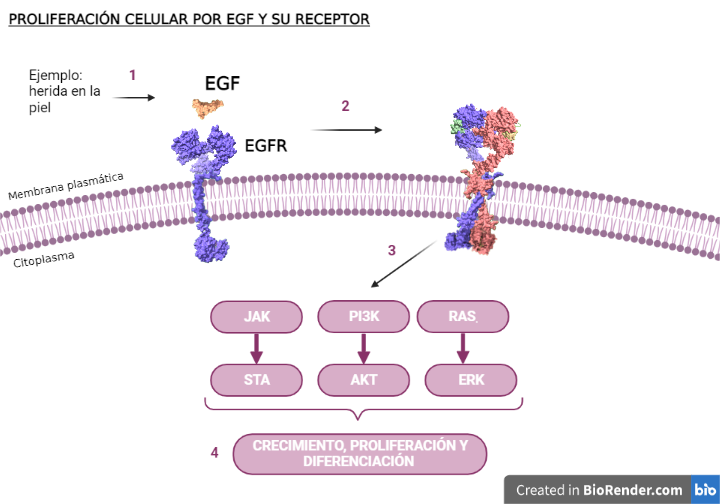
El método de acción de EGF se resume en los siguientes pasos:
- Nos hacemos una herida en la piel y se libera EGF.
- El EGF se une a su receptor de membrana (EGFr) mediante un cambio de conformación. Se produce su dimerización y se juntan sus dos extremos de arriba (unión a EGF), lo que causa que su cola (extremo tirosina-quinasa) en el citoplasma cambie por fosforilación.
- Se activa una cascada de señales que estimulan la activación de ciertas vías, dependiendo del lugar del cuerpo.
- Se produce la activación o inhibición de los factores de transcripción. Estos factores regulan la expresión de proteínas apoptóticas, tanto proapoptóticas como antiapoptóticas.
El EGF se encuentra en una gran variedad de fluidos corporales, como: la orina, la saliva, las lágrimas, el sudor, los jugos gástricos, las secreciones mamarias y el líquido amniótico. De hecho, el EGF es esencial para el desarrollo del embrión ya que actúa en la organogénesis de tejidos del mesodermo y ectodermo. Además, está implicado en la embriogénesis y en el desarrollo de ductos mamarios en la pubertad. Por lo que, podemos observar la amplia variedad de lugares en los que aparece esta proteína, aunque se suele encontrar diluida en un líquido.
Asimismo, se encuentra en las plaquetas y los macrófagos. Lo cual, explicaría la regeneración de la piel tras formarse una herida. Debido a esta característica, se estudió cómo actuaría en pieles más mayores y se observó una cualidad rejuvenecedora. Finalmente acabó como un elemento imprescindible de productos en el mercado del ámbito cosmético.
Del mismo modo, está altamente relacionado con el desarrollo tumoral ya que si no se regula la expresión del EGF puede producirse una proliferación descontrolada. Su receptor tirosina-quinasa es un proto oncogen viral que se encarga de interaccionar con el EGF. Si este receptor está mutado y su interacción no está bien regulada, se puede generar un cáncer patológico.
APLICACIONES BIOMÉDICAS
El EGFr se expresa en células normales en altas cantidades, pero en células tumorales, puede hacerlo hasta 20 veces más, pues se sobreexpresa. Esto lleva a que haya mayor proliferación y peor diagnóstico.
Por ejemplo, el cáncer de ovario se caracteriza por la proliferación descontrolada del tejido ovárico, cuyo origen no se conoce, pero se está investigando. Este tipo de cáncer es la quinta causa de muerte en mujeres, según la OMS. El tumor ovárico es una mezcla de células estromales, endoteliales, epiteliales e inmunes.
Desde las primeras etapas se va a dar la expresión de los ligandos EGF. Es más, EGFr se expresa en el 70% del cáncer de ovárico. El receptor, además de sobreexpresar en el cáncer de ovario, lo que hace es acelerar la metástasis.
Las pacientes que sean EGFr-ARNm positivas, van a tener pocas posibilidades de sobrevivir, además de aquellas mujeres que tengan el cáncer en un estadio III-IV.
Existen estudios en cáncer de útero, cérvix y vagina que afirman que hay menos tiempo para sobrevivir cuando el receptor se ha sobreexpresado. Y otros aseguran que los marcadores que aumentan la actividad de EGFr, empeoran la vida de la paciente.
Otro caso es la nefronoptisis. Esta es una enfermedad medular quística que da lugar a la insuficiencia renal. En ella, tiene cierta importancia el factor de crecimiento epidérmico, pues da lugar a la hiperplasia epitelial en el epitelio quístico y da lugar a la formación de quistes renales. En un estudio se demuestra que el EGF va a tener efecto en la mitosis y que se da un aumento de los receptores de la enfermedad.
La conclusión que sacaron es que el EGF, al ser el que diferencia los órganos inmaduros, es el que va a formar los quistes si se trata de un epitelio tubular que no está diferenciado. Aparte de esta idea, destaca su presencia en la regeneración al rasgarnos el tejido epitelial.
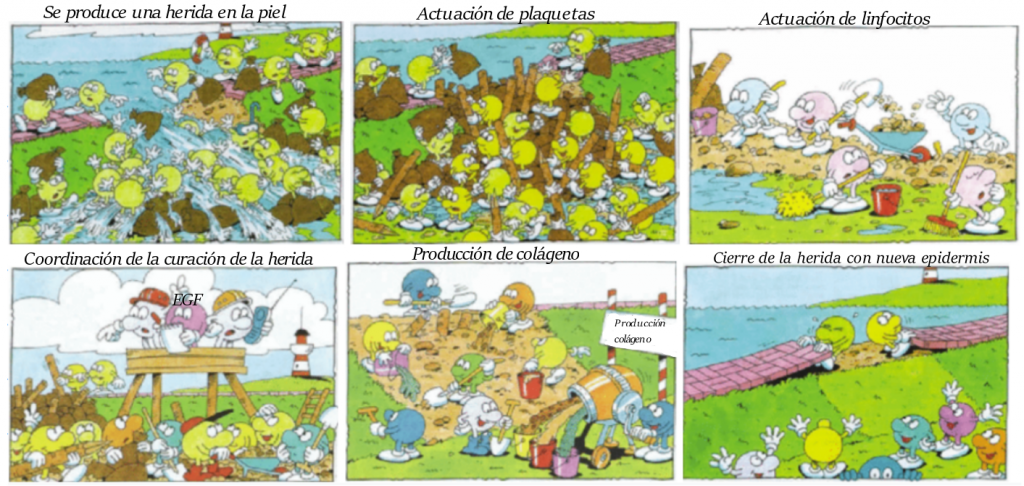
La curación de heridas da lugar a inflamación. Las células implicadas en esto van a estar reguladas por factores de crecimiento, como los factores de crecimiento epidérmicos. Es más, los receptores de estos se van a dar en muchas células, como los fibroblastos, y son sintetizados por las células implicadas en la cicatrización. Es por ello, que, aplicando EGF se mejora la regeneración de la piel tras una herida.
En varios experimentos se ha observado que la unión de EGF con su receptor conducen a una serie de vías, que generan una mejor cicatrización y producción del tejido epitelial. De ahí viene el nombre de la proteína, el factor de crecimiento epidérmico.
CONCLUSIÓN
Lo que nos hubiera gustado saber de niños tras hacernos una herida es que el EGF es una proteína necesaria en la regeneración de los tejidos epiteliales. Tras la unión de EGF con su receptor, EGFR se dimeriza, y con su dominio tirosina-quinasa activa una cascada de reacciones que dan lugar a la proliferación celular. Algunas de estas reacciones promueven una mejor curación y cicatrización de las heridas, como se muestra en la siguiente imagen:
BIBLIOGRAFÍA
Arkhipov, A., Shan, Y., Das, R., Endres, N. F., Eastwood, M. P., Wemmer, D. E., … & Shaw, D. E. (2013). Architecture and membrane interactions of the EGF receptor. Cell, 152(3), 557-569.
Lahera Sánchez, T., & González Hernández, O. J. (2010). El receptor del factor de crecimiento epidérmico y su papel en el desarrollo tumoral. Revista Habanera de Ciencias Médicas, 9(2), 172-180.
García, G., Clavijo, D., García, A., Casadiego, C. A., Mejía, O., & Zamora, R. (2005). Factores de crecimiento epitelial: aspectos biológicos, patológicos y clínicos. Revista de la Universidad Industrial de Santander. Salud, 37(2), 107-121.
Esquirol-Caussa, J., & Herrero-Vila, E. (2017). Factor de Crecimiento Epidérmico (EGF) y geles de silicona en el abordaje de heridas, quemaduras y cicatrices: revisión de la literatura. Cirugía Plástica Ibero-Latinoamericana, 43(4), 387-394.
Martínez-Carpio, P. A. (2003). El factor de crecimiento epidérmico cuarenta años después de su descubrimiento: de la bioquímica a la clínica. Endocrinología y nutrición, 50(8), 334-344.
Pereda Meira, C. M., García Figueredo, I., & Domínguez Ayerbe, A. (2004). El precursor del factor de crecimiento epidérmico: Perspectivas de su utilización como marcador tumoral. Revista Cubana de Medicina, 43(1), 0-0.
Cutiño, M. P., Remedios, A. A., & Ortega, E. G. (2018). Expresión del receptor de factor de crecimiento epidérmico en cáncer de ovario. Revista Cubana de Obstetricia y Ginecología, 44(2), 1-11.
Henson, E. S., & Gibson, S. B. (2006). Surviving cell death through epidermal growth factor (EGF) signal transduction pathways: implications for cancer therapy. Cellular signalling, 18(12), 2089-2097.
Goodsell, D. S. (2010). Molecule of The Month: Epidermal Growth Factor.
Arenas, J. (2003). [Dermatología] Las heridas y su cicatrización. Offarm: farmacia y sociedad, 22(5), 126-132.
Cutiño, M. P., Remedios, A. A., & Ortega, E. G. (2018). Expresión del receptor de factor de crecimiento epidérmico en cáncer de ovario. Revista Cubana de Obstetricia y Ginecología, 44(2), 1-11.
Flaquer, M., Romagnani, P., & Cruzado, J. M. (2010). Factores de crecimiento y regeneración renal. Nefrología (Madrid), 30(4), 385-393.
Pastore, S., Mascia, F., Mariani, V., & Girolomoni, G. (2008). The epidermal growth factor receptor system in skin repair and inflammation. Journal of Investigative Dermatology, 128(6), 1365-1374.
Ramírez, A. E., Fernández, C., Narváez, D., & Teneud, L. (2010). Expresión del receptor del factor de crecimiento epidérmico en biopsias renales de pacientes con nefronoptisis del adolescente. Nefrología (Madrid), 30(5), 518-521.


