C. Menor-Salván. Febrero 2024
Para entender los resultados expuestos, es necesario disponer del guión de prácticas del departamento de Biología Sanitaria de la Universidad de Alcalá. Es conveniente haber revisado los fundamentos prácticos de la electroforesis SDS-PAGE.
Resultado
Tras realizar la electroforesis de muestras conteniendo albúmina bovina (BSA), se tiñe el gel con el reactivo BlueSafe de NCYtech. Obtenemos el siguiente gel teñido, preparado por estudiantes de Biología Sanitaria; sobre la imagen se realiza, con una regla, la medida de la distancia de migración relativa (Rf):
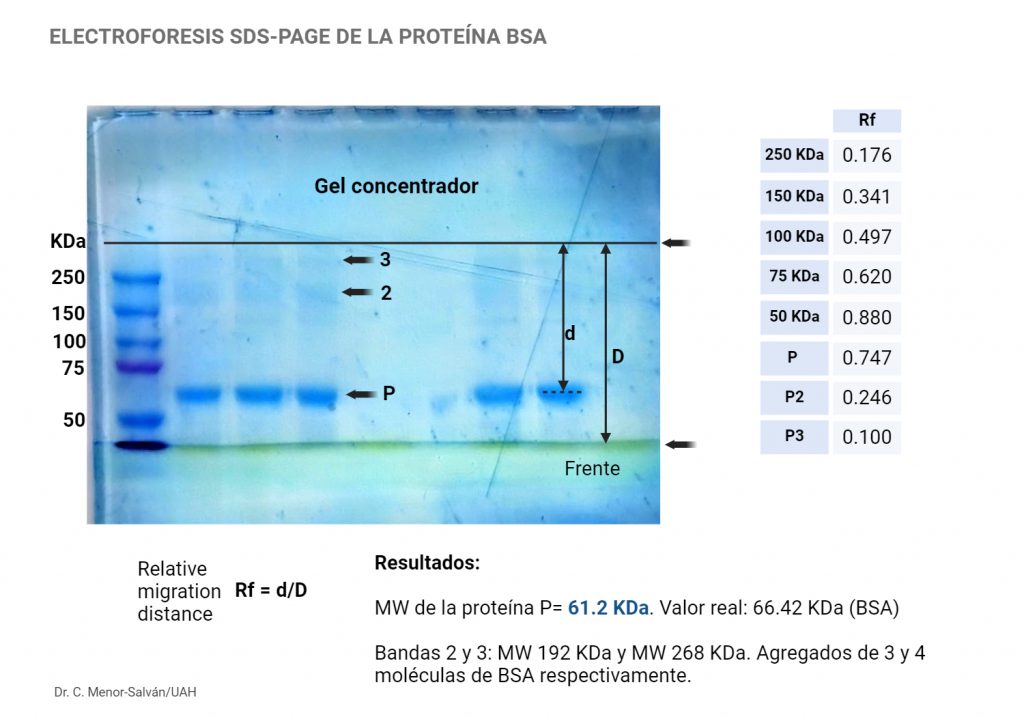
Como hemos explicado en el laboratorio, gracias al uso del SDS, la velocidad de migración de la proteína es inversamente proporcional al radio de Stokes del a partícula, que, a su vez, es directamente proporcional a la masa molecular (MW) de la proteína. Como resultado, cuanto mayor es el MW, menor es la velocidad de migración. También es investamente proporcional a la viscosidad del gel (es decir, el porcentaje de poliacrilamida), y directamente proporcional a la carga de la partícula y al campo eléctrico. Es decir, cuanto mayor es el porcentaje de acrilamida, menor es la velocidad; a su vez, cuanto mayor es el campo eléctrico, mayor es la velodad. El resultado es que no tenemos una relación sencilla o lineal entre MW y Rf
Por ello, se linealiza mediante una representación semilogarítmica, a partir de la que obtenemos una recta de regresión del logMW vs Rf:
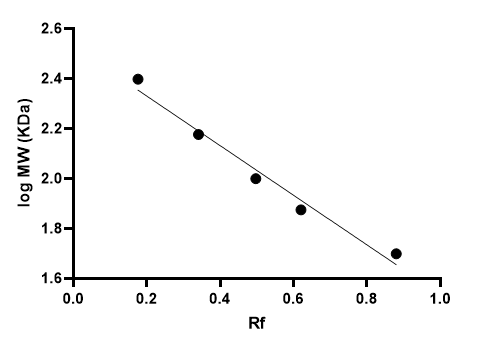
La regresión tiene un r2 = 0.977, nos ofrece unos valores aproximados del MW de las bandas y obtenemos un peso molecular de 61.2 KDa para la albúmina, cuyo valor experimental real es 66.4 KDa.
Discusión
Lo primero que nos llama la atención es la presencia de las tenues bandas adicionales 2 y 3. El cálculo del MW nos sugiere que están formadas por agregados de 3 y 4 moléculas de BSA, respectivamente. La presencia de agregados proteicos es común en la electroforesis.
Esta técnica nos permite aproximar el peso molecular de la proteína, pero es de baja resolución. A pesar del uso de gel concentrador, el ensanchamiento de las bandas hace que las medidas sean poco precisas y es normal tener errores de aproximadamente un 5% o más. Para obtener el MW real de la proteína es necesario utilizar técnicas de espectrometría de masas.
Otro aspecto a considerar es la intensidad y grosor de las bandas. Esta es proporcional a la cantidad de proteína. Esto hace la electroforesis una técnica útil para valorar la presencia o ausencia, o la proporción relativa de una proteína. La sensibilidad en la detección de diferencias depende del tipo de tinción.
Si observamos la regresión logMW vs Rf, vemos que se desvía de una recta ideal con un error considerable. Esto va a ocurrir siempre: por muy bien que hagamos la electroforesis y la medida, siempre se va a desviar la linealidad. Hay muchos factores que afectan a la separación. Uno de ellos es la temperatura. Si ésta aumenta, realizando la electroforesis a voltaje elevado por ejemplo, se produce dispersión de las bandas y efectos complejos. Por ello, en algunos casos, los investigadores realizan la electroforesis a temperatura constante o dentro de una cámara fría, para evitar los efectos térmicos, aunque una temperatura demasiado baja puede incrementar la viscosidad.
Otro factor es debido al diámetro (o radio) de Stokes de la partícula. En SDS-page, el diámetro de Stokes de la partícula proteica es proporcional al peso molecular, pero no constante. Podemos establecer una relación empírica aproximada entre el peso molecular y el diámetro:
MW= f3 x 433 x ds3
donde ds es el diametro de Stokes en nm y f es el ratio friccional. El valor de f es de aproximadamente 1.23 entre 50 y 100 KDa, aumentando a 1.28 por encima de 100 KDa y a 1.43 a aprox. 500 KDa. Para la BSA, con un MW de 66400 Da, obtenemos un diámetro de Stokes de 4.35 nm. No está mal, teniendo en cuenta que los diámetros medidos para la BSA están entre 3 y 6 nm dependiendo de la concentración de SDS y el proceso de desnaturalización.
La variación en el ratio friccional hace que la relación entre el diámetro de la partícula y el peso molecular no sea la misma para todos los marcadores, lo que introduce una considerable desviación de la linealidad.
Se recordamos, la velocidad de migración en el gel es v=µE, donde µ es la movilidad electroforética. Esta es inversamente proporcional al diámetro de Stokes. Como hemos visto, en la ecuación de la relación entre MW y diámetro de Stokes, el cambio de ratio friccional implica que a peso molecular alto, el cociente MW/ds3 se incrementa. En el caso de la proteína a 250 KDa, según la relación anterior, si el ratio friccional fuera constante, su diámetro aparente sería 9.3 nm. Como el ratio friccional no lo es, si corregimos según el tamaño, obtenemos un diámetro de 6.5 nm. Es decir, si siguiera la misma relación que el resto, el punto aparecería alineado. Como el diametro real es menor, la movilidad es algo mayor y el Rf es más elevado del que sería esperable, apareciendo el primer punto siempre por encima de la recta de regresión.
Como se ve, la técnica en su detalle tiene muchas complejidades que hay que tener en cuenta a la hora de evaluar la separación y el peso molecular aparente que obtenemos.


