C. Menor-Salvan Ver 1.8 Marzo 2024
En construcción. Para la información completa, consultar el guión de la práctica.
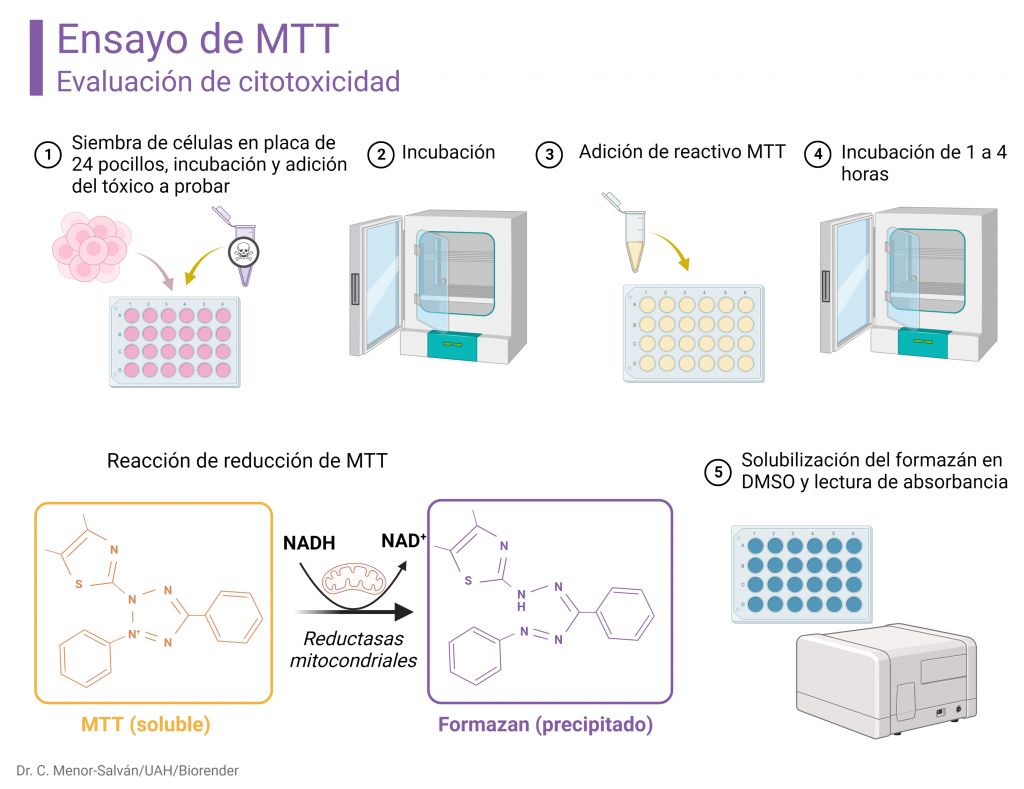
Fundamento del ensayo por MTT
El MTT (bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5-difenil-2H-tetrazolio) es uno de los compuestos más conocidos de la familia de las sales de tetrazolio. Es la base de un sencillo ensayo de toxicidad mediante la medida de la viabilidad celular.
El NADH, formado en el metabolismo celular, reduce el MTT, en una reacción que tiene lugar lentamente sin catalizadores, pero con relativa rapidez en presencia de oxidorreductasas mitocondriales. La reducción abre el ciclo de tetrazolio (originalmente amarillo). La reacción de apertura de ciclo conduce a la conjugación de dobles enlaces en el compuesto resultante, el formazán, lo cual da lugar a un cambio de color del amarillo original a un azul intenso o violáceo. La reacción hace, además, que se pierda la carga del anillo de tetrazolio, lo cual hace que el formazán sea insoluble, precipitando en el interior de las células viables, tiñendo el cultivo de púrpura o azul intenso. Lógicamente, si las células han muerto a consecuencia del tratamiento con el tóxico, dejan de producir NADH y se pierde la capacidad para reducir MTT. La generación de formazán, y, por tanto, el color azul-púrpura resultante, es directamente proporcional a la viabilidad celular. Tras la reacción, se mide la intensidad del color resultante mediante un espectrofotómetro lector de placas. El instrumento nos da una medida de absorbancia.
Cómo calculamos la DL50
El ensayo MTT nos permite obtener una curva de dosis-respuesta: al ir aumentando gradualmente la concentración de la sustancia que estamos probando en el ensayo, irá disminuyendo la viabilidad celular (si es citotóxica y hemos ‘acertado’ con las concentraciones). Con la medida de absorbancia obtenemos esta tabla, después de hacer la media de los triplicados (los tres pocillos iguales que hemos usado para cada concentración):

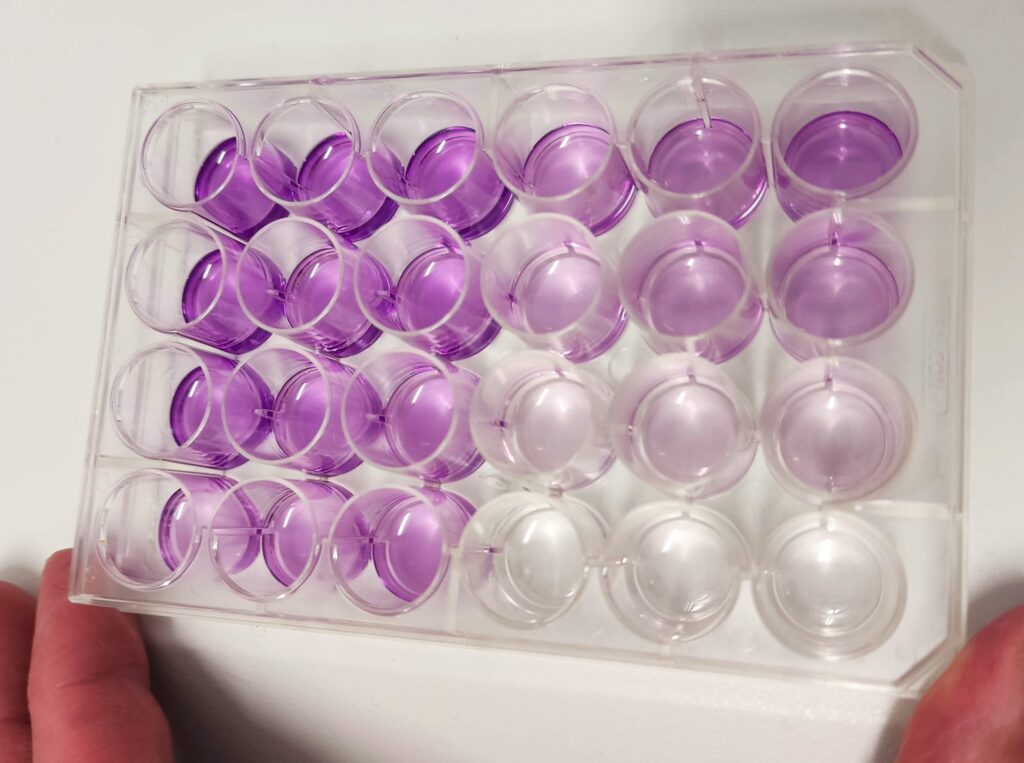
¿por qué usamos triplicados?
Básicamente por esto:

Al poner tres pocillos iguales con la misma concentración, si uno no sale bien, tenemos los otros dos. Imaginad que sólo hubiéramos usado un pocillo para concentración, y hubiera salido como el replicado 3 de la imagen…
Este es el resultado del experimento:
¿por qué ponemos unos pocillos control y otros con SDS?
El control nos permite tomar la referencia de viabilidad. Como todo el cultivo se ha realizado al mismo tiempo y en las mismas condiciones, consideraremos que el control, que no lleva ningún tratamiento (sería el equivalente al placebo en los ensayos clínicos) va a ser nuestro 100% de viabilidad.
Los pocillos con SDS los consideraremos el 0% de viabilidad, pues el SDS, un detergente, destruirá las células del cultivo al disolver sus membranas celulares. Esta medida de absorbancia que nos da (0.053 en este experimento) constituye el ‘fondo’, es decir, la absorbancia que va a presentar la placa de cultivos, el medio de cultivo, los reactivos, etc. Si observáis, casi todos habéis obtenido una medida próxima en los pocillos de SDS (entre 0.050 y 0.060). Este ‘fondo’ se lo vamos a restar al resto de las absorbancias medidas. Con ello obtendremos la absorbancia debida al formazán.
Por algunas razones (probablemente posición en la placa, vuestra velocidad de manipulación u otros factores) os ha dado a todos un valor más bajo en el control que en algunos puntos de tratamiento. Por ello, yo puse una placa de cultivo sin tratar como control adicional. Esta placa me da una media de absorbancia de 0.226 unidades. Restando el fondo, voy a usar estos datos:
| Control | 0.05 mM | 0.1 mM | 1mM | 10 mM | 15mM | 20mM | SDS 0.2% | |
| Absorbancia | 0.173 | 0.081 | 0.099 | 0.08 | 0.021 | 0.026 | 0.023 | 0 |
| % viabilidad | 100 | 46.8 | 57.2 | 46.2 | 12.2 | 15.0 | 13.3 | 0 |
Los datos de porcentaje de viabilidad los he obtenido simplemente haciendo una regla de tres, considerando la absorbancia del control como la que obtenemos con un 100% de viabilidad.
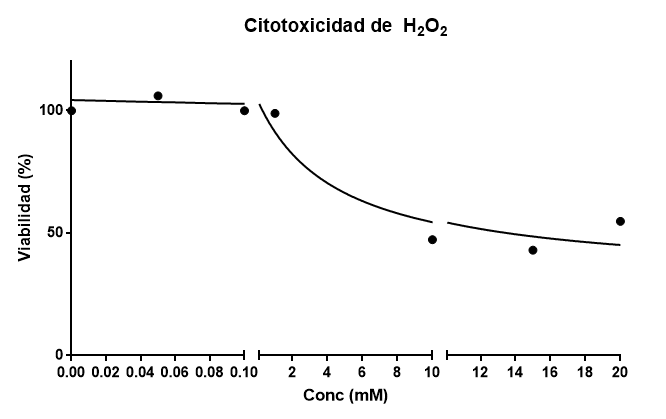
Ahora represento mi modelo de citotoxicidad:
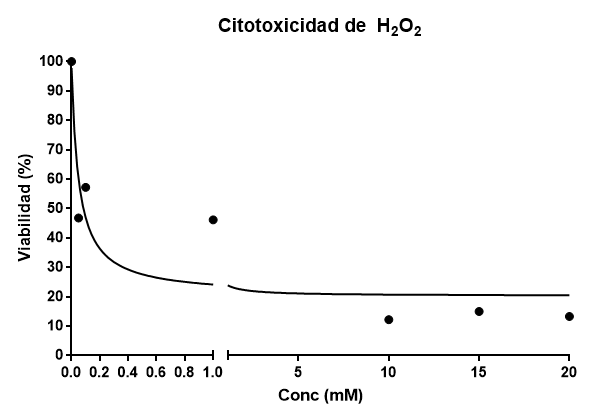
Con estos datos, ajusto a una curva sigmoidal, la función esperada para una disminución de viabilidad con el tratamiento, que tiene la forma:
Y=100/(1+X/IC50)^n)
donde n es el coeficiente de Hill. Esta ecuación es la ecuación sigmoidal de Hill, que se cumple en fenómenos como inhibición enzimática o dosis respuesta. El valor de DL50 que obtengo es de 0.052 mM. Esto significa que a una concentración de 0.052mM espero que el 50% de las células hayan muerto. El ajuste del modelo nos da un R2 =0.8479, el cual no está mal dado que es el primer experimento que hacéis.
En realidad debería haber usado el control que el equipo ha obtenido en su experimento en lugar de usar el mío, pues su control también refleja cómo el experimentador ha manejado el cultivo. Por ello, vosotros siempre debéis utilizar vuestros propios controles en los experimentos. En tal caso, obtendría este modelo:
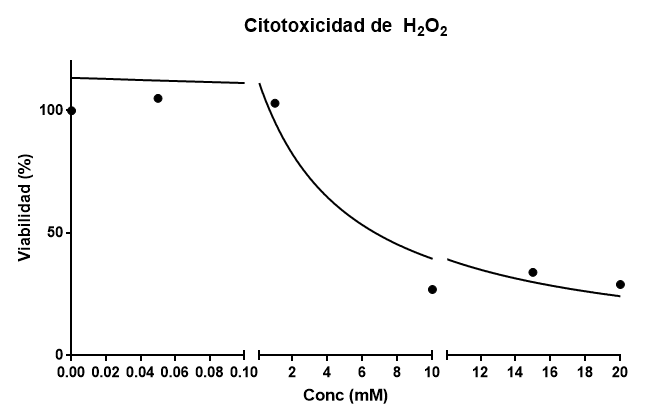
Este ajuste nos da un R2 =0.9316, mucho mejor, y un DL50 = 5.27 mM. Ya veis que disponer de un buen control es esencial. Esto significa que las células resisten bien concentraciones bajas de agua oxigenada, pero a una concentración mas elevada, comienzan a morir. Podemos decir que el agua oxigenada es poco tóxica: se requieren concentraciones del orden mM. Muchos citotóxicos actúan a concentraciones micromolares o nanomolares (1000 y hasta un millón de veces más bajas). Las células tienen un buen sistema de defensa contra el agua oxigenada: enzimas que la destruyen.
La representación en escala lineal de concentración requiere hacer unos «cortes» en la escala. Es mucho mejor realizar una representación semi-logarítmica, donde se aprecia bien el aspecto sigmoidal.
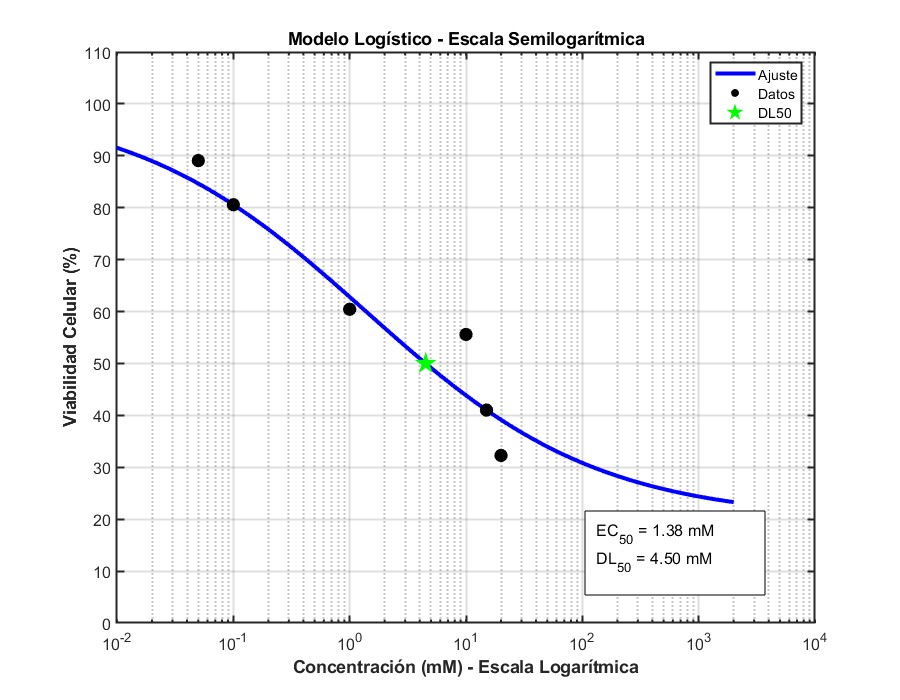
Vamos con otro set de datos:
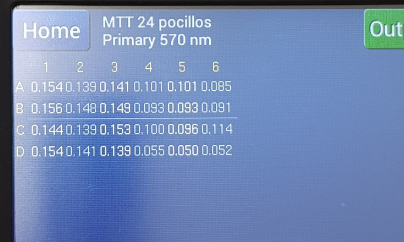
Con estos datos obtenidos en el lector de placas, tenemos la siguiente tabla (restando el valor de absorbancia del tratado con SDS, que es 0.052
| Control | 0.05 mM | 0.1 mM | 1mM | 10 mM | 15mM | 20mM | SDS 0.2% | |
| Absorbancia | 0.093 | 0.099 | 0.093 | 0.092 | 0.044 | 0.040 | 0.051 | 0 |
| % viabilidad | 100 | 106 | 100 | 98.9 | 47.3 | 43.0 | 54.8 | 0 |
El modelo que obtengo es este:
Tiene un buen ajuste, con R2=0.9456 y me da una DL50 de 4.59mM. No está demasiado lejos del experimento anterior. Observad que he dividido el eje X de la gráfica en tres segmentos, para que quede una representación proporcionada.
Estas gráficas las he ajustado numéricamente a un modelo matemático sencillo. A mano, en un simple papel milimetrado y dibujando la curva deberíamos obtener un valor similar. Para que veais que el experimento ha funcionado bien, los valores reales obtenidos para la DL50 del peróxido de hidrógeno están entre 2 y 20 mM. De hecho, la DL50 para tipos celulares de cáncer está entre 3.3 y 6.0 mM, , en particular para células similares a las que habéis utilizado, la DL50 es 4.7 mM, por lo que vuestro experimento ha funcionado muy bien.
¡Muchas gracias a Carlos Samuel Barreno y Alejandro Arzoz, y a Marina Calderón y Rocío , el primer curso de Ciencias Ambientales, por su ayuda con los datos!
Referencias
O’Donnell-Tormey, J., DeBoer, C. J. & Nathan, C. F. (1985) ‘Resistance to human tumor cells in vitro to oxidative cytolysis’, Journal of Clinical Investigation, 76(1), pp. 80–86. doi: 10.1172/JCI111981.


