La diferencia fundamental entre topoisomerasa tipo I y tipo II es que las primeras cortan una cadena de DNA y las tipo II cortan ambas cadenas de DNA, además de requerir la energía del ATP para ello. La topoisomerasa I no requiere ATP, pues es impulsada por la tensión del DNA superenrrollado.
La topoisomerasa tipo II modifica el número de giros de una molécula de DNA superenrollado, haciendo pasar un segmento de DNA a través de otro, para lo que requieren cortar la doble hélice. En este proceso, la topoisomerasa puede aliviar la tensión de torsión de la estructura tanto en superenrollamientos negativos como positivos. La topoisomerasa es esencial en numerosos procesos, como replicación, transcripción o recombinación, pues es necesario aliviar la tensión de torsión de la molécula de DNA para que las horquillas de replicación o la burbuja de transcripción progresen.
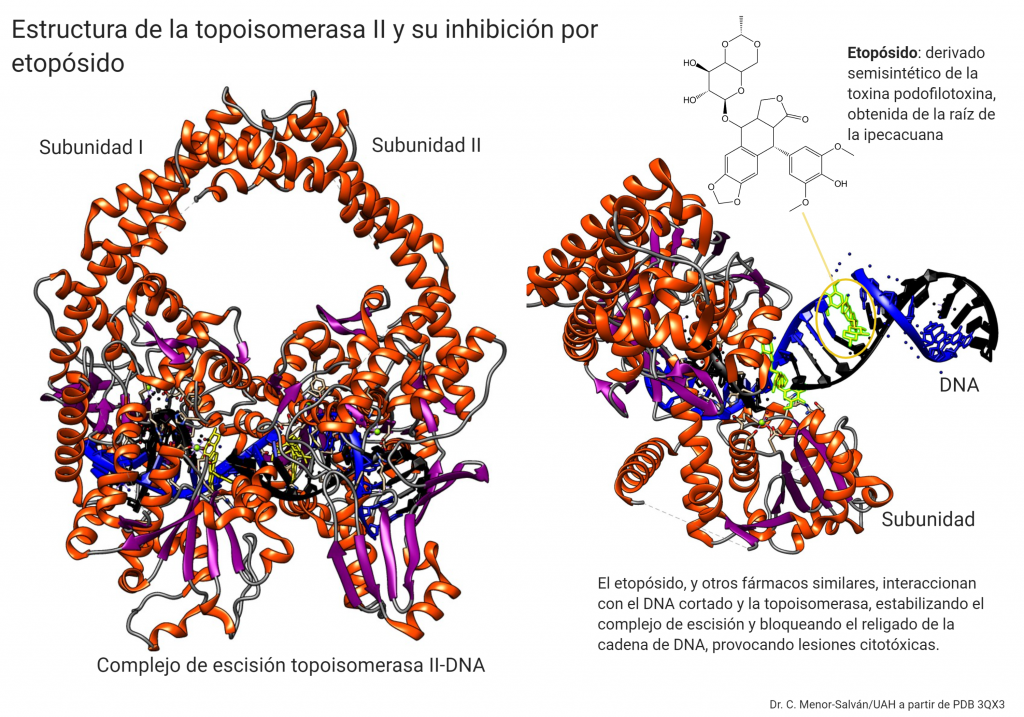
La Topoisomerasa II es un dímero, y su sitio activo tiene dos residuos de tirosina que cortan las hebras de DNA mediante una reacción de transesterificación con los grupos fosfato 5′ de las cadenas que corta. La energía del ATP impulsa la reestructuración y cambios conformacionales de la proteína necesarios.
La topoisomerasa II esta realizando un proceso muy delicado, siendo un «arma de doble filo»: cortar una doble hélice de DNA. Un fallo en el proceso resultaría en una rotura del DNA, interfiriendo en la transcripción o la replicación y provocando la muerte de la célula. Así, esta enzima es un target farmacológico muy interesante: si bloqueamos la topoisomerasa en células cancerosas, bloquearemos su replicación. Este es el mecanismo de acción de fármacos como el etopósido, que actúa estabilizando el complejo entre la topoisomerasa II y el DNA escindido, bloqueando el religado, provocando roturas en la cadena y la muerte celular por acumulación de lesiones citotóxicas en el DNA.
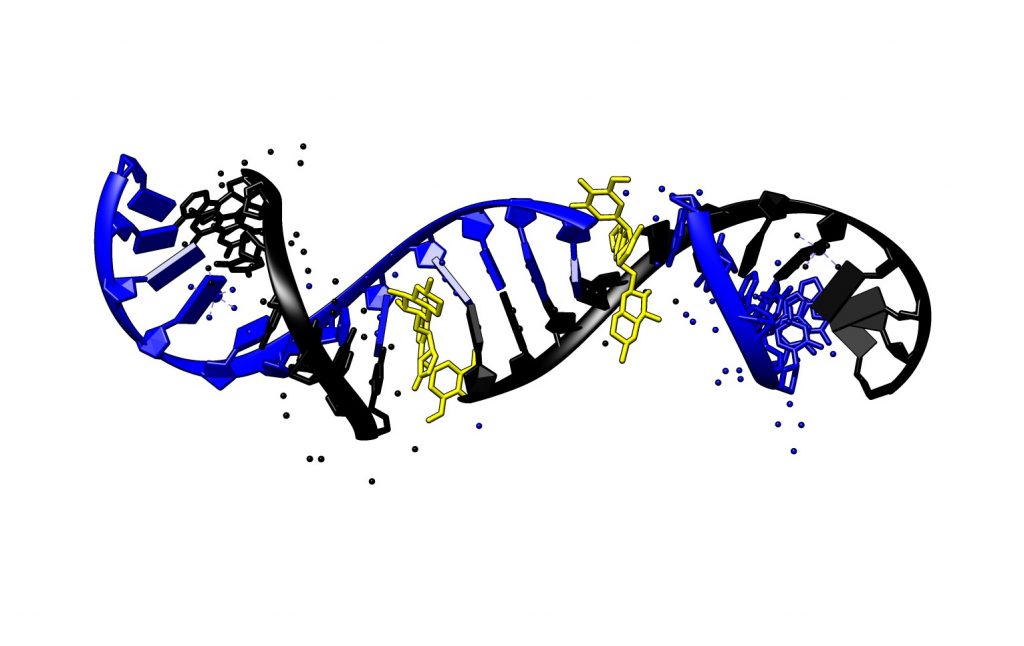

El etopósido se inserta en el corte del DNA y estabiliza el complejo de escisión a través de dos interacciones: puentes de hidrógeno entre los numerosos oxígenos de la molécula, y stacking con guaninas presentes en el punto de corte de la cadena.
Los humanos y otros vertebrados tienen dos tipos muy similares o isoformas de topoisomerasa II, con una función diferenciada: la Topoisomerasa II alfa, esencial en la replicación y presente en gran abundancia en células de cáncer, mientras que la isoforma beta es la que actúa en la transcripción. La inhibición de ambas isoformas es importante en el tratamiento farmacológico del cáncer, aunque la inhibición de la isoforma beta se asocia con efectos adversos de los fármacos. El estudio estructural detallado de las topoisomerasas puede ayudar a diseñar fármacos específicos para la isoforma alfa, mucho mas seguros y eficaces.
Referencias
Wu, C. C., Li, T. K., Farh, L., Lin, L. Y., Lin, T. S., Yu, Y. J., Yen, T. J., Chiang, C. W. and Chan, N. L. (2011) ‘Structural basis of type II topoisomerase inhibition by the anticancer drug etoposide’, Science, 333(6041), pp. 459–462. doi: 10.1126/science.1204117.