TRIPSINA: LA PRIMERA «ENZIMA»
Por Cristina Díaz Fraile, Yolanda García del Castillo López y Carmen Fernández Montiel. 1ºB de Biología Sanitaria
Para que sea más fácil relacionar los términos, y por lo tanto, reducir la energía necesaria para entender bien el tema, vamos a introducir primero lo que es una enzima.
Las enzimas son moléculas orgánicas proteicas que se encargan de catalizar reacciones. Estas reaccionan con el sustrato, formando un complejo enzima-sustrato que ocasionará que mediante un “juego” entrópico y entálpico se reduzca la energía necesaria de activación. Hay muchos tipos de enzimas que se encargan de diferentes reacciones (aunque una misma puede servir para varios sustratos debido a que no son tan específicas). La tripsina pertenece a un grupo de enzimas llamadas peptidasas o proteasas.
Esta enzima fue descubierta por el fisiólogo alemán Wilhelm Kühne mientras realizaba sus estudios sobre los mecanismos digestivos en 1876. De hecho, fue él quien introdujo la palabra enzima al investigar sobre la propia tripsina.
LA TRIPSINA: UNA ENZIMA PROTEASA
Para entender su función y mecanismo precisa conocer que se trata de una enzima proteasa, es decir, una enzima que es capaz de catalizar la ruptura de las cadenas polipeptídicas en unidades proteicas más pequeñas, como lo son los péptidos o los aminoácidos, el monómero estructural de las proteínas. Esta enzima se encuentra en humanos y otros animales como los rumiantes. Es producida por el páncreas, pero se secreta al duodeno ya que es una enzima digestiva esencial.
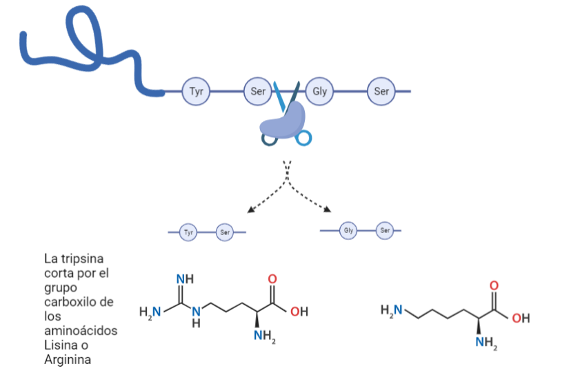
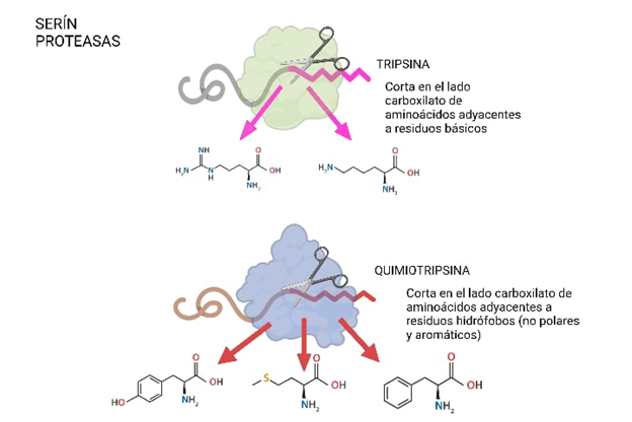
En concreto, la tripsina resulta ser una serín proteasa debido a la presencia del aminoácido serina en su centro activo, el cual será esencial para la catálisis. Las serín proteasas son capaces de reconocer la secuencia primaria de la cadena polipeptídica y cortarla por el lado carboxilo de aminoácidos específicos dependiendo de cuál sea la enzima concreta que actúe: por ejemplo, la tripsina corta en el lado carboxilato de aminoácidos adyacentes a residuos básicos como lo son la lisina y la arginina, mientras que la quimiotripsina lo hace junto a residuos no polares y aromáticos, como la tirosina, metionina o fenilalanina.
OPTIMIZACIÓN
Esta enzima tiene un rango de pH óptimo entre el 7 y el 8, aunque más concretamente es de 7,7. Asimismo, actúa con una temperatura óptima de 37 grados Celsius. De hecho, a unos 25º la actividad de la tripsina es 1.87 menor que a la temperatura óptima. Por lo tanto, es una reacción favorable en cuanto a la termodinámica, pero como tiene una energía de activación muy alta, cinemáticamente hablando es desfavorable.
Un efector en la actividad de la proteasa está relacionada con el calcio que estabiliza la estructura terciaria, ya que la tripsina tiene un lugar de unión al calcio. Este hace que no se formen agregados de tripsina, favoreciendo la actividad de esta.
MECANISMO: LA TRIADA CATALÍTICA
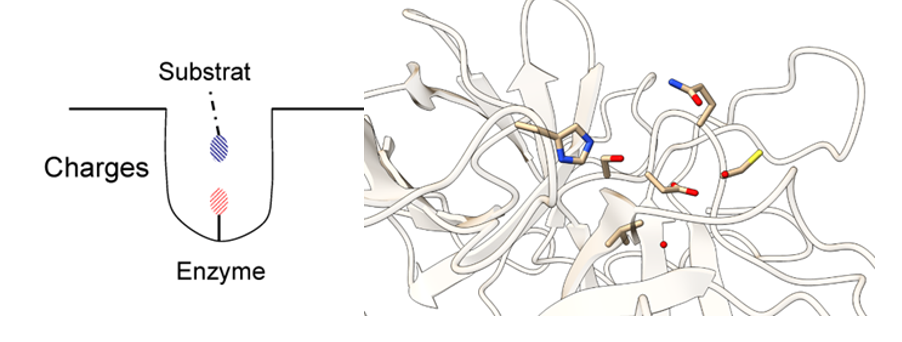
Para realizar su función, la tripsina y las enzimas hidrolasas en general poseen una triada catalítica en su centro activo, que son residuos de tres aminoácidos que funcionan en conjunto en la grieta catalítica del sitio activo para poder llevar a cabo la catálisis.
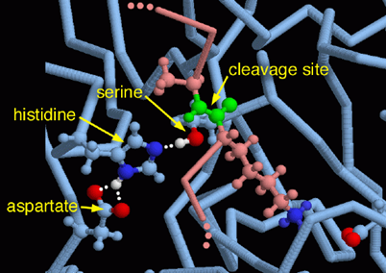
En el caso de la tripsina, esta triada está constituida por serina, histidina y aspartato. Además, posee un “bolsillo” (Substrate-binding pocket) cerca del centro activo formado por un carboxilo de la cadena lateral de un ácido aspártico. Este bolsillo tiene una fuerte relación con lo ya mencionado anteriormente, puesto que si la tripsina tiene afinidad por cortes de aminoácidos básicos (carga positiva), el hecho de que el residuo del bolsillo sea ácido hace que ambas cargas (la positiva de la base y la negativa del ácido) interaccionen electrostáticamente.
La conservación de esta triada permite la clonación de la secuencia consenso donde los oligonucleótidos degenerados se utilizan en una cadena de reacciones del material genético de la polimerasa para poder reconocer tripsinas. De hecho, la tripsina se ha utilizado para observar la especificidad de sustrato entre las serinas proteasas.
Una vez explicado los componentes esenciales para la catálisis vamos a centrarnos en las interacciones que tienen lugar en la triada para generar un entorno favorable que promueva la ruptura de los péptidos.
La serina195 es un aminoácido muy reactivo, no esencialmente por su naturaleza sino por el entorno que le rodea que le confiere la alta reactividad. En primer lugar, el grupo hidroxilo (OH) de la serina establece un puente de hidrógeno con el anillo imidazol de la histidina. El aspartato, que se encuentra en el lado contrario del anillo de imidazol, establece una unión entre su carga negativa y el hidrógeno del anillo.
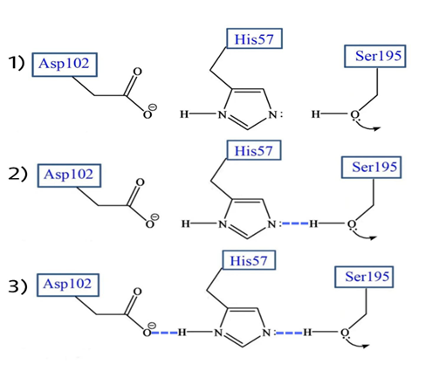
La histidina por tanto polariza el grupo OH de la serina y acepta su protón, dejando al Oxígeno con una carga negativa que incrementa la capacidad nucleofílica de la serina. El nitrógeno de la Histidina queda cargado positivamente y será el aspartato que con su carga negativa estabilice dicha carga para hacer de la histidina un mejor aceptor de protones.
SISTEMA DE REGULACIÓN: EL TRIPSINÓGENO
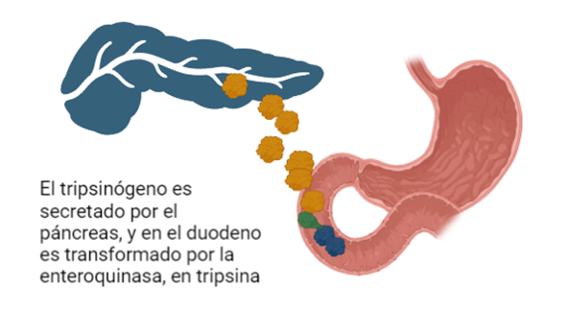
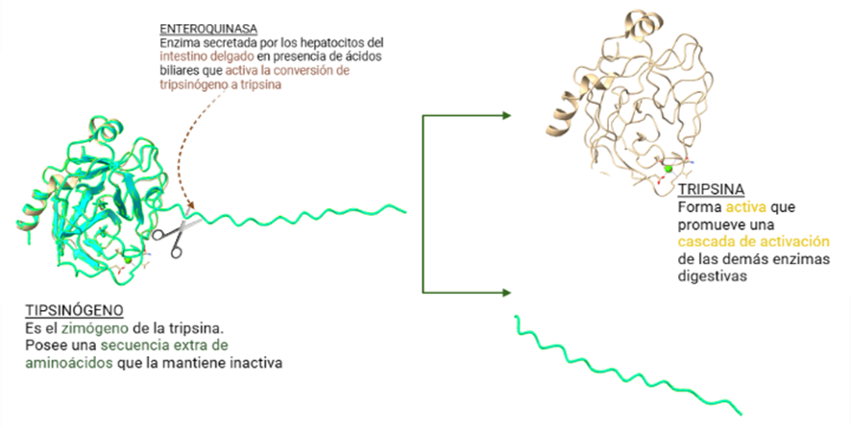
Sin embargo, todo el mecanismo que envuelve a las enzimas digestivas, entre las que se encuentra la tripsina, no está siempre en funcionamiento, sino que existen unas formas inactivas llamadas zimógenos que necesitan ser activadas. Las tripsinas se secretan en forma de tripsinógeno ya que es una forma de protección para intentar prevenir una actividad prematura del páncreas, pudiendo desencadenar una reacción inflamatoria que provoca pancreatitis. El tripsinógeno es formado en los aparatos de Golgi, empaquetados en forma de zimógenos granulados, y secretados por exocitosis.
Por otra parte, en estos gránulos también podemos encontrar inhibidores de tripsina secretoras pancreáticas (PSTI) para la inactivación de algunas tripsinas activas. Además, el tripsinógeno puede ser también activado por catepsinas (que pueden intervenir en la pancreatitis aguda), proteasas lisosomales que se activan a pH bajo. Sin embargo, estas no se encuentran en los mismos compartimentos de la célula. El mecanismo catalítico es un ataque nucleofílico.
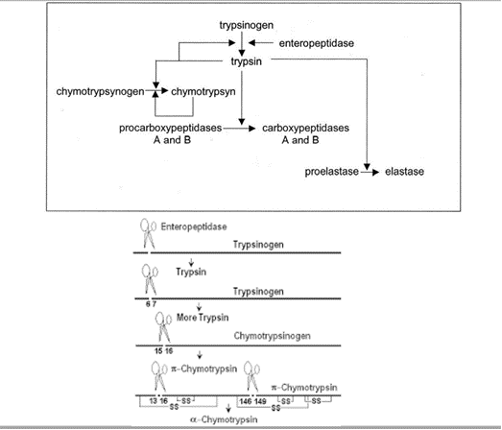
En el paso desde la forma inactiva hacia la activa actúa otra serín proteasa, la enteroquinasa (también conocida como enteropeptidasa), cuya localización se encuentra en el duodeno y que es secretada por los enterocitos una vez la comida ingerida sale del estómago. La enteropeptidasa convierte al tripsinógeno en su forma activa la tripsina, provocando la activación en cascada de las enzimas digestivas pancreáticas.
INHIBIDORES
Los inhibidores son unas proteínas, (y un tipo de inhibidor serina) que reducen la actividad de la tripsina, controlando las reacciones. Son inhibidores irreversibles y suicidas. Usados principalmente como “controladores de fallos” para evitar que el tripsinógeno se convierta en tripsina antes de su secreción. Sin embargo, también pueden ser considerados negativos en el caso en el que intervenga en la digestión cuando está funcionando correctamente.
Estos inhibidores los podemos encontrar en muchos tipos de alimentos, como patatas, judías, cacahuetes, maíz dulce, cereales y soja. Asimismo, también se han encontrado en la leche materna humana que ayuda siendo un protector del intestino para los bebés. Ha sido comprobado que el calor puede reducir la actividad de los inhibidores, sobre todo en la soja y productos del estilo. Por ejemplo, hirviendo la soja durante 14 minutos, inactivas el 80 % de los inhibidores y durante 30, el 90%.
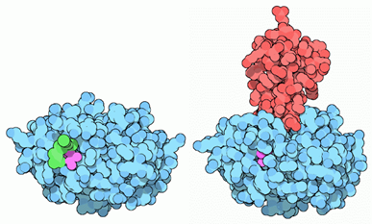
Como se ha mencionado previamente, la tripsina tiene inhibidores de su actividad (PSTI). En cambio, es posible que la actividad de la tripsina exceda la capacidad de los inhibidores, provocando que se desencadene una cascada de reacciones en la que se activan proteasas que puedan provocar daños en las células ya que activan el receptor 2 (PAR-2), haciendo que se sinteticen citoquinas y la regulación de la exocitosis a través de un feedback negativo.
Mediante estudios, han descubierto la importancia de la formación del complejo con la tripsina mediante unos experimentos, donde observaron que los inhibidores modificados reaccionaban mucho más lento que los “normales”.
Algunos usos de estos inhibidores son:
- Como ya se ha comentado, la tripsina se usa en los cultivos y en la preparación de muestras, pues los inhibidores se encargan de que la tripsina no destroce más de lo que es necesario, las células y proteínas que se van a observar.
- Los inhibidores vegetales se usan para repeler insectos, ya que provoca que el intestino de estos no funcione correctamente.
UTILIDAD EN BIOMEDICINA
En los inicios de la proteómica se usaba para separar proteínas tras un proceso de electroforesis en gel, para la secuenciación de péptidos y la identificación por espectrometría de masas. Que se pueda hacer este proceso se debe a que las tripsinas no les afecta el inhibidor fenilalanilclorometilcetona (TPCK). Esto se tiene en cuenta por la importancia de la especificidad del corte.
Actualmente la tripsina se usa en tecnologías de los alimentos, sigue utilizándose en el análisis proteómico, en la preparación de cultivos (la tripsinización, que es un proceso en el que se usa la tripsina tanto para la proteólisis en la que se separan las células adherentes del recipiente, como para pasarlas a otros), separación de tejidos en células constituyentes. Es un modulador de la capacidad alergénica de la soja y de la producción de péptidos antihipertensivos, junto a ser un identificador de enfermedades como la pancreatitis, la fibrosis quística, el cáncer… Estas enfermedades originan malabsorción, es decir, cuando hay una disminución de la producción de tripsinas, y como consecuencia, la incapacidad para digerir y absorber los nutrientes correctamente.
Por otra parte, científicos han descubierto que la tripsina puede estar asociada al Alzheimer y con las proteínas de larga duración, ya que estas al tener más “vida”, es más probable que surja una isomerización de la proteína, originando que sea más difícil de digerir, pues las enzimas digestivas (como la tripsina) tienen una tolerancia relativa a los isómeros, provocando problemas que pueden derivar al Alzheimer.
La tripsina a su vez está relacionada con la coagulación de la sangre. Por eso, ayuda en la eliminación de tejido muerto para que cicatricen mejor las heridas (desbridamiento), esto puede deberse a que degrada las proteínas del tejido. También ha habido muchos estudios que parecen indicar que la tripsina puede ser utilizada en lesiones traumáticas para reducir edema.
APLICACIONES DE LA TRIPSINA
Las enzimas son imprescindibles en una gran cantidad de industrias como la agrícola, alimentaria, farmacéutica, biomédica… Esto conlleva a que surja la necesidad de disponer de dichas enzimas. Es por esto por lo que la tripsina es utilizada para una enorme variedad de investigaciones relacionadas con este tipo de industrias.
Actualmente, se está estudiando la aplicación de la tripsina en varios ámbitos entre los que destaca la aplicación biomédica en la difracción de Rayos x en cuanto a complejos proteína-inhibidor. Esta enzima tiene un gran interés gracias a las similitudes que presenta con otras enzimas de la misma familia y que la haría útil para la sustitución de enzimas como el Factor X (factor de coagulación). Gracias a esto, también se ha podido estudiar su unión a un inhibidor que proviene de las semillas de girasol.
Asimismo, se han investigado algunas aplicaciones que puede presentar en la agricultura, participando como inhibidor en la soya y el garbando, siendo mucho más efectiva en la soya ya que ha sido capaz de modificar y aumentar la presencia de láminas beta plegadas, bucles, alfa hélices y cadenas no ordenadas además de reducir el número de estructuras agregadas de esta misma llevando a la modificación de su perfil electroforético.

Por otro lado, la tripsina ha sido estudio de la tesis de Elena Sofia Escobar Barrera de la Universidad nacional abierta y a distancia. Dicha tesis esta principalmente basada en la creación de tratamientos para destruir o impedir la aparición del herpesvirus-bovino tipo I en programas de transferencia de embriones. Dicho virus es capaz de unirse a los espermatozoides causando patologías a los futuros embriones. Existen varias formas de prevención, siendo la tripsina una solución enzimática que actúa como desinfectante. Aunque presentaba ciertos inconvenientes como el desarrollo de otras patologías, para evitar que pudiese causar otro tipo de infecciones en los embriones se llevó a cabo el desarrollo de una tripsina recombinante (obtenida del maíz).
Y con esto vamos terminando para que no sea muy difícil de digerir toda esta información.
REFERENCIAS
-Asociación Americana de Química Clínica. Malabsorción. Actualizado el 11 de noviembre de 2019.
-Aviles Gaxiola, S. Efecto de agentes reductores y/o procesamiento térmico sobre la actividad de inhibido de tripsina y solubilidad de concentrados proteicos de soya o garbanzo.
-Cohen, Maja; Davydov, Olga; Fluhr, Robert (2019-02-05). «Plant serpin protease inhibitors: specificity and duality of function». Journal of Experimental Botany. Society for Experimental Biology (OUP). 70 (7): 2077–2085. doi:10.1093/jxb/ery460. ISSN 0022-0957.
doi:10.2210/rcsb_pdb/mom_2003_10
-Escobar Barrera, E. S. Eficiencia del uso de la Tripsina como tratamiento para combatir el Herspes virus Bovino-1 en programas de transferencia de embriones.
-Hirota, M., Ohmuraya, M., & Baba, H. (2006). The role of trypsin, trypsin inhibitor, and trypsin receptor in the onset and aggravation of pancreatitis. Journal of gastroenterology, 41(9), 832-836.
-Hirota, M., Ohmuraya, M., & Baba, H. (2006). The role of trypsin, trypsin inhibitor, and trypsin receptor in the onset and aggravation of pancreatitis. Journal of gastroenterology, 41(9), 832-836.
-Huang, H. L.; Hsing, H. W.; Lai, T. C.; Chen, Y. W.; Lee, T. R.; Chan, H. T.; Lyu, P. C.; Wu, C. L.; Lu, Y. C.; Lin, S. T.; Lin, C. W.; Lai, C. H.; Chang, H. T.; Chou, H. C.; Chan, H. L. (2010). «Trypsin-induced proteome alteration during cell subculture in mammalian cells». Journal of Biomedical Science. 17 (1): 36. doi:10.1186/1423-0127-17-36. PMC 2873939. PMID 20459778.
-Ito C, Yamaguchi K, Shibutani Y, et al. Acciones antiinflamatorias de proteasas, bromelina, tripsina y su preparación mixta. Nihon Yakurigaku Zasshi. 1979; 75 (3): 227-237.
-John A. Williams, in Encyclopedia of Gastroenterology, 2004.Kadam, S.S., and Smithard, R.R. (1987). «Effects of heat treatments on trypsin inhibitor and hemagglutinating activities in winged bean». Plants Foods for Human Nutrition. 37 (2): 151–159. doi:10.1007/BF01092051. S2CID 84193551.
-Kaur, J., & Singh, P. K. (2020). Trypsin detection strategies: A review. Critical Reviews in Analytical Chemistry, 1-19.
-Kühne, Wilhelm (1877). «Über das Verhalten verschiedener organisirter und sog. ungeformter Fermente» [On the behavior of various organized and so-called unformed ferments (Sobre el funcionamiento de varios fermentos organizados, considerados aún no formados)]. Verhandlungen des naturhistorisch-medicinischen Vereins zu Heidelberg. Neue Folge [nueva serie] (en alemán) (Heidelberg) 1: 194-198.
-Liu, KeShun (2012-12-06). Soybeans: Chemistry, Technology, and Utilization. Springer. ISBN 978-1-4615-1763-4.
-Ma W, Tang C, Lai L. Especificidad de tripsina y quimotripsina: correlación dinámica controlada por el movimiento del bucle como determinante. Biophys J. 2005; 89 (2): 1183-93. doi: 10.1529 / biophysj.104.057158
-Mathews, C. K.; Van Holde, K.E et Ahern, K.G (2003). Bioquímica (3 edición)
-Miller PC, Bailey SP, Barnes ME, Derr SJ, Hall EE. Los efectos de la suplementación con proteasa en la función del músculo esquelético y DOMS después de correr cuesta abajo. J Sports Sci. 2004; 22 (4): 365-72. doi: 10.1080 / 02640410310001641584October 2003, David Goodsell
-Olsen, Jesper V.; Ong, Shao-En; Mann, Matthias (2004-06). «Trypsin Cleaves Exclusively C-terminal to Arginine and Lysine Residues». Molecular & Cellular Proteomics (en inglés) 3 (6): 608-614. doi:10.1074/mcp.T400003-MCP200. Consultado el 6 de septiembre de 2021.
-Ozawa, K., & Laskowski Jr, M. (1966). The reactive site of trypsin inhibitors. Journal of Biological Chemistry, 241(17), 3955-3961.Patricia JJ, Dhamoon AS. Fisiología, digestión. [Actualizado el 7 de julio de 2019]. En: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2019 enero.
-Rick, W. (1974). Trypsin. In Methods of enzymatic analysis (pp. 1013-1024). Academic Press.
-Santiago García, R. (2000). Inhibidores de serinproteasas: estudios estructurales de complejos tripsina-inhibidor.
-Shah D, Mital K. El papel de la tripsina: quimotripsina en la reparación de tejidos. Avances en terapia. 2018; 35 (1): 31-42. doi: 10.1007 / s12325-017-0648-a
-Shaw PC. El uso de una formulación de tripsina-quimotripsina en fracturas de la mano. Br J Clin Pract. 1969 1 de enero; 23 (1): 25-6.
Silverman, Gary A.; Bird, Phillip I.; Carrell, Robin W.; Church, Frank C.; Coughlin, Paul B.; Gettins, Peter G.W.; Irving, James A; Lomas, David A.; Luke, Cliff J.; Moyer, Richard W.; Pemberton, Philip A.; Remold-O’Donnell, Eileen; Salvesen, Guy S.; Travis, James; Whisstock, James C. (2001). «The Serpins Are an Expanding Superfamily of Structurally Similar but Functionally Diverse Proteins». Journal of Biological Chemistry. American Society for Biochemistry and Molecular Biology (Elsevier). 276 (36): 33293–33296. doi:10.1074/jbc.r100016200. ISSN 0021-9258. PMID 11435447. S2CID 18684515.
-Silzel, J. W., Ben-Nissan, G., Tang, J., Sharon, M., & Julian, R. R. (2022). Influence of Asp Isomerization on Trypsin and Trypsin-like Proteolysis. Analytical Chemistry, 94(44), 15288-15296.
-Sistema de salud de Nemours Children. Estudio observacional prospectivo a largo plazo de la incidencia de la colonopatía fibrosante.
-Smith, C., Van Megen, W., Twaalfhoven, L., & Hitchcock, C. (1980). The determination of trypsin inhibitor levels in foodstuffs. Journal of the Science of Food and Agriculture, 31(4), 341-350.
-Trypsin (Huber, R., & Bode, W. (1978). Structural basis of the activation and action of trypsin.
-Wirnt, R. (1965). Trypsin. In Methods of enzymatic analysis (pp. 807-818). Academic Press.


