Virus oncolíticos como nueva terapia frente al cáncer
Realizado por Natalia López Escobar y Pablo Martín Valenzuela.
Biología molecular. 3º Biología Sanitaria. Grupo C.
1. Introducción
Actualmente, existen diversas terapias frente al cáncer, por un lado, las tradicionales, donde encontraríamos la quimioterapia, la cirugía y la radioterapia; y por el otro, las de nueva incorporación, donde nos encontraríamos la terapia dirigida, la inmunoterapia y la terapia hormonal láser entre otras.
Una de las líneas de investigación más recientes frente al cáncer es el uso de virus oncolíticos. Estos virus son modificados genéticamente para reconocer al cáncer e infectarlo. Gracias a esto, no sólo conseguimos que las células del tumor infectadas mueran, si no que permite, además, una activación del sistema inmune del hospedador. Al lisar a las células tumorales, se liberan antígenos que serán reconocidos por células del sistema inmune que activarán la respuesta inmune.
1.1. El cáncer
El cáncer es un conjunto de enfermedades que se presentan cuando las células se multiplican sin control y se diseminan a los tejidos que los rodean. Las características que deben cumplir las células para ser consideradas células tumorales fueron descritas en 2011 por Hanahah y Weinberg (1 y 2). Estas características son:
- Autosuficiencia de señales de crecimiento, es decir, no necesitan señales externas para crecer.
- Insensibilidad a señales antiproliferativas.
- Evasión de la apoptosis.
- Adaptación metabólica.
- Inmortalización, mediante el alargamiento de los telomeros
- Capacidad de invasión y angiogénesis, es decir, capacidad de crear nuevos vasos sanguíneos.
- Capacidad de colonización de otros tejidos (metástasis).
- Evasión de la respuesta inmune

1.2. Los virus oncolíticos
La idea de que los virus pueden ser utilizados contra el cáncer no es novedosa, proviene de mediados del siglo XX, cuando se observaron, en pacientes con linfomas y leucemias, remisiones del tumor, coincidentes con infecciones por virus, como el de la hepatitis o el del sarampión (3). Se empezó entonces a probar la infección de pacientes oncológicos con virus. No tuvo la eficacia esperada y además, se encontraron muchos efectos secundarios causados por los virus, de modo que se detuvo la investigación (4).
Ahora, gracias a los avances de la ingeniería genética, se han podido desarrollar virus oncolíticos más seguros y específicos frente a determinados tipos de tumores.
2. Mecanismos moleculares de acción
Los virus oncolíticos son capaces de infectar células anormales a través de dianas celulares específicas: Transcriptasa inversa de telomerasa humana, antígeno específico de próstata, ciclooxigenasa-20, her2/neu…
- La Transcriptasa inversa de telomerasa humana o hTERT, es una subunidad catalítica de la enzima Telomerasa. La telomerasa es una polimerasa ribonucleoproteica, que mantiene los extremos de los telomeros. No puede ser considerado un protooncogén, ya que su mutación por sí sola no induce el crecimiento. Si que es importante su papel en la inmortalización de las células tumorales. La mutación en el promotor de hTERT confiere una mayor agresividad al melanoma (5)
- HER2/neu: es un tipo de HER (Human EGF Receptor). Es un receptor con actividad Tyr quinasa, que tiene como ligando EGF (Epidermal Growth Factor). HER2 tiene un peculiaridad, ya que presenta la capacidad de activarse sin necesidad de ligando. Se ha visto su sobreexpresión hasta en el 30% de los cánceres de mama. (6 y 7)
Una vez hemos visto ejemplos de algunas dianas que pueden usar los virus para reconocer a las células tumorales, podemos ver los mecanismos que producen la muerte del tumor. La infección viral provoca, en primer lugar, la lisis de células tumorales. Las células dendríticas, reconocen antígenos virales y estimulan la producción de Interferon de tipo I, factor de necrosis tumoral alfa. (TNF-α) y citoquinas como la interleucina 2 (IL-2). El TNF-α regula la expresión del complejo de histocompatibilidad, e influye positivamente en la acción de la enzima caspasa y contribuye a la apoptosis celular en algunos tumores. Además, está molécula está relacionada con la activación de los linfocitos T citotóxicos y las células NK. Por lo tanto, conseguimos la muerte de las células tumorales mediante dos modos: por un lado, la lisis celular provocada por el ciclo de infección del virus. (8)
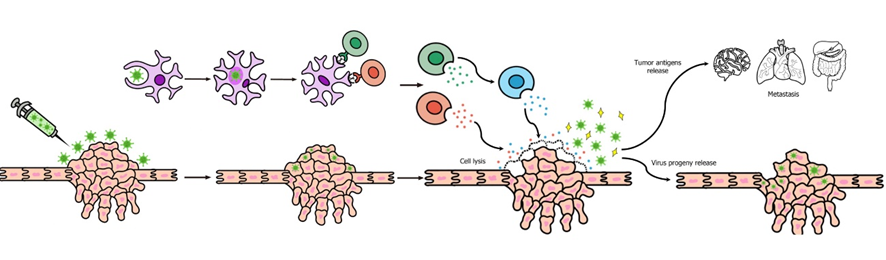
Una de las principales ventajas que supone el uso de virus oncolíticos es que podría inducir regresión en casos de metástasis (que representan la mayor parte de las muertes por cáncer) ya que, al provocar la lisis celular, salen nuevas partículas virales que pueden viajar hacia zonas lejanas donde haya metástasis. Pero el mecanismo más importante son las nuevas respuestas inflamatorias, que se producen cuando se lisan las células tumorales y salen antígenos al exterior. Estas nuevas respuestas inflamatorias, unidas a la memoria inmune celular, pueden provocar la regresión de las metástasis. (8)
Uno de los virus oncolíticos más prometedores es el CTV-m7, el cual incrementa la acción citotóxica sobre el tumor y es capaz de lisar células metastásicas. Se ha probado su uso en cánceres de próstata y ha demostrado efectividad (9).
Hay un único virus oncolítico aprobado por la FDA, es el T-VEC (Imlygic®), que es el virus del herpes simple (VHS), modificado para atacar a las células cancerígenas del melanoma.
3. Virus de la Enfermedad de Newcastle como nueva aproximación terapéutica para el glioblastoma
3.1. Introducción
Vamos a poner un ejemplo de un estudio que se realizó sobre el virus de la enfermedad de Newcastle, para ver si es adecuado para usarlo como virus oncolítico y como terapia para el glioblastoma.
3.1.1. Glioblastoma (GBM)
El glioblastoma es el tumor cerebral más común en el SNC, siendo muy agresivo debido a su invasividad y alta proliferación. Las personas que lo padecen tienen una esperanza de vida muy corta una vez que se diagnostica, a pesar de la mejora de los tratamientos y establecimiento de terapias.
Este tumor, compuesto por células madre de glioma (GSCs), presenta resistencia a diferentes tratamientos contra el cáncer, como la quimio o la radioterapia, ya que estas células son capaces de autorrenovarse y diferenciarse (10). Las GSCs se cree que también son las causantes de la recurrencia del glioblastoma.
Los rasgos más característicos de este cáncer son la proliferación microvascular y la necrosis, es decir, se agrupan en capas y las células presentan la zona central con necrosis (11).
3.1.2. Virus de la Enfermedad de Newcastle (NDV)
Es un virus aviar, con propiedades oncolíticas e inmunoestimuladoras, por lo que su estudio en viroterapia y ensayos clínicos cada vez es mayor.
El genoma de este virus consiste en una molécula de ARN monocatenario, con polaridad negativa y formada por dos regiones en los extremos, leader en 3’ y tráiler en 5’, no codificantes; y seis genes que codifican 6 tipos de proteínas diferentes (12).
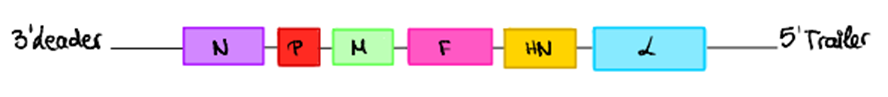
Infecta células y se replica en ellas, destruyéndolas. Esto lo hace más rápido en las células cancerosas humanas, de ahí el interés en su estudio como tratamiento para el cáncer. Presenta dos cepas: las cepas líticas, que dañan la membrana de la célula; y las cepas no líticas que bloquea el metabolismo de la célula. Las cepas líticas son las que se estudian para el cáncer, ya que son capaces de eliminar directamente las células cancerosas; pero las dos cepas se usan en vacunas que ayudan al sistema inmune a combatir el cáncer (13).

Los cultivos que se realizaron con GSCs y rNDV muestran como este virus afecta a la viabilidad de las células del tumor, induciendo apoptosis.
3.2. Glioblastoma: aspectos moleculares y patología
Las vías de señalización, moléculas y genes más comúnmente afectadas en el GBM, que hacen que sea resistentes a los tratamientos convencionales (14), son:
- Receptores tirosina/quinasa (RTK): se encuentran en la membrana plasmática. Se autofosforilan en presencia de ligando para activarse. Se encargan de activar vías de transducción que continúan con vías de transcripción de genes que regulan el ciclo celular.
- Vía de PI3K/AKT/mTOR: PI3K activa a AKT y este activa a mTOR, relacionado con la supervivencia y el ciclo celular.
- Señalización de RAS/MAPK: genes transcritos por vías de traducción llevadas a cabo por segundos mensajeros (oncogenes o genes supresores de tumores), que participan en la proliferación celular. RAS es una GTPasa que actúa en la transducción de señal de RTK. Cuando se activan RTK, se activa RAS, que a su vez activa la vía de transducción de las MAPK. Las mutaciones en RAS la activan permanentemente, activando también permanentemente la vía de las MAPK. Esto induce una transcripción activa de genes relacionados con el ciclo celular.
- P53 y retinoblastoma (RB): implicadas en regulación del ciclo celular. P53 es un gen supresor que se encarga de inducir apoptosis cuando el ADN está dado. Si p53 está mutado, se sigue con el ciclo celular y el daño en el ADN. También inhibe a mTOR, relacionado con el ciclo celular. El retinoblastoma está relacionado con la mutación de pRb, que hace que no se una a E2F y se siga con el ciclo celular.
- Gen EGFR: es el gen del receptor del factor de crecimiento epitelial (GFR). Si está alterado, se hace independiente de EGF, por lo que se activa a muy bajas concentraciones de ligando.
3.3. NDV como agente oncolítico
En 1965 observó por 1ª vez que NDV presentaba un efecto antitumoral y baja neuroafinidad. Este potencial oncolítico que presenta el virus se debe a su propia capacidad de replicarse bastante mejor (unas 104 veces mejor) en las células tumorales que en las células normales, y además, sin afectar a las células sanas. Además, al ser un virus aviar, sus cepas virulentas provocan solo síntomas leves.
3.3.1. Mecanismo de oncólisis de NDV
NDV se asocia principalmente a la inducción de la apoptosis. La apoptosis es un tipo de muerte celular programada que ocurre en todos los tipos celulares. Además, también puede provocar necroptosis, que es un tipo de muerte celular que tiene características tanto de necrosis (por la morfología de las células) como de apoptosis (por lo de programada). También puede inducir la muerte celular por autofagia.
La infección por este virus induce la activación de la respuesta inmune, favoreciendo su efecto oncolítico. Las células tumorales infectadas presentan Ag virales, haciendo que las células de alrededor liberen citoquinas, que activan a macrófagos, NK y o monocitos, provocando la respuesta inmune innata; o haciendo que se activen las células presentadoras de Ag, que activan a los linfocitos T citotóxicos, que activarán la respuesta inmune adaptativa. Todo esto activa el estado de actividad inmunológica antitumoral causando la muerte celular inmunogénica de las células tumorales (15).
El genoma de este virus es muy fácil de modificar, por lo que la técnica de genética inversa es útil para obtener virus recombinantes, teniendo como objetivo aumentar su eficacia antitumoral.
Se han estudiado sus propiedades oncolíticas, dando en algunos casos reducción parcial y en otros total del tumor.
3.4. Resultados
La tesis concluye que el NDV induce cambios en la viabilidad de las GSCs, demostrando la capacidad oncolítica del virus en diferentes tipos de líneas celulares tumorales, incluidas las líneas tumorales de glioma. Además, interfiere en el crecimiento celular de las GSCs, y provoca la inducción de la apoptosis de las diferentes líneas celulares.
En cuanto a os xenotransplantes, también se observó que se reduce el tamaño de los tumores xenotransplantados en ratones Nude. Finalmente se demostró que en los ratones inmunodeprimidos, el virus causa 100% de mortalidad, siendo seguro solo para los ratones inmunocompetentes. Lo que puede suponer una importante limitación en el uso farmacológico del virus de la enfermedad de Newcastle.
4. Conclusión
Nos ha parecido un trabajo interesante y además hemos aprendido muchas cosas que no sabíamos y que nos han gustado mucho. Creemos que la investigación y el estudio de los virus como terapia para el cáncer es algo muy importante y que podría funcionar muy bien para solucionar el problema que provoca esta enfermedad. Si es verdad que aún queda mucho por avanzar, pero creemos firmemente, que de aquí a unos años esta nueva terapia será una opción más para combatir el cáncer.
5. Bibliografía
1. The Hallmarks of CancerHanahan D, Weinberg RCell (2000) 100(1) 57-70
2. Conociendo y comprendiendo la célula cancerosa: Fisiopatología del cáncer Catherine Sánchez N. Revista Médica Clínica Las Condes (2013) 24(4) 553-562
3. Studies in Hodgkin’s syndrome; the association of viral hepatitis and Hodgkin’s disease; a preliminary report. HOSTER H, ZANES R, VON HAAM E. Cancer research (1949) 9(8) 473-80
4. Clinical studies of viruses as antineoplastic agents with particular reference to Egypt 101 virus. SOUTHAM C, MOORE A Cancer (1952) 5(5) 1025-34
5. Telomerase reverse transcriptase promoter mutations in primary cutaneous melanoma Heidenreich B, Nagore E, Rachakonda P, Garcia-Casado Z, Requena C, Traves V, Becker J, Soufir N, Hemminki K, Kumar R. Nature Communications (2014) 5(1) 3401
6. Homeostasis celular: crecimiento celular y cáncer – Bioquímica médica Michie, Alison M.; Paunovic, Verica; Harnett, Margaret M.; Bioquímica médica, Capítulo 28, 397-415
7. Introducción a la anatomía patológica – Wheater. Anatomía patológica O’Dowd, Geraldine, BSc(Hons), MBChB(Hons), FRCPath; Bell, Sarah, BSc Med Sci(Hons), MBChB(Hons), DipFMS, FRCPath; Wright, Sylvia, BSc(Hons), MBChB(Hons), FRCPath, DipFMS, PG Cert Mol Path; Wheater. Anatomía patológica, 1, 2-11
8. Santos Apolonio J, Lima de Souza Gonçalves V, Cordeiro Santos ML, Silva Luz M, Silva Souza JV, Rocha Pinheiro SL, de Souza WR, Sande Loureiro M, de Melo FF. Oncolytic virus therapy in cancer: A current review. World J Virol 2021; 10(5): 229-255
9. Therapy of prostate cancer using a novel cancer terminator virus and a small molecule BH-3 mimetic Sarkar S, Quinn B, Shen X, Dash R, Das S, Emdad L, Klibanov AWang X, Pellecchia M, Sarkar D, Fisher P Fisher POncotarget (2015) 6(13) 10712-10727
10. Piper K, DePledge L, Karsy M, Cobbs C. Glioma Stem Cells as Immunotherapeutic Targets: Advancements and Challenges.
11. Ohgaki and Kleihues, 2013; Perry and Wesseling, 2016; Urbanska et al., 2014
12. Marcos et al., 2005; Triosanti et al., 2018
13. Csatary LK, Eckhardt S, Bukosza I, Czegledi F, Fenyvesi C, Gergely P, Bodey B, Csatary CM. Attenuated veterinary virus vaccine for the treatment of cancer. Cancer Detect Prev. 1993;17(6):619-27.
13. Csatary LK, Moss RW, Beuth J, Töröcsik B, Szeberenyi J, Bakacs T. Beneficial treatment of patients with advanced cancer using a Newcastle disease virus vaccine (MTH-68/H). Anticancer Res. 1999 Jan-Feb;19(1B):635-8.
14. Crespo et al., 2015; Szopa et al., 2017
15. Matveeva et al., 2015; Zamarin and Palese, 2012ª
16. Virus de la Enfermedad de Newcastle como nueva aproximación terapéutica para el Glioblastoma, Rubio S (2018) 24-43


 Entrada anterior
Entrada anterior Entrada siguiente
Entrada siguiente
Es conveniente tener en cuenta que el virus constituye un reino de la Naturaleza independiente, con un comportamiento muy disímil en si mismo; y su comportamiento poco controlado se debe a que además de mutar, su encapsidamiento es una partícula cuántica compuesta que se mueve con una inteligencia selectiva. Esto indica que su tratamiento para el caso de los virus nocivos o letales, es el mismo virus como lo llaman en este documento: virus oncológico. Felicitaciones por ese atrevimiento hipotético. Por ahí es el curso de la investigación.