La fosfoglicerato mutasa, ¿de la glucólisis a la intolerancia al ejercicio físico?
Elizabeth Cairós Escobar. Biología Sanitaria, UAH.
INTRODUCCIÓN
La fosfoglicerato mutasa (PGM) se trata de una enzima que interviene en el metabolismo de carbohidratos. Este comprende, dentro de los mecanismos de degradación (es decir, catabolismo), los procesos de la glucólisis y la glucogenólisis, que destacan como los principales, aunque la enzima metabólica que vamos a tratar hace presencia en el primero de los dos procesos mencionados. Por esta razón, ¿sabemos lo qué es la glucólisis?
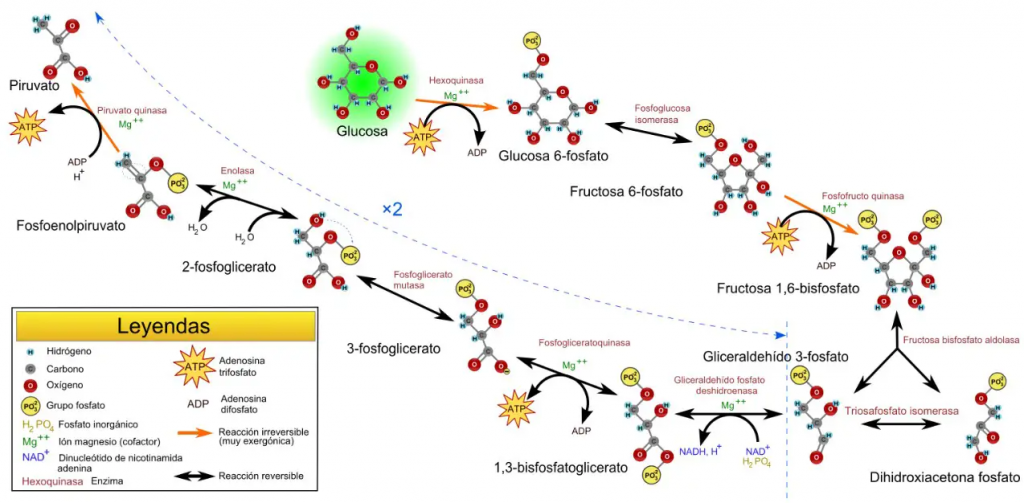
La glucólisis se trata de un proceso metabólico, que cuenta con diez etapas, en el que se transforman moléculas de glucosa en piruvato. Forma parte del catabolismo central de la glucosa y, como resultado, se obtienen dos moléculas de piruvato por cada molécula de glucosa transformada.
Del mismo modo, este proceso genera, de manera anaerobia, dos moléculas de energía en forma ATP, a partir de dos de ADP, y dos moléculas de poder reductor en forma de NADH, a partir de dos de NAD+.
Concretamente, la PGM cataliza el octavo paso de este proceso.
PAPEL BIOLÓGICO Y FUNCIONAMIENTO DE LA PGM
Como se indicó en el apartado introductorio, la fosfoglicerato mutasa es una enzima presente en el proceso metabólico de la glucólisis y es la encargada de la conversión de moléculas de 3-fosfoglicerato (3PG) en moléculas de 2-fosfoglicerato (2PG). Además, es importante señalar que esta transformación se lleva a cabo mediante un intermediario metabólico, que se trata del 2,3-bisfosfoglicerato.
3-fosfoglicerato + PGM-P ⇌ 2,3-bisfosfoglicerato + PGM ⇌ 2-fosfoglicerato + PGM-P
Pero, ¿cuál es el verdadero funcionamiento de la PGM y cómo ocurre la reacción?
Si hablamos de manera amplia y general, la principal función de esta enzima es desplazar el fosfato hacia un lugar clave en el centro de la molécula de 3PG, con la finalidad de contribuir al proceso final de obtención de energía que, recordando, se da en forma de ATP. De igual forma, incidir en que esta translocación ocurre, concretamente, del tercer carbono de la molécula al segundo, y da como resultado la formación de 2-fosfoglicerato.
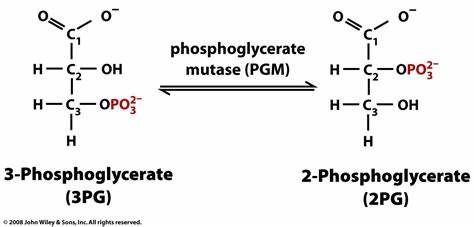
Sin embargo, si se profundiza más en el funcionamiento de la PGM, el proceso de conversión del que se encarga se lleva a cabo mediante la isomerización irreversible del 3PG y la intervención de un cofactor que, en este caso, se trata del Mg+2. Asimismo, esta reacción de conversión ocurre en dos etapas.
Primeramente, la fosfoglicerato mutasa, que ha sido previamente fosforilada en un sobrante del aminoácido histidina, cede dicho fosfato al grupo hidroxilo (OH–) del carbono en la posición 2 del 3PG. De esta manera, se genera el 2,3-bisfosfoglicerato (el intermediario metabólico de la reacción).
Seguidamente, en el segundo paso de la conversión, la molécula de 2,3-bisfosfoglicerato le transfiere a la enzima su fosfato del carbono 3, obteniéndose como resultado tanto la liberación de la PGM fosforilada de nuevo como el producto final de la reacción que esta enzima cataliza (la molécula de 2-fosfoglicerato).
Por otro lado, y como información adicional, ya una vez la fosfoglicerato mutasa sea poseedora del fosfato adicional (el cedido por la molécula de 2,3-bisfosfoglicerato), esta queda activa por un breve periodo de tiempo, de apenas dos minutos. Durante este corto intervalo realiza su función en repetidas ocasiones antes de que pierda el fosfato y, por consecuente, tenga que ser suministrado de nuevo
ESTRUCTURA DE LA ENZIMA
La estructura de la PGM no es común a todos los organismos (depende de la especie a la que se esté haciendo referencia), ya que puede adoptar formas variables y diferir en el número de subunidades que la forman. Estas subunidades pueden ser del tipo M o B y cuentan con una localización concreta en los tejidos, aunque puede variar durante el desarrollo del individuo.
En el caso de los humanos, la enzima fosfoglicerato mutasa está formada por dos subunidades idénticas, pero se puede observar en las imágenes inferiores que en otros seres vivos esto no es así.
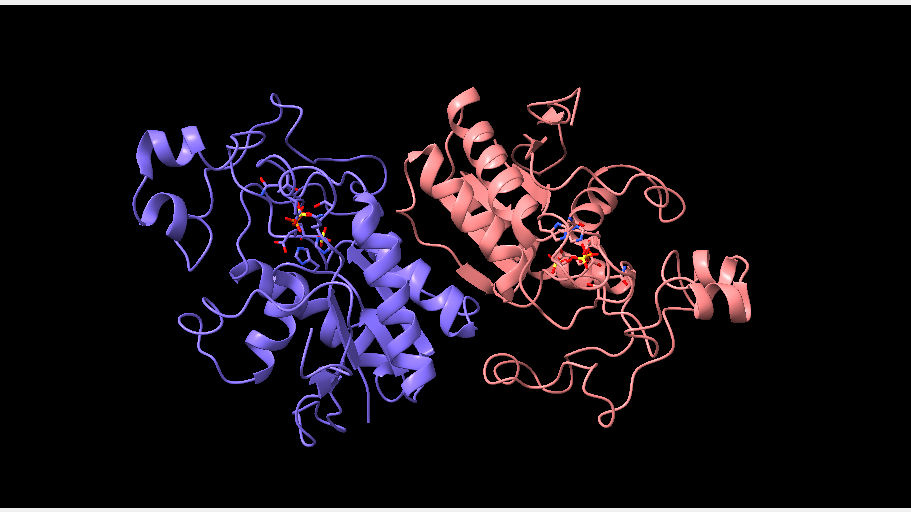
*La fosfoglicerato mutasa de levadura (PDB 3PGM), al igual que la de humanos, está compuesta por subunidades idénticas, aunque en el primero de los casos cuenta con 4 subunidades.
Aún así, la PGM en el filo de los mamíferos cuenta con 3 isoenzimas (enzimas que son diferentes en cuanto a su secuencia de aminoácidos, pero que catalizan la misma reacción), cuyo origen recae en las diferentes maneras de unión de las subunidades de la enzima.
Por otro lado, para su funcionamiento, esta enzima, en las células humanas, utiliza una molécula especial del aminoácido histidina que es el que, como se señaló anteriormente, coloca el fosfato, después de haber sido extraído, en el lugar específico de la enzima.
No obstante, la fosfoglicerato mutasa hace, en realidad, la acción contraria a la histidina, ya que incorpora un fosfato a la molécula de 3PG (para que se una al otro que ya posee dicha molécula) y luego se encarga de quitarlo.
Como es lógico, para añadir dicho fosfato la PGM primero tiene que hacerse con él, por lo que la 2,3-bisfosfoglicerato es la molécula intermedia encargada de suministrárselo.
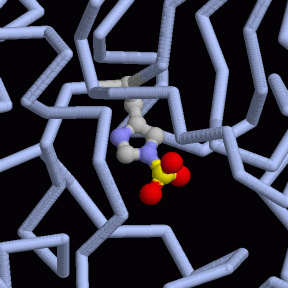
Asimismo, la PGM posee un átomo de Mg+2 como cofactor.
IMPORTANCIA DE LA PGM EN CUANTO AL EJERCICIO FÍSICO
Hasta ahora se ha hecho referencia a la fosfoglicerato mutasa y a su implicación en el metabolismo de azúcares, más concretamente en la glucólisis, mas ¿cuál es su relación con la actividad física?
Partiremos de la base de que, si se dan déficits en enzimas relacionadas con el metabolismo lipídico y de azúcares a causa de la herencia de enfermedades genéticas autosomales recesivas, se pueden desarrollar enfermedades conocidas como miopatías metabólicas.
Las miopatías metabólicas conllevan la manifestación de frecuentes crisis de mialgias (conocidas popularmente como dolores musculares), calambres y rigidez en los músculos. Este último síntoma se traduce en una difícil contracción muscular, causada por la disminución energética tras la reducción del trifosfato de adenosina (TFA) o adenosín trifosfato (ATP), un nucleótido imprescindible en la obtención de energía en las células, mediante la fosforilación oxidativa en la mitocondria.
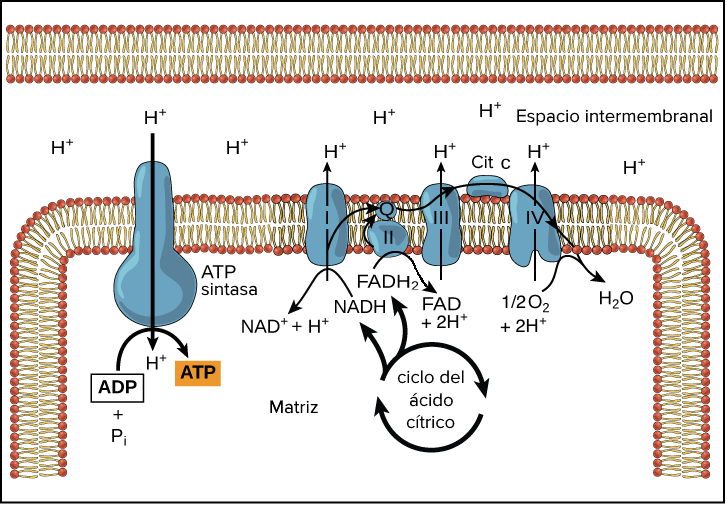
Los déficits enzimáticos que causan estas miopatías metabólicas pueden deberse a fallos en el metabolismo de carbohidratos (normalmente producidos por ejercicio físico en periodos menores a 10 minutos y de elevada intensidad) o por trastornos en el metabolismo de lípidos (actividad física por más de 10 minutos de tiempo y de baja intensidad). Con esto, pondremos el foco de atención en los déficits enzimáticos causados por el primer tipo de fallos, ya que, como se ha visto a lo largo de toda esta entrada, la fosfoglicerato mutasa participa en la catálisis metabólica de azúcares.
Así, se tiene que los déficits enzimáticos a los que hacemos referencia pueden ser causados por la deficiencia de miofosforilasa (glucogenosis tipo V), fosfofructocinasa muscular (glucogenosis tipo VII), beta enolasa (glucogenosis tipo XIII), fosfoglicerato quinasa (glucogenosis tipo IX), fosfoglicerato mutasa (glucogenosis X) y/o lactato deshidrogenasa (glucogenosis tipo XI).
Generalmente, las miopatías causadas por estas enzimas comienzan a manifestarse en el periodo de la adolescencia y, en todas ellas, las concentraciones de creatina cinasa (CK), una sustancia que libera el cuerpo cuando se somete a un estrés físico considerable, varían y se elevan.
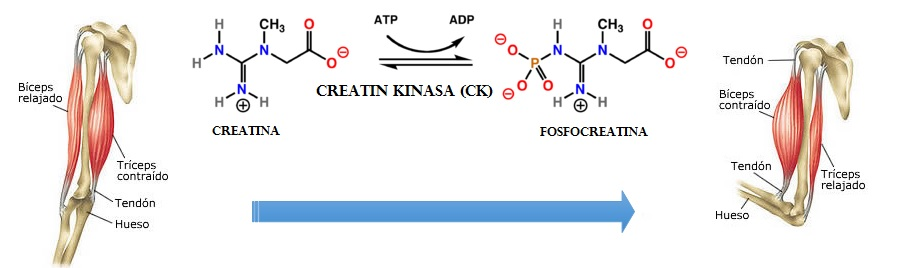
Por otro lado, y centrándonos exclusivamente en la fosfoglicerato mutasa, la deficiencia de esta enzima causa la que se denomina Enfermedad de almacenamiento de glucógeno (o glucogenosis tipo X). Se trata de una enfermedad no demasiado común que causa calambres musculares debido al ejercicio, la mioglobinuria (excreción de mioglobina en la orina a causa de una mioglobinemia procedente de la destrucción de la musculatura estriada, según el Diccionario Médico de la Clínica Universidad de Navarra) y la presencia de agregados tubulares durante biopsias en el músculo.
Estudios de investigación han concluido que en esta patología aumentan considerablemente los niveles de CK (y es que, en episodios de mioglobinuria aguda, los valores de la CK pueden elevarse hasta 200 veces más de los parámetros normales) y, por el contrario, no lo hacen los niveles de lactato.
A día de hoy no existe tratamiento farmacológico para esta enfermedad, sino que simplemente se trata con una buena hidratación, la toma frecuente de glucosa y la alcalinización de la orina. No obstante, hay una serie de medidas recomendadas para prevenir las crisis de calambres musculares, como evitar el ejercicio físico que las produzca y el ayuno, ya que ambos factores predisponen a su aparición.
Finalmente, el pronóstico de esta enfermedad es, por norma general, bueno (hay casos excepcionales en los que se produce una insuficiencia renal aguda por el aumento de mioglobina en sangre a causa de una rabdomiólisis – rotura o descomposición del tejido muscular – grave), aunque se recomienda el estudio de los polimorfismos de esta enzima para seguir recabando información sobre ella y permitir el avance de futuras investigaciones.
INFORMACIÓN EXTRA QUE TE PUEDE INTERESAR
Además de la implicación de la PGM en las miopatías metabólicas, también hay determinados estudios que han investigado las alteraciones de esta enzima y sus isoenzimas en tumores de distintos órganos.
A modo de breve resumen, estos estudios han determinado un descenso en la actividad de la fosfoglicerato mutasa en los tumores cerebrales y un incremento de la misma en los otros tipos de quistes.
Consulta el siguiente link para ir directamente a esta información: Actividad e isoenzimas de la fosfoglicerato mutasa. Alteraciones tisulares en los tumores humanos. Alteraciones sericas en el infarto de miocardio – Dialnet (unirioja.es).
Referencias
[1] de glúcidos. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . M., de la glucólisis. . . . . . . . . . . . . . . . . . . . . . . . . . . V. M. R. a. I., De la, M., Del, M., de Rapoport Luenering. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ., C., del arsénico. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T., de los polioles. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . V., de la glucosamina. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . V., & del glicerol. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . M. (s/f). Tabla de conntennidos. Edu.ar. Recuperado el 29 de enero de 2023, de http://rephip.unr.edu.ar/bitstream/handle/2133/11027/qbsp4-5.pdf?sequence=3
[2] Escribano, M. Z., & Soria Aznar, M. (s/f). Trabajo Fin de Grado POLIMORFISMOS GENÉTICOS EN EL METABOLISMO GLUCOLÍTICO RELACIONADOS CON LA FATIGA CANDIDATOS A SER ESTUDIADOS EN UNA MUESTRA DE DEPORTISTAS DE ÉLITE. Unizar.es. Recuperado el 29 de enero de 2023, de https://zaguan.unizar.es/record/57619/files/TAZ-TFG-2016-1007.pdf
[3] INSERM US14 — TODOS LOS DERECHOS RESERVADOS. (s/f). Orphanet: Enfermedad de almacenamiento de gluc�geno por deficiencia de fosfoglicerato mutasa. Orpha.net. Recuperado el 29 de enero de 2023, de https://www.orpha.net/consor/cgi-bin/OC_Exp.php?lng=ES&Expert=97234
[4] Mioglobinuria. (s/f). Cun.es. Recuperado el 29 de enero de 2023, de https://www.cun.es/diccionario-medico/terminos/mioglobinuria
[5] Molecule of the month: Glycolytic enzymes. (s/f). RCSB: PDB-101. Recuperado el 29 de enero de 2023, de https://pdb101.rcsb.org/motm/50
[6] Papazian, O., & Rivas Chacón, R. (2013). Miopatías metabólicas. Revista de neurologia, 57(S01), 65. https://doi.org/10.33588/rn.57s01.2013257
[7] Pich, N. D. (1997). Actividad e isoenzimas de la fosfoglicerato mutasa. Alteraciones tisulares en los tumores humanos. Alteraciones sericas en el infarto de miocardio. Universitat de Barcelona.
[8] Zerón, H. M., Morales, P. V., Salgado Alday, M. E., Mendieta, H., & Felipe, Z. (s/f). Mioglobinuria. Reporte de un caso y revisión de la literatura. Core.ac.uk. Recuperado el 29 de enero de 2023, de https://core.ac.uk/download/pdf/161648906.pdf
[9] (S/f). Azucareraprofesionales.es. Recuperado el 29 de enero de 2023, de https://www.azucareraprofesionales.es/wp-content/uploads/2018/04/Libro-Blanco-del-Azucar-Indice-Interactivo.pdf


