La enzima lactato deshidrogenasa constituye una de las proteínas más importantes de nuestro metabolismo.
Redactado por Lucía Blázquez y Yixuan Chai
La lactato deshidrogenasa (también conocida como LDH, EC 1.1.1.27) se trata de una enzima de la familia de las oxidasas y es dependiente de NAD+. Tiene un importante papel en cuanto a la producción de energía, donde actúa como una barrera o válvula de seguridad. Es una enzima esencial en las vías anaerobias metabólicas.
Su principal función se encuentra en el proceso celular de degradación de glucosa. Esta reacción requiere gran cantidad de oxígeno, de tal forma que, cuando el flujo de este gas es insuficiente, el conducto de producción de energía se detiene y entra en acción la LDH. Esta cataliza la transformación de piruvato en lactato y viceversa, mediante el proceso de oxido-reducción del NADH/NAD+.
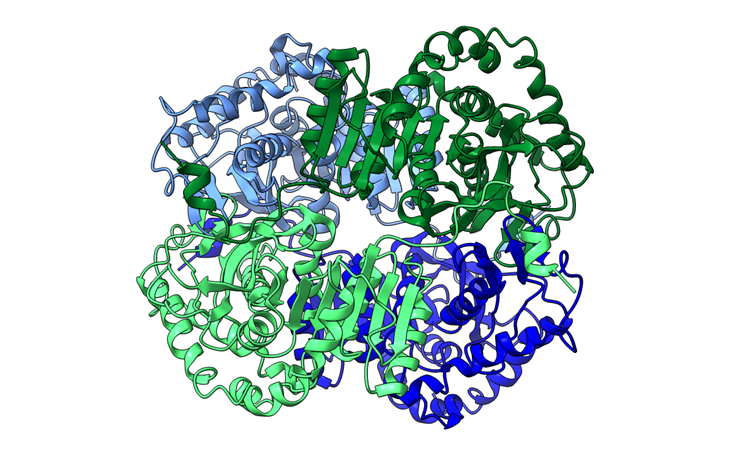
Se trata de una proteína tetramérica, conformada por dos tipos de subunidades: M (muscle) y H (heart). De la combinación de estas dos aparecen las cinco isoformas de la LDH:
- LDH 1 cuenta con cuatro subunidades H (4H), encontrándose mayoritariamente en el corazón.
- LDH 2 tiene tres subunidades H y una M (3H1M), situándose principalmente en el sistema reticuloendotelial.
- LDH 3 consiste en dos subunidades de cada tipo (2H2M), y se encuentra en los pulmones.
- LDH 4 está formada por una subunidad H y tres M (1H3M), muy presente en los riñones.
- Por último, la LDH 5 está compuesta por cuatro subunidades M (4M), y se localiza en el hígado y en el músculo esquelético.
Las cinco isoenzimas de la lactato deshidrogenasa son esenciales para su papel celular, ya que, aunque todas llevan a cabo la misma función, difieren en ciertas características que permiten una mayor regulación y control: afinidad con el sustrato, punto isoeléctrico…
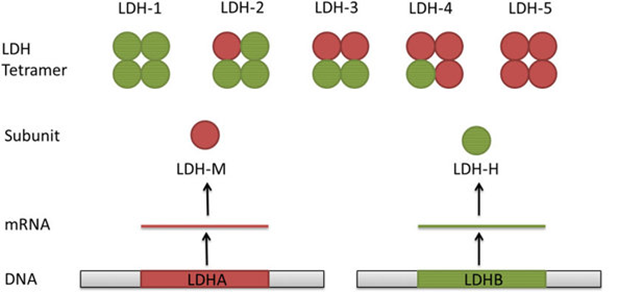
Las subunidades se diferencian tanto bioquímica como genéticamente. M y H (formalmente A y B), codificadas por LDH-A y LDH-B. Aunque sean similares en forma y tamaño, tienen diferentes propiedades enzimáticas. La subunidad M tiene mayor preferencia por la conversión de piruvato en lactato; la subunidad H, por otro lado, tiene mayor predilección por la reacción inversa.
Se ubica en el citoplasma de todas las células, y, en algunos casos, también puede encontrarse en las mitocondrias.
Se trata de una enzima alostérica, debido a su estructura cuaternaria. La fructosa 1,6- difosfato conforma uno de los activadores alostéricos de la proteína, siendo uno de los primeros productos formados en la glucólisis.
La función básica de la enzima es catalizar la transformación de lactato en piruvato, a través de una reacción de óxido-reducción en la que participa NADH. Constituye uno de los pasos finales de la hidrólisis de glucosa.

Las reacciones llevadas a cabo por la lactato deshidrogenasa envuelven complejos ternarios en los cuales los nucleótidos de piridina (NAD+/NADH) se unen primero y los sustratos más pequeños después. El nucleótido actuará como coenzima, de tal forma que en su ausencia la enzima no se unirá al sustrato y no se llevará a cabo el proceso.
En el hígado se producirá la oxidación de lactato en piruvato (con reducción del NAD+), gracias a que presenta una alta concentración de LDH5. En los músculos se llevará a cabo de forma inversa, gracias al alto contenido de LDH1.
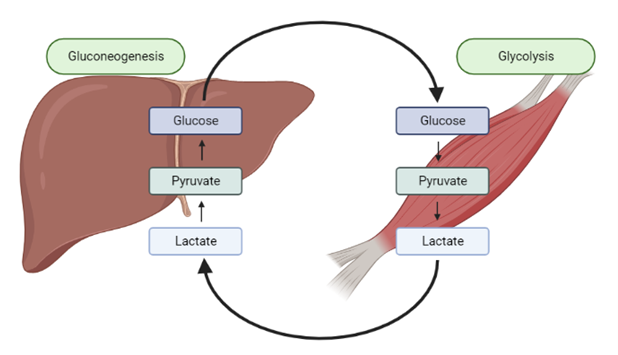
Esta reacción se asocia con la acidosis láctica, producida ante ejercicios físicos intensos donde nos encontramos ante una insuficiencia de oxígeno. Ante esta situación anaeróbica, el lactato generado en los músculos es transportado hasta el hígado, donde se lleva a cabo la gluconeogénesis. Así se obtiene energía de forma mucho más rápida, aunque muy reducida (2ATPs) en comparación a la conseguida en el proceso aerobio de la glucólisis (30-32 ATPs). Esto forma parte de los procesos conocidos como fermentaciones, en los cuales se produce una degradación anaerobia de la glucosa (u otros nutrientes) con el fin de obtener energía.
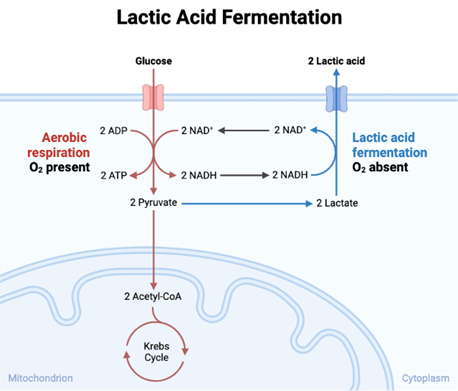
La LDH-1 juega un papel importante en el metabolismo energético de células tumorales, razón por la que su inhibición ha sido objeto de estudio durante años. Algunos compuestos orgánicos como el gosipol y galoflavina actúan como inhibidores de dicha isoenzima. Otra propuesta médica de la inhibición sería el tratamiento frente a la hiperxaluria primaria, ya que esta isoenzima cataliza la reacción de conversión de glioxalato en oxalato en los hepatocitos.
Además, se ha descubierto que la LDH también esta presente en invertebrados, bacterias y protozoos, por ejemplo, en los del género Plasmodium, los cuales son responsables de la enfermedad del paludismo o malaria. Por lo que sería de gran interés médico la inhibición de la LDH del Plasmodium falciparum (pfLDH).
Otro aspecto biomédico sería la determinación de las concentraciones de LDH en los líquidos biológicos que puede ser útil con fines diagnósticos, al igual que su determinación en plasma, que constituye un biomarcador de carácter pronóstico en oncología.
La presencia de altos niveles de LDH en sangre está relacionada con la existencia de células tumorales en algún tejido y, como consecuencia, a padecer algún tipo de cáncer tal como el de mama y de pulmón.
La LDH también funciona como una enzima ubiquitina que se encuentra en altas cantidades en las células que forman el hígado, riñón, miocardio y músculo esquelético. Juega un papel muy importante en el efecto Warburg (factor común de las células que tienen un gran potencial de convertirse en una célula tumoral) que consiste en el proceso por el cual la transformación de la glucosa en lactato pasa de ser un mecanismo aerobio a uno anaerobio.
Como las células cancerígenas dependen de la glucólisis, ya que necesitan la energía y los ácidos nucleicos para su proliferación y crecimiento. Las condiciones de hipoxia prevalecen en las células tumorales, de tal forma que la glucólisis anaerobia normalmente es acompañada de la acidificación de la célula.
La isoenzima que se expresa principalmente en las células cancerígenas es la LDH5, mientras que la concentración de LDH1 es menor en estas células que en tejidos normales.
PRÁCTICA
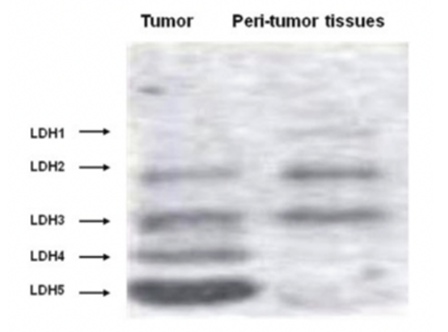
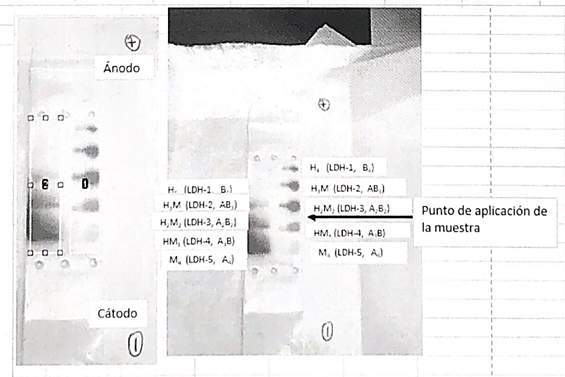
Los alumnos de 1º de Biología Sanitaria han realizado una práctica en la asignatura de Bioquímica acerca de las isoformas de la LDH. Se ha llevado a cabo a través de la electroforesis de esta proteína en acetato de celulosa.
El procedimiento ha consistido en la utilización de muestras de corazón y músculo esquelético para identificar la distribución de cargas (y, por tanto, las isoenzimas) de la LDH en estos tejidos.
Toda la práctica se fundamenta en la capacidad de ionización de los aminoácidos de las proteínas. El punto isoeléctrico (pI) se define como valor de pH ante el cual el aminoácido se encuentra en forma neutra, en estado Zwitterion. A un determinado pH, en este caso 8.6, aquellos aminoácidos cuyo pI sea menor estarán cargados negativamente, desplazándose hacia el ánodo, y viceversa, aquellos cuyo pI sea mayor estarán cargados positivamente y se desplazarán hacia el cátodo.
Se aplican dichas muestras en las tiras de acetato y se introducen en una cuba conectada a una fuente electroforética, cuya corriente continua es de 200 voltios, durante 30 minutos. Una vez pasado el tiempo, se procede a la revelación de las diferentes isoformas a partir de su tinción. Este proceso se basa en la reducción enzimática de NAD+ que se encuentra en una disolución reveladora, aportada por el profesor. Se obtendrán unos resultados similares a estos:
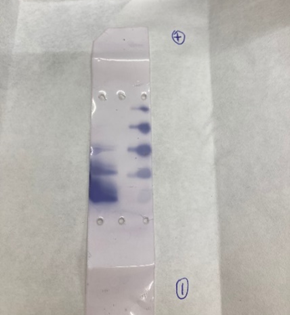
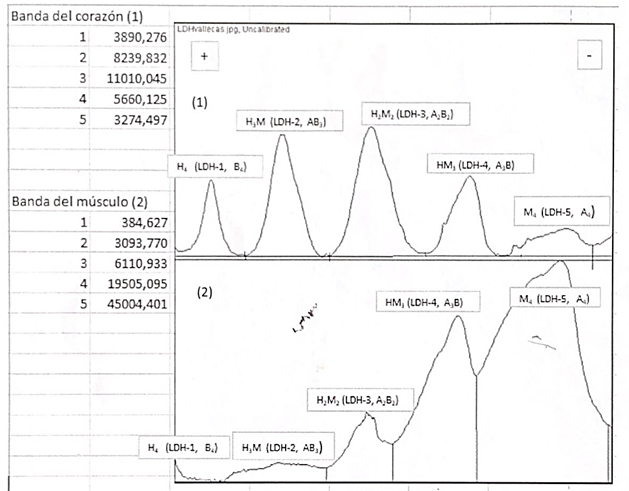
Utilizando los programas informáticos Scion Image y BioModelUAH, se pueden interpretar dichos resultados y conocer la proporción de cada isoforma de la LDH en los diferentes tejidos. Comprobando así la predominancia de LDH5 en el tejido muscular y de LDH3 en el corazón.
REFERENCIAS
[2]https://app.biorender.com/biorender-templates/t-61f95fffb86cec00a37c6b81-lactic-acid-fermentation Reprinted from «Lactic Acid Fermentation», by BioRender, December 2021, retrieved from https://app.biorender.com/biorender-templates/t-61f95fffb86cec00a37c6b81-lactic-acid-fermentation Copyright 2023 by BioRender.
[3] Jurisic, V., Radenkovic, S. y Konjevic, G. (2015). El papel actual de la LDH como marcador tumoral, aspectos bioquímicos y clínicos. Avances en biomarcadores de cáncer: de la bioquímica a la clínica para una revisión crítica, 115-124.
Miao, P., Sheng, S., Sun, X., Liu, J., & Huang, G. (2013). Lactate dehydrogenase A in cancer: a promising target for diagnosis and therapy. IUBMB life, 65(11), 904-910. https://iubmb.onlinelibrary.wiley.com/doi/full/10.1002/iub.1216
PDB-101: Educational resources supporting molecular explorations through biology and medicine. Christine Zardecki, Shuchismita Dutta, David S. Goodsell, Robert Lowe, Maria Voigt, Stephen K. Burley. (2022) Protein Science 31: 129-140 doi:10.1002/pro.4200
The RCSB PDB «Molecule of the Month»: Inspiring a Molecular View of Biology D.S. Goodsell, S. Dutta, C. Zardecki, M. Voigt, H.M. Berman, S.K. Burley (2015) PLoS Biol 13(5): e1002140. doi: 10.1371/journal.pbio.1002140
Molecule of the Month illustrations are available under a CC-BY-4.0 license. Attribution should be given to David S. Goodsell and the RCSB PDB. https://pdb101.rcsb.org/motm/102
The Protein Data Bank H.M. Berman, J. Westbrook, Z. Feng, G. Gilliland, T.N. Bhat, H. Weissig, I.N. Shindyalov, P.E. Bourne (2000) Nucleic Acids Research, 28: 235-242. doi:10.1093/nar/28.1.235
UCSF ChimeraX: Structure visualization for researchers, educators, and developers. Pettersen EF, Goddard TD, Huang CC, Meng EC, Couch GS, Croll TI, Morris JH, Ferrin TE. Protein Sci. 2021 Jan;30(1):70-82.
UCSF ChimeraX: Meeting modern challenges in visualization and analysis. Goddard TD, Huang CC, Meng EC, Pettersen EF, Couch GS, Morris JH, Ferrin TE. Protein Sci. 2018 Jan;27(1):14-25.
Farhana, A., & Lappin, S. L. (2022). Biochemistry, lactate dehydrogenase. In StatPearls [Internet]. StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK557536/
Brandt, R. B., Laux, J. E., Spainhour, S. E., & Kline, E. S. (1987). Lactate dehydrogenase in rat mitochondria. Archives of Biochemistry and Biophysics, 259(2), 412-422. https://www.sciencedirect.com/science/article/abs/pii/0003986187905078
Cárdenas Paredes, J. M. (2008). Identificación y caracterización de las isoenzimas de la LDH (lactato deshidrogenasa) durante el desarrollo tardío en alevinos de Onchorhyncus Mykiss en variedades importadas. https://repositorio.uniandes.edu.co/bitstream/handle/1992/23789/u303121.pdf?sequence=1
Marcial-Reyes, D. B. (2022). Exploración a la EC. 1.1. 1.27 Lactato Deshidrogenasa. https://repositorioinstitucional.buap.mx/handle/20.500.12371/16841
Valvona, C. J., Fillmore, H. L., Nunn, P. B., & Pilkington, G. J. (2016). The regulation and function of lactate dehydrogenase a: therapeutic potential in brain tumor. Brain pathology, 26(1), 3-17.
Jurisic, V., Radenkovic, S. y Konjevic, G. (2015). El papel actual de la LDH como marcador tumoral, aspectos bioquímicos y clínicos. Avances en biomarcadores de cáncer: de la bioquímica a la clínica para una revisión crítica, 115-124.
Álvarez Romero, M. (2020). REVISIÓN SOBRE INHIBIDORES DE LA ENZIMA LACTATO DESHIDROGENASA.
Goulabchand, R., & Guilpain, P. (2016). Anomalías biológicas frecuentes: lactato deshidrogenasa elevada. EMC-Tratado de medicina, 20(4), 1-5.
Holbrook, JJ, Liljas, A., Steindel, SJ y Rossmann, MG (1975). 4 lactato deshidrogenasa. En Las enzimas (Vol. 11, pp. 191-292). Prensa Académica.
Departamento de Biología de Sistemas, Universidad de Alcalá (2022) Titulo. Guion de prácticas de Bioquímica.


