Una mutación en la glucosa-6-fosfato dehidrogenasa y su influencia en la constante de Michaelis-Menten y la eficiencia catalítica de la enzima.
La glucosa-6-fosfato dehidrogenasa (G6PDH) es una enzima fundamental en el metabolismo central. Conecta la glucolisis con el metabolismo de los azúcares en el ciclo de las pentosas fosfato, a través de la oxidación de glucosa-6-fosfato a 6-fosfogluconolactona por NADP+. La reacción es una fuente de NADPH, que es un cofactor crucial en algunos procesos bioquímicos, como la recuperación del glutation, un pequeño péptido esencial para evitar daños por estrés oxidativo.
La recuperación de glutation es especialmente significativa en los glóbulos rojos, en los que esta reacción es su única fuente de NADPH. Si sus niveles se ven comprometidos, los glóbulos rojos se ven afectados por daño oxidativo y puede producirse anemia hemolítica
Esto puede tener lugar por deficiencia de la enzima G6PDH, que es, precisamente, una de las enzimopatías más comunes, afectando a casi 500 millones de personas en todo el mundo, principalmente en Africa, Peninsula Arábica y Sudeste Asiático. Se han descrito 230 mutaciones con relevancia clínica, principalmente hombres, al estar ligadas al cromosoma X. Las más graves producen anemia hemolítica y las menos severas producen hemolisis asociadas a tóxicos que producen estrés oxidativo o algunas toxinas, como las lectinas presentes en las judías.
La razón de esa distribución es que, curiosamente, la deficiencia de esta enzima confiere resistencia contra la malaria producida por el parásito Plasmodium falciparum. Entonces, en las zonas donde la enfermedad es endémica, las mutaciones de G6PDH proporcionan una ventaja evolutiva, prevaleciendo gradualmente sobra la enzima más activa, ya que el parásito requiere de ésta para su ciclo vital.
Mutación en la arginina 219
En el trabajo publicado en Nature Communications por Zgheib et al., se describe un caso muy interesante desde el punto de vista de la bioquímica estructural. Un joven paciente de 15 años sufrió hemolisis y pancitopenia tras una infección viral. Los autores estudiaron el caso y, tras ver en su historia que un tío suyo tenía deficiencia de G6PDH, llevaron a cabo el estudio bioquímico de la enzima.
Descubrieron una nueva mutación en la enzima, en la que una arginina en la posición 219 se había sustituido por una glicina. Esta mutación puede estar asociada a un cambio de un simple nucleótido, pues los codones de glicina y arginina sólo se diferencian en su primer nucleótido, siendo G para arginina y C para glicina.
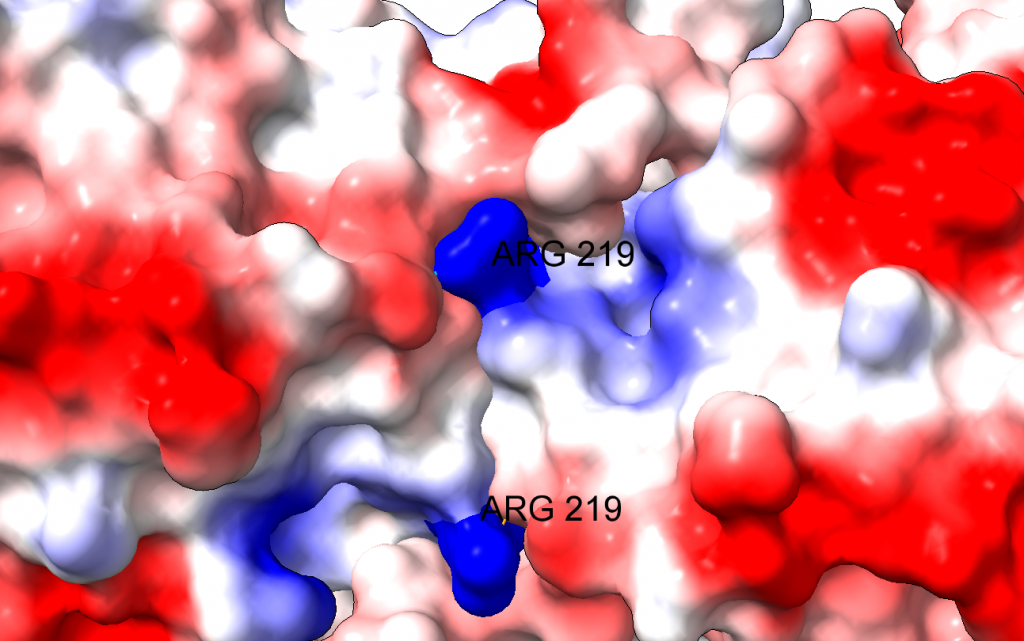
El problema es que el cambio de un aminoácido con carga como la arginina por un aminoácido neutro de pequeño tamaño como la glicina puede tener importantes implicaciones en la estructura de la proteína. En efecto, la arginina 219 estabiliza la estructura proteica, que es un dímero, a través de un puente de hidrógeno y de la carga positiva, por interacción electrostática. Al cambiar por la glicina, se pierden esas interacciones electrostáticas en una posición clave, desestabilizándose la estructura de la enzima y dificultando su acción catalítica. Los autores comprueban que, en efecto, la enzima mutante es mucho más sensible a la desnaturalización, debido a la desestabilización estructural. La enzima mutante pierde actividad a temperatura superior a 44ºC, mientras que la enzima WT (wild type, la enzima funcional normal) pierde actividad a temperaturas superiores a 50ºC.
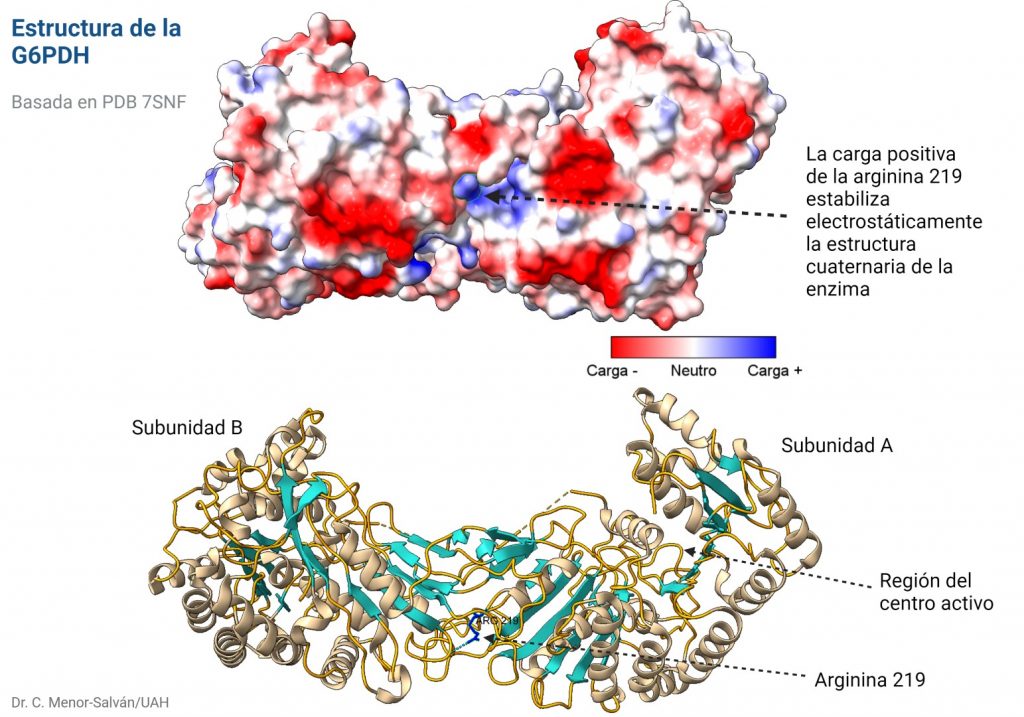
Es interesante que la arginina 219 no está en el centro activo de la enzima. Así, podemos explicar los datos experimentales de la actividad de la enzima que obtienen los autores:
- Km=49.5 µM para el sustrato (glucosa 6 fosfato) en la enzima WT
- Km=46.1 µM para el sustrato en la enzima con la mutación
- Kcat=326 s-1 para la enzima WT
- Kcat=6 s-1 para la enzima mutante.
¿que nos dicen estos resultados?. Que la enzima mutante muestra una constante de Michaelis-Menten similar a la WT para el sustrato glucosa-6-fosfato, por lo que no ha perdido afinidad por el sustrato; no es sorprendente, pues la mutación no afecta al centro activo y la unión sustrato-enzima no se ha visto afectada. Sin embargo, la enzima mutante ha perdido eficiencia catalítica. Recordemos que el Kcat o numero de turnover son los moles de sustrato que son transformados por mol de enzima y por segundo. Así, su actividad se ve enormemente reducida: la enzima WT es 54 veces más activa. Esto es debido, probablemente, por la dificultad de la enzima mutante para alcanzar un estado de transición energéticamente favorable, ya que la mutación condiciona el ajuste de la enzima con el sustrato y el cofactor.
Este caso ilustra bien la diferencia de significado entre las dos constantes fundamentales de la actividad enzimática y cómo la discusión teórica que realizamos en la clase de Bioquímica Estructural tiene gran relevancia práctica.
Referencias
Zgheib, O. et al. (2023) ‘Substitution of arginine 219 by glycine compromises stability, dimerization, and catalytic activity in a G6PD mutant’, Communications Biology. Springer US, 6(1), p. 1245. doi: 10.1038/s42003-023-05599-z.


