ESCUCHEMOS AL CROMOSOMA SILENCIOSO…
Irene Romero Baños y Paula Mª Ojeda Walczuk
3º Biología Sanitaria 2019/2020
Durante décadas, el silenciamiento del cromosoma X ha sido uno de los fenómenos epigenéticos más misteriosos en el mundo de la ciencia. Ningún científico era capaz de comprender cómo todas las células obtienen el mismo producto génico a partir de una dosis génica diferente de cromosomas sexuales en machos y hembras.
En la gran mayoría de los genes se da la expresión de los dos alelos, uno localizado en el cromosoma procedente del padre y otro, en el de la madre. Sin embargo, esto no es aplicable en los genes cuyos locus se sitúan en los cromosomas sexuales puesto que el número de cromosomas X e Y es diferente en machos (XY) y en hembras (XX).
La base de este conocimiento promovió la búsqueda del mecanismo a través del cual las células logran la compensación de la dosis génica, es decir, la obtención del mismo producto génico independientemente del número de cromosomas X presentes en el núcleo celular.1,2
En 1949, los investigadores M. Barr y E. Bertran fueron los primeros en observar unos corpúsculos muy condensados que no se correspondían con el nucleolo. Estos corpúsculos, hoy en día conocidos como “corpúsculos de Barr”, solo aparecen en núcleos de células somáticas de hembras y fueron denominados por ellos mismos como cromatina sexual.
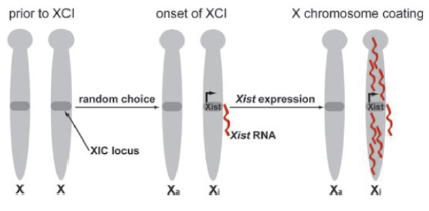
La procedencia de esta estructura continuó siendo objetivo de investigación hasta 1966, fecha en la que la científica Mary Frances Lyon propuso la conocida “Hipótesis de Lyon”. Según esta, dicha estructura aparece como consecuencia de la inactivación aleatoria de uno de los dos cromosomas X de las hembras, causando así su inactivación genética.
Actualmente, cada vez son mayores los conocimientos acerca del silenciamiento del cromosoma Xi (inactivo). De hecho, el descubrimiento de Lyon dio paso a numerosas investigaciones posteriores, obteniendo así el descubrimiento del gen responsable del silenciamiento aleatorio de uno de los cromosomas X, el gen Xist.3
RNA funcional: XIST, lionización del cromosoma X y corpúsculo de Barr
Durante el desarrollo temprano del cigoto, ambos cromosomas X se encuentran activos. Sin embargo, uno de ellos será inactivado aleatoriamente cuando las células totipotentes empiecen a diferenciarse;4 esto ocurre más específicamente durante el desarrollo del epiblasto.5,6
En este momento, todas las células somáticas del individuo presentan un cromosoma X inactivo. A pesar de que la observación de este acontecimiento sea mayoritaria en hembras también puede ocurrir en machos durante la espermatogénesis, aunque en este caso, el silenciamiento es llevado a cabo por mecanismos epigenéticos distintos a los que se observan en la embriogénesis7.
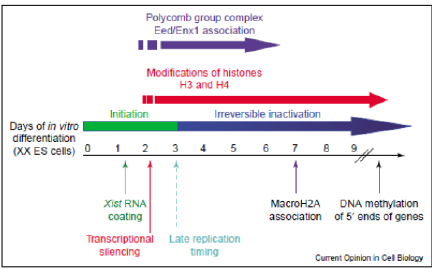
El proceso de inactivación del cromosoma Xi ocurre durante la embriogénesis temprana y en ella diferenciamos cinco fases. En primer lugar, ocurre el conteo, que verifica el número de cromosomas X por conjunto de autosoma en la célula hembra para así poder decidir cuál de los dos cromosomas inactivar, el X materno o paterno, en la segunda fase de la escongencia. La tercera fase es la de iniciación, la cual está controlada por el centro de inactivación del X o XIC. Su función es producir ARNs no codificantes que serán diferenciados mediante distintas modificaciones epigenéticas. Estas modificaciones forman parte de la siguiente fase, la extensión (“spreading”), ya que la señal se extiende por cis y trans desde el XIC en las dos direcciones del cromosoma. Finalmente, el mantenimiento. Esta última fase permite que el estado de inactivación conserve dichas marcas epigenéticas en las siguientes divisiones celulares.7,8,9
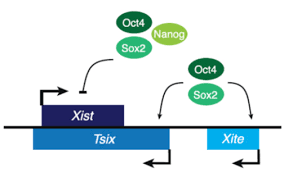
A pesar de que el locus XIC no sea esencial más allá de las primeras fases del proceso de inactivación10 presenta gran importancia en el silenciamiento transcripcional del cromosoma X. Esto se debe a que, entre los RNAs no codificantes que transcribe, da lugar al transcrito específico del X inactivo (XIST) y a un ARN antisentido que regula su expresión, denominado TSIX.11
El TSIX funciona como un represor antisentido de XIST y es expresado en el cromosoma X activado (Xa), de manera que puede bloquear el proceso. En cambio, en el cromosoma Xi es inactivado, produciéndose una sobreexpresión XIST que permite la inactivación del cromosoma.12 La sobreexpresión del gen Xist produce ARN de Xist que cubre el cromosoma provocando la iniciación de una cascada de modificaciones epigenéticas, como variaciones en el metabolismo; se han observado diferencias en el metabolismo de la glucosa entre blastocitos machos y hembras que han sido atribuidas al desbalance de la expresión de genes debido al cromosoma X.13 Así, todo este proceso culmina con la formación de la heterocromatina facultativa.
Hasta ahora, tan solo hemos hablado de dos RNAs no codificantes expresados por XIC. Sin embargo, la función de XIC sigue siendo aún más interesante:
Jpx y RepA son dos activadores de XIST, también expresados por XIC, cuya función es regular la diferenciación de las células embrionarias en diferentes tejidos y órganos.14 Estos, a su vez, están regulados por los factores de pluripotencia NANOG, SOX2 y OCT-4, que regulan negativamente la expresión de XIST uniéndose a su región promotora del gen. A su vez, van a regular positivamente al promotor de Xite y de TSIX, manteniendo la doble dosis génica en ambos cromosomas X15,16,17. Por ello, una de las funciones de TSIX es la de reducir la expresión de Jpx y RepA.
Para finalizar el proceso de la inactivación del cromosoma X y la formación del corpúsculo, se requieren algunas modificaciones que tendrán lugar en unas proteínas asociadas al DNA de gran importancia, las histonas. De esta forma, las histonas H3 sufren metilaciones en varias lisinas18 mientras que las histonas H4 se hipoacetilan. Además, es necesario la reclutación de las proteínas Polycomb, HP1 y la Macro H2A.19
Estas modificaciones suponen el inicio de un proceso irreversible en la inactivación del cromosoma Xi en células embrionarias, permitiendo su diferenciación. Finalmente, se hipermetilan regiones promotoras de un gran número de genes en el cromosoma Xi provocando el silenciamiento de los mismos.20
El resultado de este proceso es un cromosoma X inactivo cuya secuencia se encuentra hipermetilada, a excepción de la región del promotor del gen XIST, que está hipometilada permitiendo su expresión. Por su parte, un cromosoma X activado en su totalidad, salvo su gen XIST, que en este caso se presenta metilado para inhibir su expresión.21,22 Según Sado T, Okano M, Li E. y Sasaki H. la expresión adecuada de XIST en el cromosoma Xi es debido también a la ausencia de las enzimas ADN metiltransferasas.23
Por fin, este resultado nos permite entender cómo es posible el mantenimiento del proceso de inactivación en división de células somáticas.
Enfermedades y líneas de investigación
El cromosoma X contiene genes esenciales para el crecimiento y el desarrollo de los seres humanos y la mayoría de los mamíferos. La presencia de, al menos, un cromosoma X en el genotipo de cualquiera de estos organismos (macho y/o hembra) evidencia dicha importancia. Por el contrario, el cromosoma Y es más pequeño, con menor cantidad de genes y no es vital.
Las enfermedades ligadas al cromosoma X son aquellas producidas por alteraciones en genes contenidos en él. Como ya se ha dicho anteriormente, las hembras presentan dos copias del cromosoma X de tal forma que, si uno de ellos presenta un gen mutado, el gen normal del otro cromosoma puede compensar a la copia alterada. Si esto ocurre, la hembra será sana y portadora de la enfermedad ligada al cromosoma X. En cambio, las enfermedades ligadas al cromosoma X siempre se expresarán en machos, pues carecen de un segundo cromosoma X normal.25 Algunos ejemplos de este tipo de enfermedades son la hemofilia A y la distrofia muscular de Duchenne.
Con todo, realmente lo fascinante de este proceso, aún por descubrir, reside en la aleatorización de la inactivación del cromosoma X.
En la mayoría de los casos, cuando una hembra hereda un gen mutado del cromosoma sexual, el cromosoma silenciado será ese; así, queda inactivo y el cromosoma X sin mutar permanece activado. Pero, ¿cómo sabe la célula que es ese el que debe inactivar? Si bien, en aquella minoría de casos, como el Síndrome de Rett o el síndrome del X frágil, no ocurre así 26; la presencia de células con copias del cromosoma normal no es suficiente para compensar la ausencia de función en las células con el cromosoma X mutado activo.
A veces, resulta paradójico que la propia cura para la enfermedad ligada al cromosoma X se localice en la misma célula. Partiendo de la base de que la inactivación del cromosoma X está mediada por Xist, la síntesis de oligonucleótidos antisentido dirigidos de forma específica hacia este ARN no codificante expresado por el propio cromosoma inactivo, permite que se una a él, quedando este bloqueado y facilitando su degradación.
En este punto se abre una nueva área de investigación enfocada a la búsqueda de la reactivación del cromosoma X inactivo como aproximación para el tratamiento de enfermedades causadas por mutaciones en el cromosoma X como el síndrome de Rett.
Bibliografía
- Rastan S. X chromosome inactivation and the Xist gene. Current Opinion in Genetics & Development, 1994; 4(2):292-297.
- P Bitoun. Conseil génétique et médecine prédictive. Encycl Méd Chir (Elsevier, Paris), AKOS Encyclopédie Pratique de Médecine, 7–1040, 1998, 8 p.
- Rubén MG. Figuras de la genética: Mary Lyon y el silencio de los cromosomas. Genotipia, 2019.
- Epstein C.J., Smith S., Travis B., Tucker G. Both X Chromo- somes Function before Visible X Chromosome Inactivation in Female Mouse Embryos. Nature, 1978; 274:500-503.
- Monk M., Harper Mh. Sequential X Chromosome Inactivation Coupled with a Cellular Differentiation in Early Mouse Embryos. Nature 1979, 281:311-313.
- Acosta Lobo ME, Vásquez Araque NA, Londoño Franco LF. Inactivación del cromosoma X en el desarrollo embrionario mamífero. CES Med Zootec 2013; 8(2): 108-119.
- Turner JMA. Meiotic sex chromosome inactivation. Development 2007; 134: 1823-1831.
- Avner P, Heard E. X-chromosome inactivation: counting, choice and initiation. Nat Rev Genet 2001; 2 (1): 59-67.
- Sidhu SK, Minks J, Chang SC, Cotton AM, Brown CJ. X chromosome inactivation: heterogeneity of heterochromatin. Biochem Cell Biol 2008; 86: 370-379
- Rastan, S. X chromosome inactivation and the Xist gene. Current opinion in genetics & development, 1994; 4(2), 292-297.
- Brown, CJ et al. A gene from the region of the human X inactivation centre is expressed exclusively from the inactive X chromosome. Nature 1991; 349: 38-44.
- Lee JT, Davidow LS, Warshawsky D. Tsix, a gene antisense to Xist at the X-inactivation center. Nat Genet, 1999; 21: 400-404.
- Wrenzycki C, Lucas-Hahn A, Herrmann D, Lemme E, Korsawe K, Niemann H. In Vitro Production and Nuclear Transfer Affect Dosage Compensation of the X-Linked Gene Transcripts G6PD, PGK, and Xist in Preimplantation Bovine Embryos. Biology of reproduction 2002; 66: 127-134.
- Leeb M, Steffen PA, Wutz A. X chromosome inactivation sparked by non-coding RNAs. RNA Biology 2009; 6 (2): 94-99.
- Navarro P. et al. Molecular coupling of Xist regulation and pluripotency. Science 2008; 321: 1693–1695.
- Navarro P. et al. Molecular coupling of Tsix regulation and pluripotency. Nature 2010; 468: 457–460.
- Brown CJ et al . Localization of the X inactivation centres on the human X chromosome in Xq13. Nature 1991; 349: 82-84.
- Chadwick BP, Willard HF. Multiple spatially distincts types of facultative heterochromatin on the human inactive X chromosome. PNAS 2004; 101 (50): 17450-17455.
- Plath K, Mlynarczyk-Evans S, Nusinov DA, Panning B. Xist RNA and the mechanism of X chromosome inactivation. A Rev Genet 2002; 36: 233-278.
- Csankovszki G, Nagy A, Jaenisch R. Synergism of Xist RNA, DNA methylation and histone hypoacetylation in maintaining X chromosome inactivation. Journal of Cell Biology 2001; 153: 773-784.
- Kozlowski, M., Corujo, D., Hothorn, M., Guberovic, I., Mandemaker, I. K., Blessing, C., … & Treier, M. (2018). MacroH2A histone variants limit chromatin plasticity through two distinct mechanisms. EMBO reports, 19(10).
- Kim DH, Jeon Y, Anguera MC, Lee JT. X-chromosome epigenetic reprogramming in pluripotent stem cells via noncoding genes. Seminars in Cell & Developmental Biology 2011; 22: 336– 342.
- Sado T, Okano M, Li E, Sasaki H. De novo DNA methylation is dispensable for the initiation and propagation of X chromosome inactivation. Development 2004; 131: 975-982.
- Heard, E. (2004). Recent advances in X-chromosome inactivation. Current opinion in cell biology, 16(3), 247-255.
- Pennisi E. The human genome. Science 2001; 291: 1177-1182.
- Aldana, E.A. Enfermedades ligadas al cromosoma sexual X (segunda y última parte). Boletín médico-Facultad de Medicina UAS, 2005; 1(6).