La importina: el GPS hacia el núcleo
Por Paula Rodríguez y Sara Vargas. Grado de Biología Sanitaria.
Introducción
En el interior de las células se realiza un tráfico constante de miles de moléculas y proteínas entre el núcleo y el citoplasma con el objetivo de realizar las numerosas tareas relacionadas con el genoma, como la reparación y el almacenamiento. Este es un proceso altamente regulado y selectivo llevado a cabo por unas proteínas flexibles capaces de reconocer secuencias y que median tanto la exportación como la importación. Los poros nucleares son las estructuras que conectan el núcleo y el citoplasma, y las importinas y exportinas (conocidas colectivamente como carioferinas) transportan moléculas de un lado a otro del poro.
En este artículo se va a tratar el papel de las importinas.
Papel biológico y su importancia
Las importinas son las proteínas encargadas del transporte entre el citoplasma de la célula y el núcleo. Este proceso se lleva a cabo a través de los complejos de los poros nucleares en un proceso llamado el ciclo de importación de proteínas nucleares. Se podría decir que la importina actúa como un GPS molecular, facilitando el transporte hacia el núcleo de unas proteínas específicas.
La importina es capaz de importar dichas moléculas gracias a secuencias de localización nuclear.
Es decir, como sería muy complejo crear una importina por cada tipo de proteína que haya que transportar al interior del núcleo, las proteínas con funciones nucleares tienen en su estructura una secuencia corta llamada señal de localización nuclear (NLS), que es reconocida por la importina y facilita el transporte de las proteínas a través de los poros nucleares hacia el núcleo. Estas secuencias no son idénticas en todas las proteínas que se importan, varían ligeramente, pero todas las variaciones pueden ser reconocidas por las importinas, y así les permite reconocer el tipo específico de molécula según esa secuencia.
Suelen ser secuencias de aminoácidos cortas formadas por grupos de residuos de carácter básico como lisinas y argininas. Que haya una mayor afinidad por la importina con la molécula depende de cada secuencia, y causa que ciertas moléculas entren al nucleoplasma con mayor facilidad.
Sin esta secuencia de localización nuclear, las proteínas no podrían ser reconocidas por las importinas y por tanto no podrían llegar a su destino nuclear ni llevar a cabo su función.
Estructura
Las importinas están formadas por un complejo compuesto por la importina-beta, importina-alfa y la carga. La importina-beta y la importina-alfa funcionan conjuntamente para transportar moléculas a través de proteínas del complejo del poro nuclear. Este complejo debe ingresar al núcleo donde la carga debe liberarse y las importinas deben reciclarse de regreso al citoplasma.
Si observamos la estructura de la importina, tanto la subunidad alfa como la beta se pliegan como un muelle que después se enrolla en una hélice. Es por ello que su estructura es todo alfa, es decir, está principalmente compuesta de hélices alfa. No se debe confundir el nombre de las subunidades con el tipo de estructura secundaria que presentan. Tiene sentido que esta proteína sea todo alfa ya que esta debe ser soluble y no crear precipitados. La estructura deja en el interior todas las uniones que sostienen la hélice.
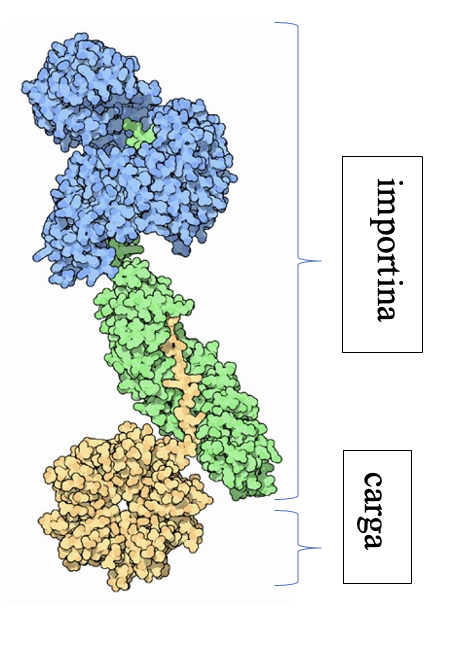
Imagen obtenida a partir de PDB-101
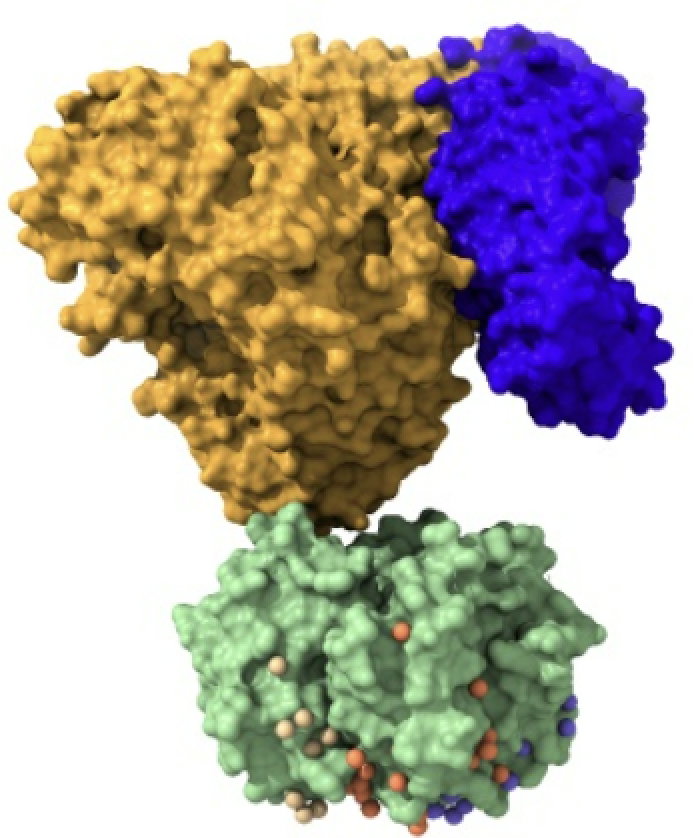
Imagen creada con Chimera X a partir de PDB 1qgk (importina beta), 1ee5 (importina alfa) y 1k5j (carga).
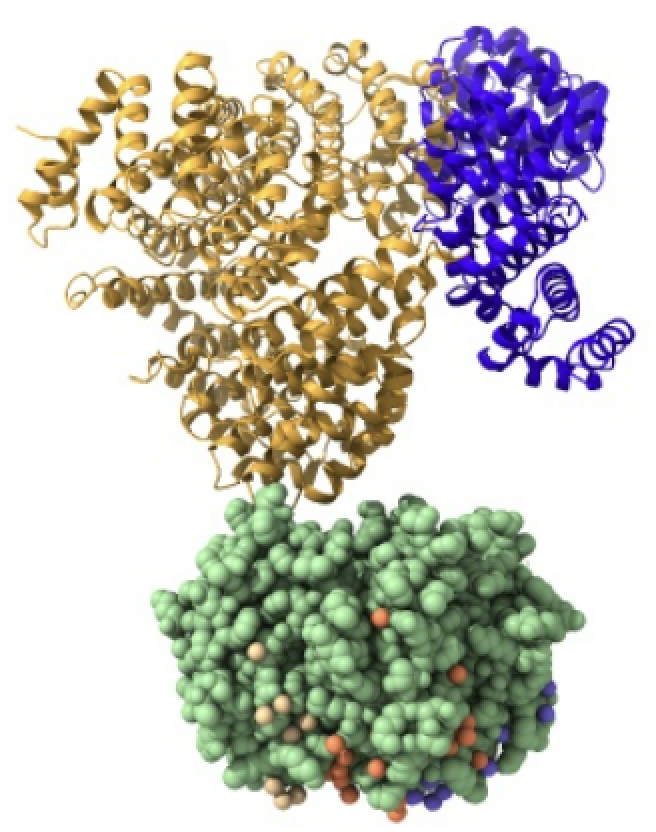
Imagen creada con Chimera X a partir de PDB 1qgk (importina beta), 1ee5 (importina alfa) y 1k5j (carga)
Mecanismo de acción de la proteína
Las importinas transportan constantemente miles de proteínas diferentes desde el citoplasma al núcleo. El transporte a través del poro nuclear está determinado por un gradiente energético de unas moléculas llamadas Ran.
La proteína Ran, es la responsable de liberar la carga y crear direccionalidad en el transporte. Para ello, la proteína Ran se une a importina-beta y provoca un cambio significativo en la estructura, lo que lleva a la liberación de importina-alfa y la carga. Luego, el complejo de importina-beta y Ran viaja de regreso al citoplasma a través del poro.
En el proceso de la importación encontramos que en el citoplasma se crea el GDP y se une a las moléculas Ran creando el complejo Ran-GDP. Una vez que la molécula importada traspasa el poro entrando en el nucleoplasma, las Ran-GDP son rápidamente convertidas en Ran-GTP, manteniendo un gradiente RanGDP en el citoplasma y RanGTP en el núcleo y dejando a la importina-beta lista para transportar la siguiente proteína de carga al interior. El gradiente de las proteínas Ran a través del complejo del poro nuclear es esencial y asegura la dirección correcta del transporte.
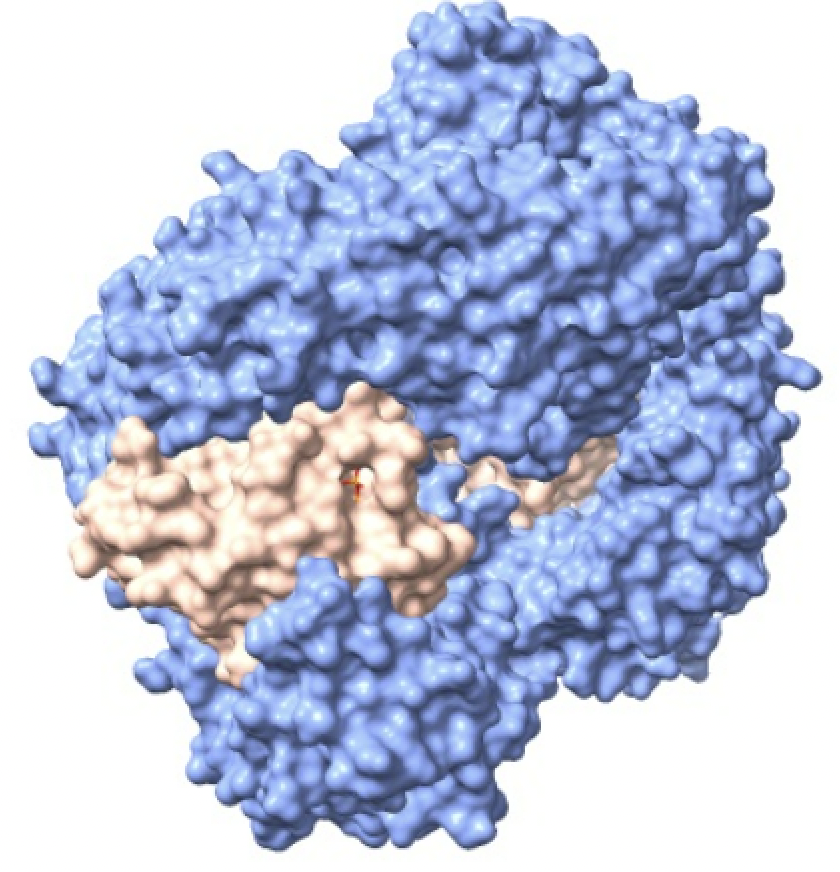
Imagen creada con ChimeraX a partir de PDB 2bku.
En cambio, la importina-alfa no puede regresar al citoplasma por sí misma, por lo que la proteína CAS (factor de exportación nuclear) debe participar en el proceso. CAS es similar a importina-beta, pero se mueve a través del poro nuclear en la dirección opuesta. CAS se une a importina-alfa y Ran para sacarlos del núcleo. Por último, una escisión similar del GTP en Ran libera importina-alfa para poder estar disponible para transportar otra proteína de carga.
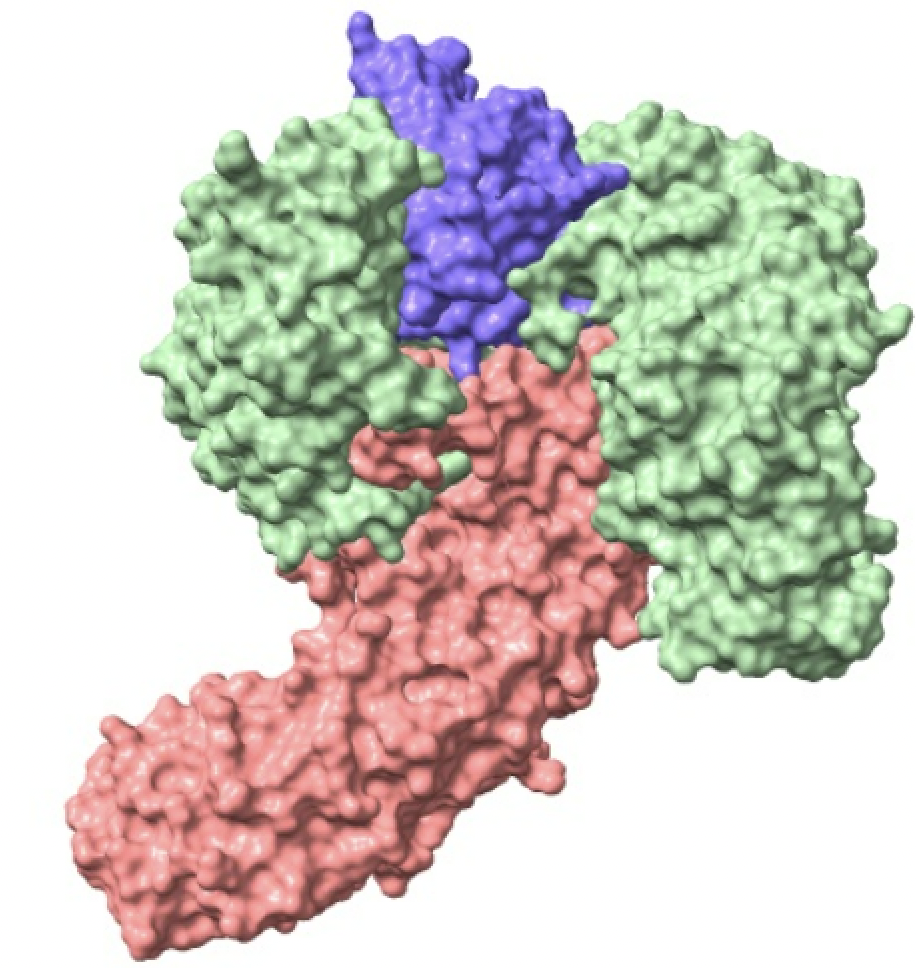
Imagen creada con ChimeraX a partir de PDB 1wa5.
Cuando la importina ya ha reconocido a la proteína por su secuencia de localización celular y se une a ella, lo denominamos complejo importina-carga.Las nucleoporinas (proteínas que componen los poros nucleares) interaccionan con la importina y utilizando el gradiente Ran mencionado para crear direccionalidad en el transporte. Una vez en el nucleoplasma, la presencia de altos niveles de Ran-GTP causa que el complejo importina-carga se destruya, liberando así la carga en el interior del núcleo.De esta manera, los complejos importina-carga que se han formado espontáneamente en el citoplasma, atraviesan el poro y son disgregados en importina más carga por las Ran-GTP del nucleoplasma. La importina después regresa a través de los poros de vuelta al citoplasma.
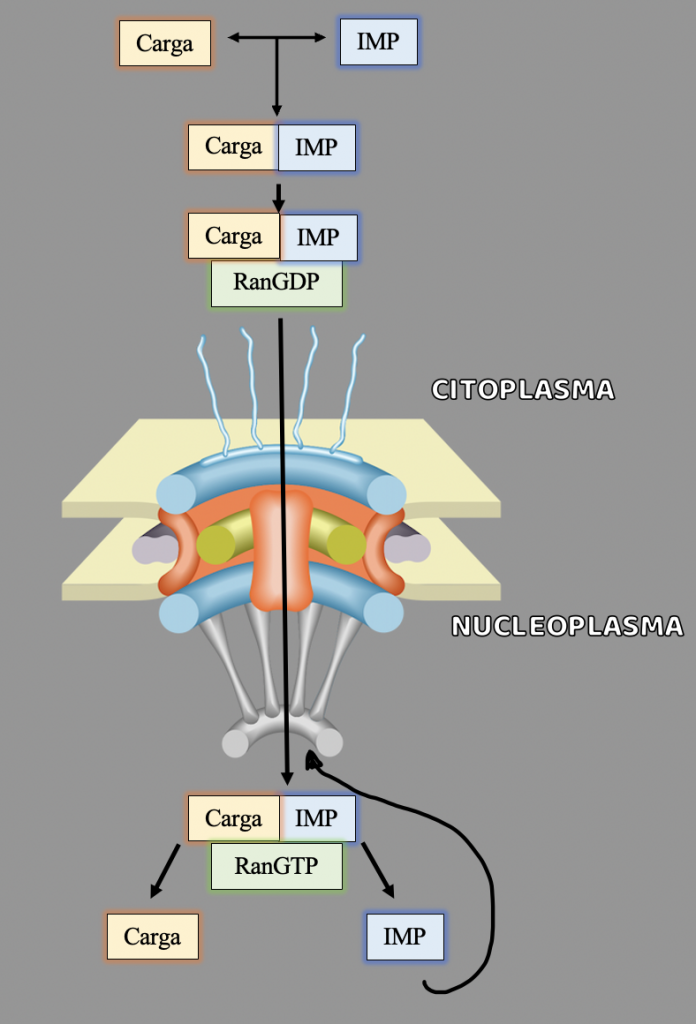
Autor de la imagen: Sara Vargas Jiménez
Implicaciones biomédicas y patologías asociadas a su mal funcionamiento
La actividad de las importinas está estrechamente relacionada con implicaciones biomédicas en los ámbitos de genética, bioquímica y biología molecular. Un mal funcionamiento del transporte entre el núcleo y el citoplasma puede influir en la aparición de muchas enfermedades y patologías asociadas a mutaciones o cambios en la estructura de la importina-α e importina-β.
Se han realizado estudios que demuestran que alteraciones en las importinas pueden estar relacionadas con cáncer. El mal funcionamiento en el transporte nuclear puede llevar a cambios tanto a nivel fisiológicos como en la ubicación de los supresores de tumores, protooncogenes y otras macromoléculas que afectan a procesos relacionados con tumores y la sensibilidad a los fármacos de células cancerosas. Los estudios de cáncer de mama han demostrado que el mal funcionamiento de las proteínas supresoras de tumores depende de la localización celular. En muchos de los tejidos de cáncer de mama la p53 se encuentra en el citoplasma en lugar del núcleo. p53 contiene señales de localización nuclear putativas (NLS) que interactúan con la importina α.
Además de sus funciones de transporte nuclear en la interfase, los receptores de transporte nuclear de carioferina también tienen funciones importantes en la mitosis y la integridad cromosómica. Por lo que alteraciones en las funciones regulares de las carioferinas pueden tener efectos sustanciales en el curso y resultado en enfermedades.
La actividad de la importina también está asociada con ciertas patologías relacionadas con la actividad de virus. Experimentos recientes han demostrado que en la infección del virus Ébola inhibe de la importación nuclear de PY-STAT1 ya que el virus evita que la importina-α entre al núcleo. Como resultado, la importina no es funcional y la proteína de carga permanece en el citoplasma lo que produce una reducción en la respuesta inmunitaria del huésped.
Por último, varios estudios han demostrado la relación entre las importinas y los procesos de gametogénesis y una posible relación con la infertilidad masculina. Como resultado, se ha demostrado que las contribuciones de las importinas al desarrollo celular no se basan solo en el movimiento de carga a través de los poros nucleares sino que también pueden tener relevancia en muchas enfermedades y patologías celulares.
Bibliografía
PDB-101: The RCSB PDB «Molecule of the Month Importins»: Inspiring a Molecular View of Biology D.S. Goodsell, S. Dutta, C. Zardecki, M. Voigt, H.M. Berman, S.K. Burley (2015) PLoS Biol 13 January 2007, David Goodsell
M. Stewart, (2006). Structural basis of the nuclear protein import cycle. Biochemical Society Transactions 34, 701-704.
Megías M, Molist P, Pombal MA. (2019). Atlas de histología vegetal y animal. La célula. Depto. De Biología Funcional y Ciencias de la Salud. Universidad de Vigo
Espinel, C. (2002). Núcleo. Fondo Editorial Biogénesis, 291-336.
Ramos, J. F. (2012). Ensamblaje de complejos de transporte nucleocitoplasmático con chaperones de histonas (Doctoral dissertation, Universidad del País Vasco-Euskal Herriko Unibertsitatea).
Geydan, T. D., GARZÓN-CORAL, C., Fajardo, C., & Spinel, C. (2010). Dinámica del complejo del poro nuclear. Acta biológica colombiana, 15(1), 281-288.
Tolga Çağatay, Yuh Min Chook, Karyopherins in cancer, Current Opinion in Cell Biology, Volume 52, 2018, Pages 30-42,
Kim, I. S., Kim, D. H., Han, S. M., Chin, M. U., Nam, H. J., Cho, H. P., … & Moon, Y. H. (2000). Truncated form of importin α identified in breast cancer cell inhibits nuclear import of p53. Journal of Biological Chemistry, 275(30), 23139-23145.
Benedict Nathaniel, Penny A.F. Whiley, Yoichi Miyamoto, Kate L. Loveland, Importins: Diverse roles in male fertility,Seminars in Cell & Developmental Biology,Volume 121, 2022, Pages 82-98
Michael S. Lee, Frank J. Lebeda, Mark A. Olson,Fold prediction of VP24 protein of Ebola and Marburg viruses using de novo fragment assembly,Journal of Structural Biology,Volume 167, Issue 2, 2009, Pages 136-144


