No siempre cuanto más mejor, regula tus fosfatos. PROTEÍNA RAS E IMPLICACIONES ONCOGÉNICAS.
Trabajo realizado por Silvia Rodríguez Masedo y Emma Peña Porras. 1º Biología Sanitaria.
PROTEÍNA RAS.
Índice.
1. Introducción.
2. Estructura
2.1. Estructura primaria
2.2. Estructuras secundaria y terciaria
3. Función y rutas principales.
4. Implicaciones biomédicas. Cáncer y rasopatías
5. Inhibidores y últimas investigaciones.
6. Referencias
1. Introducción
Los genes ras pertenecen a una superfamilia de genes que codifican pequeñas proteínas de unión a nucleótidos de guanina. Las proteínas RAS son una familia de enzimas con actividad GTPasa, altamente conservadas, que se localizan en la superficie interna de la membrana celular para poder llevar a cabo su función; actuar como centrales que reciben, modulan y transmiten las señales que controlan un gran número de procesos celulares como los de crecimiento, diferenciación, transformación y apoptosis, establecidos por las rutas de señalización en cascada que surgen de los receptores situados en la superficie celular.
La superfamilia de enzimas RAS consta de las subfamilias K-RAS, N-RAS y H-RAS, que codifican las cuatro isoformas de estas proteínas: H-, N-, K-Ras4A y K-Ras4B (las dos últimas, originadas por procesamiento alternativo del exón 4) y se expresan en todos los tejidos y tipos de células de forma distinta.
Estas proteínas tienen una importancia notoria en los procesos oncológicos, pues su función está estrechamente ligada al control de la proliferación celular.
2. Estructura
2.1. Estructura primaria.
La estructura primaria está conformada por una secuencia de residuos de aminoácidos unidos de forma covalente, conectados entre sí por una reacción de condensación entre el grupo carboxilo de un aminoácido y el grupo amino de otro, dando lugar al enlace peptídico.
La secuencia de las proteínas Ras contiene 189 aminoácidos, a singularidad de K-Ras4B que se forma por 188. En su estructura primaria se pueden distinguir 4 regiones diferentes. En primer lugar, la región contante comprende los primeros 85 aminoácidos comunes a las tres subfamilias (K-RAS, N-RAS y H-RAS). La región variable consta de los 80 aminoácidos siguientes, que continúan siendo altamente homólogas (80%). Tras esta, la región hipervariable compuesta por la región carboxilo terminal, en esta región apenas hay homología (4%). Los últimos cuatro aminoácidos (C cisteína, A aminoácido alifático y X metionina o serina) denominados “CAJA CAAX” fundan un dominio esencial para la unión a membranas y para la actividad de estas proteínas.
2.2. Estructura secundaria y terciaria.
Vamos a estudiar la estructura de la proteína Ras analizando sus motivos de una forma comparativa, viendo la diferencia entre la proteína activa (unida a GTP) e inactiva (unida a GDP).
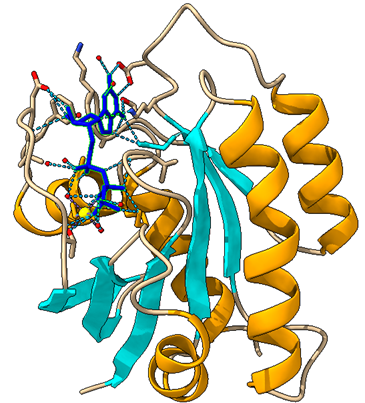
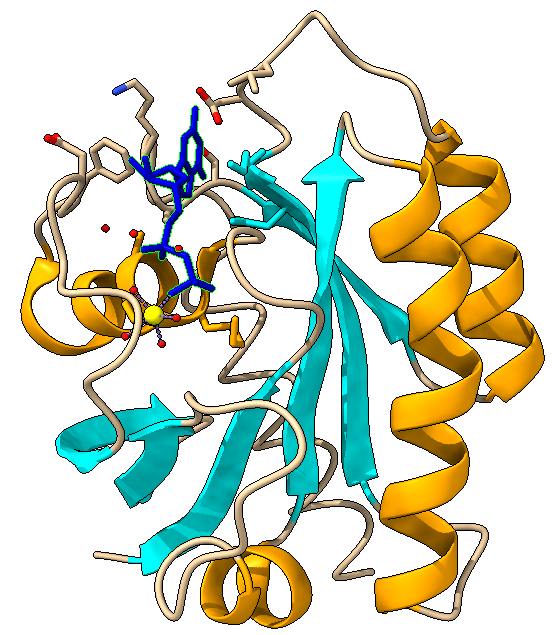
En las imágenes podemos reconocer:
5 hélices alfa representadas en amarillo, que se encuentran en la zona periférica de la proteína, aunque en la forma inactiva la hélice alfa que vemos en el centro de la proteína debido a la desviación de sus enlaces o interacciones, no es reconocida como tal en el programa de Ximera, si no que es reconocida como un bucle.
6 láminas beta, representadas en cian, que tienen una especie de estructura de tambor TIM abierto, que se encuentran en el centro de la estructura proteica. Tenemos 5 láminas paralelas y una en sentido contrario. Estas láminas se unen a las hélices alfa mediante bucles (en color carne)
Cofactor Mg 2+, representado en amarillo chillón, está interaccionando con la proteína a través de la serina 17 y también con el GDP, además, establece interacciones con moléculas de agua. Es en esta posición donde consigue realizar su función, favoreciendo la correcta alineación y la estabilización de RAS.
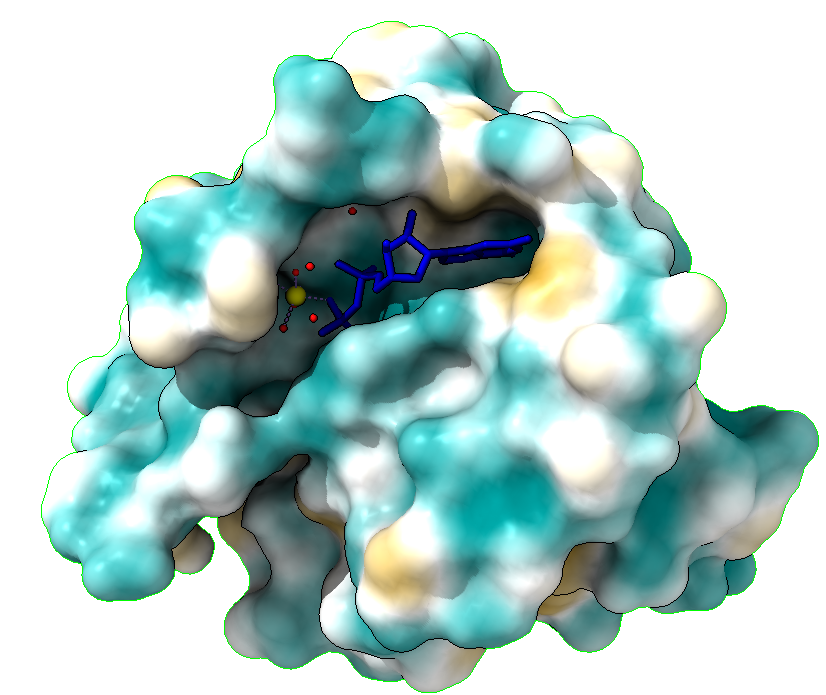
En las imágenes superiores vemos mostrada la hidrofobicidad de la proteína RAS, lo que nos permite ver de una forma muy visual, el centro activo, también llamado bolsillo, que la proteína deja para la unión del GDP o GTP. Se ve como encaja este GDP o GTP (unidos al cofactor de magnesio) en el bolsillo con forma alargada que vemos ocupado en ambas imágenes.
Además, vemos como es más afín el GTP que el GDP, dado que en el GTP encaja perfectamente con el bolsillo mientras que el GDP encaja, pero deja un hueco, estableciendo por lo tanto menos interacciones y siendo esta unión menos estable.
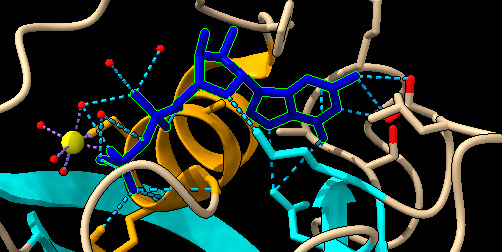
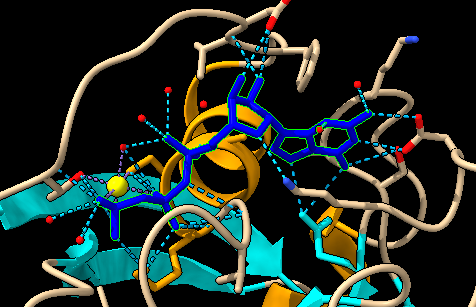
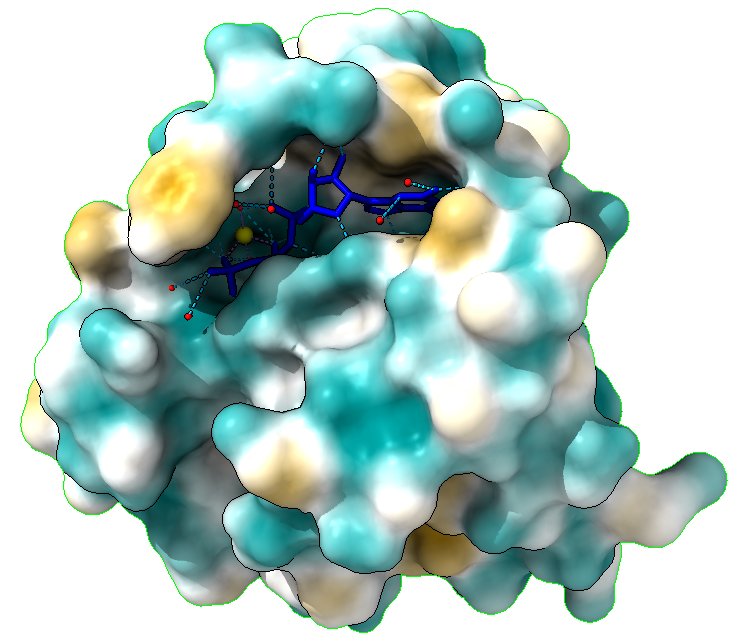
En estas imágenes lo que vemos representado son los puentes de hidrógeno que se establecen entre el GTP/GDP y el centro activo. Sabemos que los puentes de hidrógeno estabilizan está unión, por lo tanto, a mayor número de interacciones por puentes de H, más afín será la unión, y por lo tanto más estable el complejo RAS- sustrato.
La unión de con GDP cuenta con 21 puentes de hidrógeno, mientras que la unión con GTP tiene 29, es decir, estos 8 puentes de hidrogeno adicionales hacen que la unión GTP- RAS, sea más estable, al igual que veíamos que era más estable en las imágenes de la hidrofobicidad. Es por ello por lo que esta unión al verse favorecida se puede descontrolar, desencadenando una cascada de señales descontrolada, que causan demasiada proliferación celular, favoreciendo la aparición de tumores.
3. Función y rutas principales.
Antes de explicar la cascada de señales que lleva a cabo la proteína Ras, recordamos las dos formas nos la podemos encontrar:
RAS-GTP: forma activada, donde la proteína RAS está unida a GTP
RAS-GDP: forma inactivada, donde la proteína RAS está unida a GDP
SEÑALIZACION CELULAR.
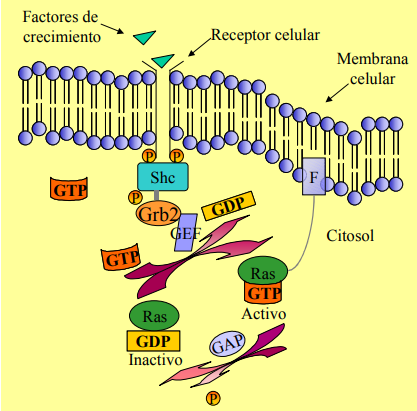
Consiste en la transmisión de información desde el exterior de la célula hasta su núcleo. Los factores de crecimiento llegan a los receptores de membrana, que interaccionan con proteínas adaptadoras (Shc, Grb2), y con los factores de intercambio de nucleótidos de Guanina (GEFs). Es en este momento cuando se produce la activación de Ras, mediante el paso de GDP a GTP.
En ausencia de señales de reproducción celular, entran en acción las proteínas GAP, que poseen actividad GTPasa, hidrolizando un grupo fosfato, inactivando a Ras. Estas proteínas GAP son imprescindibles dado que Ras presenta más afinidad por GTP que por GDP, y las proteínas GAP contrarrestan esa ventaja del GTP.
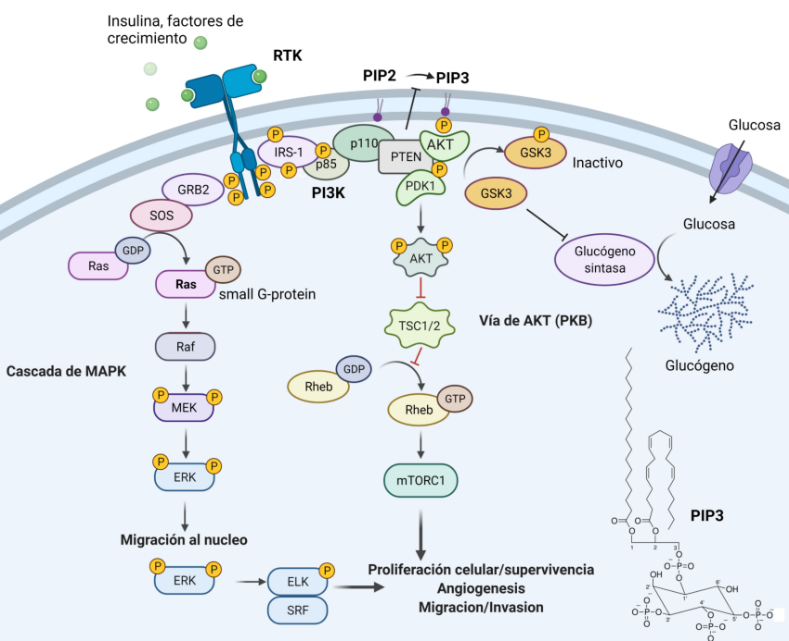
Las proteínas Ras, una vez activadas, pueden asociarse con varios efectores para ejercer sus efectos biológicos:
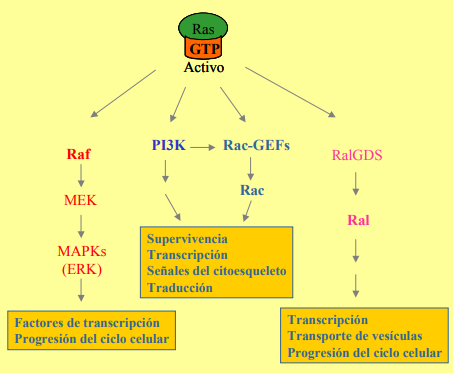
RAF: Es una proteína kinasa que tras su translocación se activa y activa mediante fosforilación a las quinasas MEK, que activan también mediante fosforilación a las proteínas Erk (conocidas como MAPKs), que activan factores de transcripción.
PI3K: Es una enzima que interviene en la producción de moléculas que actúan como segundos mensajeros, y está implicada en procesos como la organización del citoesqueleto o la división celular.
RalGDS: Es un factor de intercambio de nucleótidos de guanina, que se conoce menos que las dos anteriores. Se sabe que están implicadas en la progresión del ciclo celular y en la transcripción de genes.
Ras también está estrechamente relacionada con la apoptosis.
- Induce apoptosis a través de la ruta RAF (Raf-Mek-Erk) y activando a p38.
- La función apoptótica depende de la subfamilia de Ras. En condiciones de estrés oxidativo, H-Ras V12 es apoptótica y K-Ras V12 será anti-apoptótica, sin embargo ante radiaciones ionizantes estas dos funciones se intercambian, siendo K-Ras V12 la apoptótica y H-Ras V12 será anti-apoptótica.
- Además, K-Ras tras ser fosforilado por PKC, se transloca a la mitocondria, donde se une a Bcl-XL (proteína inicialmente anti-apoptótica), convirtiéndolo en pro-apoptótico.
4. Implicaciones biomédicas. Cáncer y rasopatías.
-CÁNCER
El origen del cáncer tiene lugar debido a la formación de tumores asociados a una mutación en una célula. De forma normal, esta mutación se corrige por la acción de determinados complejos enzimáticos de reparación o en caso de que no se repare con éxito se induce la apoptosis. Cuando ambos mecanismos fallan comienza a reproducirse la célula sin control, cada vez más rápido y resistentes al mecanismo de defensa de nuestro organismo. Cuando dicha célula (ahora tumoral) adquiere la capacidad de invadir tejidos (metástasis) produce cáncer.
Como hemos comentado previamente, la proteína ras está implicada en procesos como la proliferación celular, la diferenciación o apoptosis. Cuando esta sufre una mutación, pierde la capacidad de realizar correctamente muchas de las funciones mencionadas y no actúa correctamente ante factores de crecimiento o señales inhibidoras, adquiriendo capacidad de metástasis.
Desde hace más de 30 años se sabe que el 30% de los cánceres humanos presentan una mutación somática en alguno de los genes que codifican estas proteínas. La mutación de Ras que causa cáncer crea una forma de la proteína que siempre está activa. Esto es un desastre, porque el Ras mutado les dice continuamente a las células cancerosas que está bien que se multipliquen, sin los límites normales que controlan el crecimiento celular. Generalmente, sólo una de las isoformas está mutada en un tumor y la frecuencia en la que aparece mutada cada isoforma depende del tejido y tipo tumoral.
Diversos resultados de un estudio reciente, han determinado que los tumores en el colon izquierdo presentaban en un 62.7% de los pacientes que padecían esta enfermedad, una mutación presente en un 43.3% de las proteínas de tipo K-RAS, siendo el recto la localización más frecuente. El adenocarcinoma (un carcinoma es un tumor maligno del tejido epitelial) fue el tipo histológico más predominante en un 82%. Las metástasis múltiples (el tumor maligno se expande a través de la sangre o sistema linfático y aparece en varios órganos) se observaron en el 58.6% de los tumores K-RAS mutados, siendo el hígado y pulmón los órganos más frecuentes. Como conclusión del estudio, determinaron que tumores K-RAS mutados se relacionaron con un mayor riesgo de esta enfermedad, incrementando la presencia de metástasis múltiples y por tanto un peor pronóstico. El valor predictivo del gen RAS frente a las terapias no pudo ser evaluado.
-RASOPATÍAS
Por otro lado, también se ha demostrado que las mutaciones en la línea germinal de RAS provocan anomalías en el desarrollo del individuo, aunque depende el gen afectado. Todos los pacientes comparten un grado variable de retraso mental o dificultades de aprendizaje, trastornos cardiacos, dismorfismo facial, anomalías cutáneas y en diversas situaciones predisposición al cáncer.
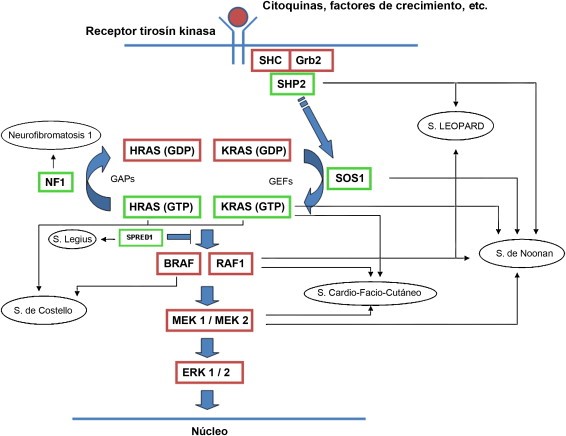
Entre estos síndromes, conocidos como rasopatías, se incluyen el síndrome de Noonan, el síndrome de Costello, la neurofibromatosis, el síndrome Leopard, el síndrome cardio-facio-cutáneo y el síndrome de Legius. Además, existen otras enfermedades relacionadas con mutaciones germinales en la vía RAS/MAPK que no afectan a procesos del desarrollo, pero si causan daños en las vías inmunológicas o a la formación de vasos sanguíneos. Predominan, el síndrome linfoproliferativo autoinmune (ALPS), el síndrome de malformaciones capilares y malformaciones arteriovenosas (CM-AVM) o la hiperplasia fibrosa gingival tipo 1 (HFG1).
Destacamos, como uno de los efectos principales, las manifestaciones cutáneas por estas rasopatías. A pesar de que el papel de la vía RAS/MAPK en el desarrollo del tegumento cutáneo no está del todo determinada, en un reciente estudio experimental se ha podido comprobar que la hiperactivación del KRAS bloquea la proliferación del pelo e induce la aparición de piel redundante (más larga y abundante de lo normal), crecimientos papilomatosos ( un papiloma es un tumor epitelial) y uñas cortas.
5. Ras como target farmacológico: Inhibidores y últimas investigaciones.
Investigaciones recientes, han encontrado ciertos compuestos químicos, que se encuentran todavía en estado de prueba, pero podrían ser posibles soluciones farmacológicas para la lucha contra el cáncer en un futuro no tan lejano. Entre ellos encontramos:
Benzimidina:
La presencia de anillos bencénicos en la benzimidina hace que sea posible la unión con el medio hidrofóbico otorgado por los aminoácidos del centro activo de RAS, haciendo la unión benzimidina-centro activo de RAS afín.
Esta molécula es capaz de unirse a un bolsillo de la proteína distinto al habitual, ocasionando la inhibición de la actividad de intercambio GTP/GDP vía proteínas SOS .Es decir, provoca un cambio conformacional que inactiva a la proteína, y esto impide que tenga lugar la proliferación celular; es por tanto una posible nueva estrategia en el tratamiento de enfermedades neoplásicas.
N-{1-[N-(2,4-diclorofenil)glicil]piperidin-4-il}etinilsulfonamida:
Una de las vías más eficaces para inhabilitar o cambiar la conformación de una proteína es la unión a la misma de forma covalente.
El azufre de la cisteína del centro activo establece una interacción muy fuerte con el carbono de la etinilsulfonamida. Lo importante a reseñar sobre este ligando es que es selectivo, es decir, que solamente puede interaccionar con la cisteína que aparece en la proteína mutada, ausente en la nativa o inalterada. Esto representa un resultado muy prometedor porque significaría el balance entre alta eficacia y selectividad.
6.Bibliografía
- Introducción y estructura:
Sánchez, H. Á. (2016e, noviembre 29). Análisis y presentación de la estructura y función de una proteína. Estudio de la estructura y función de K-RAS. https://ebuah.uah.es/dspace/handle/10017/27238
Blanco, O. G. (2007). EXPRESIÓN DE LAS PROTEÍNAS p21 RAS y CÁNCER | Guirado Blanco | Medicentro Electrónica. https://medicentro.sld.cu/index.php/medicentro/article/view/733/748+https://docs.google.com/viewerng/viewer?url=https://digital.csic.es/bitstream/10261/89100/1/La+ruta+RAS-ERK.pdf
- Rutas:
La ruta RAS-ERK.pdf. (s. f.). https://docs.google.com/viewerng/viewer?url=https://digital.csic.es/bitstream/10261/89100/1/La+ruta+RAS-ERK.pdf
- Cáncer y rasopatías:
Blanco, O. G. (2007b). EXPRESIÓN DE LAS PROTEÍNAS p21 RAS y CÁNCER | Guirado Blanco | Medicentro Electrónica. https://medicentro.sld.cu/index.php/medicentro/article/view/733/748
Just a moment. . . (s. f.). https://www.sciencedirect.com/science/article/pii/S000173101100113X?casa_token=voikaZe9Y4kAAAAA:SyW0Wdrtas0T4TcBYaPck7he460kR-0GgQgAHGMUxXOi90GhV1WqAxtWkRj7i9xLKok0T3lUqg
Sang, C. S. L. M. (2022a, noviembre 28). Determinación del gen ras como factor pronóstico y predictivo en cáncer colorrectal metastásico en el Instituto de Oncología Dr. Heriberto Pieter, enero 2019 – diciembre 2021. https://repositorio.unphu.edu.do/handle/123456789/4782
SciELO – Scientific Electronic Library Online. (s. f.). http://www.scielo.org.pe/scielo.php?pid=S1022-51292003000300006
- Inhibidores:
Sánchez, H. Á. (2016h, noviembre 29). Análisis y presentación de la estructura y función de una proteína. Estudio de la estructura y función de K-RAS. https://ebuah.uah.es/dspace/handle/10017/27238
Imágenes:
Imagen de las rutas por rasopatías:
Hernández-Martín, A., & Torrelo, A. (2011). Rasopatías: trastornos del desarrollo con predisposición al cáncer y manifestaciones cutáneas. Actas Dermo-Sifiliográficas, 102(6), 402-416.
Realizadas por nosotras desde Ximera o extraídas de las webs citadas anteriormente, y citadas en la leyenda de las correspondientes imágenes.


