¿POR QUÉ NO PODEMOS REGENERAR NUESTRAS EXTREMIDADES COMO LOS AJOLOTES?
Por Claudia García Lorenzo, Eva García Sánchez y Lucía González Márquez.
3º Biología Sanitaria. Universidad de Alcalá.
INTRODUCCIÓN
¿Te imaginas perder una pierna y que al día siguiente te crezca una nueva? Aunque parezca salido de una película de ciencia ficción, hay animales que pueden regenerar por completo sus extremidades.
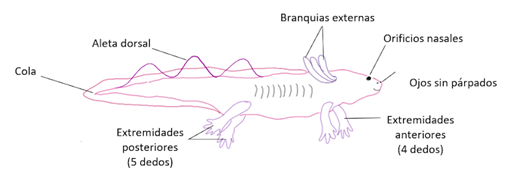
Ambystoma mexicanum, comúnmente conocido como ajolote, es un anfibio similar a la salamandra. Etimológicamente hablando, su nombre significa “monstruo del agua” (aunque mucho miedo, no da).

Fuente: National Geographic (https://www.nationalgeographic.es/animales/ajolote).
Por lo general viven en canales, aunque en la actualidad sus hábitats naturales están siendo modificados por las actividades humanas. Por ello, es habitual encontrarlos en acuarios y su distribución en tiendas de mascotas1.
Todo esto, está favoreciendo su desaparición, lo que supondría una gran pérdida en el mundo de la investigación, pues el ajolote es un animal de especial interés por la capacidad que tiene para regenerar sus tejidos.
Los urodelos, y en especial el ajolote, son los únicos vertebrados que pueden regenerar estructuras complejas como las extremidades, la cola, el corazón, la piel, e incluso algunas regiones del sistema nervioso, como la médula espinal2.
CICLO DE REGENERACIÓN
La regeneración de tejidos consiste en la reparación de células, tejidos, órganos o partes completas del cuerpo que están dañadas o ausentes para que vuelvan a funcionar completamente. Los vertebrados más complejos (mamíferos) cuentan con funciones regenerativas limitadas siendo la más común la formación de cicatrices en los tejidos para cerrar heridas.
La regeneración de las extremidades es el proceso que más se ha estudiado en el ajolote, por lo que a lo largo del trabajo nos centraremos en esto3.
Las extremidades maduras de los ajolotes (y de cualquier otro animal) están formadas por distintos tejidos (entre ellos: epidermis, dermis, tejido óseo, cartilaginoso, muscular…), que deben regenerarse de manera coordinada para que la nueva estructura sea funcional.
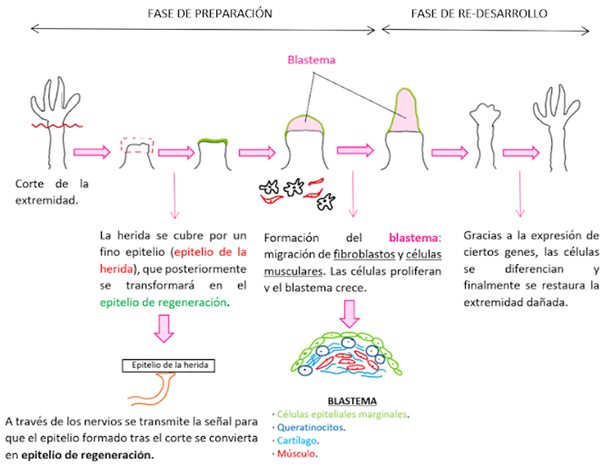
Para ello, se genera una estructura denominada blastema. Inicialmente se pensaba que el blastema estaba formada por un grupo de células homogéneas pluripotentes que se iban diferenciando para formar tejidos concretos. Sin embargo, estudios recientes han determinado que estas células tienen una cierta memoria, y es que cada una originará un tejido concreto en función de su origen4.
El proceso de regeneración cuenta con dos fases2:
- FASE DE PREPARACIÓN
El desencadenante del proceso es el corte de la extremidad del ajolote. Tras ello se produce la migración de las células epiteliales hacia la herida para formar el epitelio de la herida, que se irá engrosando con el tiempo, dando lugar al epitelio de regeneración5.
A continuación, se produce una reacción inmune6 que va acompañada de la migración y desdiferenciación de los fibroblastos y de las células musculares para generar el blastema que irá aumentando su tamaño progresivamente. Para facilitar la migración de las células es esencial la presencia de nervios.
- FASE DE RE-DESARROLLO
El objetivo del ajolote en esta fase es volver a la estructura inicial antes de que se produjera la herida. Para ello, van a expresarse una gran cantidad de genes, entre ellos algunos genes Hox, encargados del control de la región antero-posterior (2). Estos genes van a seguir prácticamente el mismo patrón que siguieron durante el desarrollo del animal.
Las células indiferenciadas del blastema se van a diferenciar en células musculares y cartílago7, y poco a poco se irán viendo los dedos hasta que se forme por completo la extremidad.
EL FACTOR TGF-β
- ESTRUCTURA DEL FACTOR
Hay muchos factores y proteínas relacionadas con la regeneración tisular, pero en lo que se refiere a la regeneración de extremidades del ajolote, destaca el factor TGF-β (transforming growth factor), una proteína de secreción con 393 aminoácidos que actúa como factor de transcripción regulando positivamente la división celular.
De los 393 aminoácidos que la conforman, los 23 primeros conforman la secuencia señal de la proteína (permite llevar la proteína a su localización exacta) y por tanto, desde el aminoácido 24 al 393, se encuentra el dominio funcional de la proteína.
Su estructura, que todavía no se conoce al 100%, tiene estructuras en hélice-α y láminas-β. Cuenta con, al menos, cinco puentes disulfuro, uno de ellos (aminoácido 358), intercatenario9.
2. PAPEL EN LA REGENERACIÓN DE TEJIDOS
El urodelo expresa en sus células dos receptores con actividad serina/treonina quinasa transmembrana, TBR-I y TBR-II. La vía de señalización del TGF-β comienza con su unión al TBR-II, activando la quinasa. Esta va a reclutar y fosforilar a TBR-I para activarla también. Este receptor se va a encargar de propagar la señal en el interior celular, ya que fosforila a los factores de transcripción Smad (siendo los más importantes Smad2, Smad3 y Smad7). Una vez fosforilados, se liberan del receptor para formar un complejo con Smad4. Se transloca al núcleo a través de un poro nuclear e interaccionan con el ADN, regulando la expresión de genes diana al reclutar una serie de co-activadores y co-represores transcripcionales6,10.
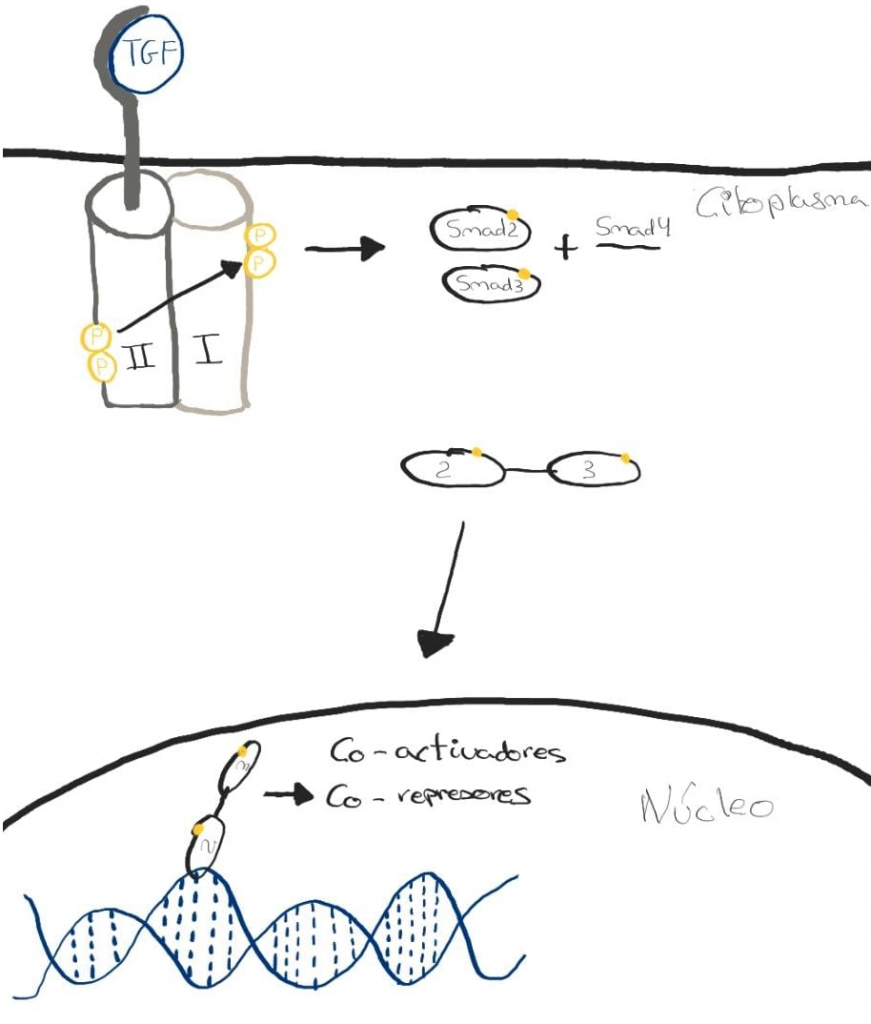
El papel de estos factores (TGF-ꞵ y Smad) está estrictamente limitado a la fase de preparación mencionada en el apartado anterior6. Su función no está totalmente estudiada, pero se han utilizado varios ratones knockout y se ha visto que:
Los ratones Smad2 y 4 KO eran letales6. Los Smad3 KO eran viables, y en su fenotipo se vieron varias características interesantes. Los ratones eran sanos y relativamente normales, se había amplificado la respuesta de los fibroblastos en la regeneración, y se ha visto una mejora a la hora de la reepitelización de las heridas con menor inflamación y la reducción considerable de la cicatrización6,10.
A parte de los knockouts, se han realizado ensayos de inmunofluorescencia para visualizar el tipo celular donde se concentran estos factores. Smad2 se observaba tanto en células epiteliales como en las mesenquimáticas10. En cambio, Smad3 está enriquecida en las células epiteliales cercanas a la herida. También se ha estudiado la activación diferencial, ya que aparece antes fosforilado Smad3 antes que Smad211,12
Con todo esto dicho, podemos llegar a varias conclusiones: Smad2 es requerido para la regeneración de las extremidades y Smad3 no. Además, se podría especular que el papel de Smad3 está relacionado con la cicatrización mientras que Smad2 es requerido para pasar a la formación del blastema requerido para continuar con la regeneración11.
Los mamíferos también presentamos estos factores. Entonces, ¿por qué no somos capaces de regenerar un brazo si nos lo cortan? La realidad es que existe evidencia de que los ajolotes son capaces de desdiferenciar por completo las células cercanas al sitio de amputación y de atenuar sus sistema inmune tras la formación de la herida12. En cambio, los mamíferos inician una respuesta de reepitelización seguida de la reconstitución de una membrana basal madura, una contracción de la herida y la formación de una densa y estratificada capa de cicatrización13. Estas diferencias imposibilitan la regeneración de la extremidad, no se puede formar un blastema que dé lugar a las yemas12. Todavía sigue en estudio, pero se han barajado varias hipótesis para estas posibles diferencias:
1. Una expresión diferencial de factores en los diferentes estados de desarrollo humano, ya que los urodelos como los ajolotes los presentan a lo largo de toda su vida constitutivamente. Esto se debe a que, en los fetos, se ha visto regeneración sin cicatrización durante el primer trimestre de la gestación12. Como esto en adultos no ocurre, se podría pensar que los niveles de estos factores disminuyen a medida que el ser humano crece, y por lo tanto también la capacidad de regenerarse.
2. Expresión diferencial de los factores que intervienen en el proceso de regeneración: Es posible que en los mamíferos se fosforilen más los factores Smad3 que los Smad2, lo que daría a un incremento de la cicatrización en comparación con los ajolotes.
3. Diferencias morfológicas: está claro que hay una gran diferencia de tamaño entre un ajolote y un ser humano. Existe la posibilidad que la regeneración de un brazo de un mamífero sea más costoso metabólicamente que la de un ajolote, por lo que al cuerpo le compensa más en lo que se refiere a conservación de energía seguir por la vía de cicatrización que por la de regeneración de la extremidad.
UTILIDADES
La capacidad de regeneración de los ajolotes es un campo abierto de estudio que puede suponer muchos beneficios para los humanos y otros mamíferos, aunque actualmente la investigación referida a este tema está muy limitada y no es específica de los ajolotes. Existen pocos equipos de investigación dedicados al estudio de la medicina regenerativa y los ajolotes, pero se plantean muchas aplicaciones posibles.
Las líneas más importantes de investigación están dirigidas principalmente al tema del cáncer. Se ha observado que los ajolotes tienen una incidencia muy baja en cuanto a aparición de tumores de manera espontánea, así como si son inducidos por agentes cancerígenos (el tumor suele aparecer durante un tiempo largo de exposición y con mayor probabilidad en aquellos ajolotes que son más viejos). Además, en aquellos tejidos implicados en la regeneración, no se ha observado la aparición, tanto espontánea como inducida, de tumores.
Siguiendo con la línea de investigación del cáncer, se ha estudiado también el papel de la telomerasa en esas células, y, aunque aún no se sabe muy bien cómo actúa, se plantea la posibilidad de que, como hemos mencionado antes, en la fase de re-desarrollo, se vuelve a un estado embrionario para posteriormente dar lugar al nuevo tejido.
También tiene importancia la senescencia celular, es decir, la muerte por acortamiento de telómeros, un proceso normal que limita la vida de las células. En relación a esto se ha visto que los anfibios, sobre todo los urodelos (apenas hay estudios en este tema relacionados con ajolotes), poseen células resistentes a la senescencia, aunque no todas, sino sobre todo en células de las extremidades y en algunos grupos de cardiomiocitos.
Como bien sabemos, el cáncer está muy relacionado con la edad, a mayor edad, mayor probabilidad de padecer cáncer. En el caso de los ajolotes, la capacidad de regeneración está poco limitada por la edad. Se dice que los ajolotes adultos regeneran de manera más lenta los tejidos que los ajolotes más jóvenes, pero esto ocurre porque los ajolotes jóvenes, al ser más pequeños, tienen menor cantidad de tejido que regenerar, por ello tardan menos. Esta propiedad que tienen los ajolotes de no perder capacidad de regeneración puede aplicarse a los humanos para tratar enfermedades asociadas a la edad como el Alzheimer o enfermedades cardíacas, respuestas inmunitarias alteradas, senescencia, etc.
El sistema inmune también se ve afectado con el paso del tiempo, empieza a ser menos eficiente y los humanos son más susceptibles a padecer enfermedades o sufrir respuestas inmunitarias alteradas. Tanto en mamíferos como en anfibios, el desarrollo del sistema inmune está relacionado con una pérdida de la capacidad de regeneración, pero es necesaria una respuesta inflamatoria, como la activación de los macrófagos, para llevar a cabo funciones como eliminar células en senescencia en el tejido que está siendo regenerado. Se necesita un equilibrio.
Por último, una posible aplicación de la capacidad de regeneración de los ajolotes es la parabiosis heterocrónica, una técnica que permite la unión de vasos sanguíneos de animales de distintas edades. Es una técnica que ha tenido éxito en los ajolotes, y, aunque se han hecho estudios que facilitan la regeneración de músculo e hígado en ratones viejos gracias a la activación de células de los ratones jóvenes, está rodeada de muchas opiniones controversiales12,14.
BIBLIOGRAFÍA
- Sámano, C., González-Barrios, R., Castro-Azpíroz, M., Torresgarcía, D., Ocampo-Cervantes, J. A., Otero-Negrete, J., & Soto-Reyes, E. (2021). Genomics and epigenomics of axolotl regeneration. In International Journal of Developmental Biology (Vol. 52). UPV/EHU Press. https://doi.org/10.1387/IJDB.200276CS
- Roy, S., & Lévesque, M. (2006). Limb regeneration in axolotl: Is it superhealing? In TheScientificWorldJournal (Vol. 6, Issue SUPPL.1, pp. 12–25). https://doi.org/10.1100/tsw.2006.113
- National Institute of General Medical Science. https://nigms.nih.gov/education/fact-sheets/Pages/regeneration-spanish.aspx
- Kragl, M., Knapp, D., Nacu, E., Khattak, S., Maden, M., Epperlein, H. H., & Tanaka, E. M. (2009). Cells keep a memory of their tissue origin during axolotl limb regeneration. In Nature (Vol. 460, Issue 7251, pp. 60–65). https://doi.org/10.1038/nature08152
- Hernández, A. G., Martínez, T. M. G., Trejo, M. V., & Akerberg, V. D. Á. (2021). El género Ambystoma en México¿ Qué son los ajolotes?. CIENCIA ergo-sum, Revista Científica Multidisciplinaria de Prospectiva, 28(2).
- Sader, F., & Roy, S. (2022). Tgf‐β superfamily and limb regeneration: Tgf‐β to start and Bmp to end. Developmental Dynamics, 251(6), 973-987
- McCusker, C., Bryant, S.V. and Gardiner, D.M. (2015), The axolotl limb blastema: cellular and molecular mechanisms driving blastema formation and limb regeneration in tetrapods. Regeneration, 2: 54-71. https://doi.org/10.1002/reg2.32
- Vogg, M. C., & Galliot, B. (n.d.). Blastema Essays on Developmental Biology, Part A.
- UNIPROT. Identificador: A9LJ20 https://www.uniprot.org/uniprotkb?query=tgf-beta%20axolotl
- Brown, K. A., Pietenpol, J. A., & Moses, H. L. (2007). A tale of two proteins: Differential roles and regulation of Smad2 and Smad3 in TGF‐β signaling. Journal of cellular biochemistry, 101(1), 9-33.
- Denis, J. F., Sader, F., Gatien, S., Villiard, É., Philip, A., & Roy, S. (2016). Activation of Smad2 but not Smad3 is required to mediate TGF-β signaling during axolotl limb regeneration. Development, 143(19), 3481-3490.
- Roy, S., & Gatien, S. (2008). Regeneration in axolotls: a model to aim for!. Experimental gerontology, 43(11), 968-973.
- Seifert, A. W., & Muneoka, K. (2018). The blastema and epimorphic regeneration in mammals. Developmental biology, 433(2), 190-199.
- Vieira, W. A., Wells, K. M., & McCusker, C. D. (2020). Advancements to the Axolotl Model for Regeneration and Aging. Gerontology, 66(3), 212–222. https://doi.org/10.1159/000504294.


