Tomar café acorta nuestra vida… ¿o no?
por Lucía Dueñas Prieto & Edurne Gómez Maroto, estudiantes de 3º Biología Sanitaria (Universidad de Alcalá, UAH)

Sabemos que nuestro estilo de vida y hábitos influyen en la salud y en el funcionamiento de nuestro organismo. Durante años, el consumo de café ha estado ligado a efectos negativos sobre la salud y al envejecimiento debido, principalmente, al acortamiento de los telómeros, pero… ¿Cómo afecta realmente el consumo de café a nivel molecular? ¿Es esta idea totalmente cierta?
Este artículo se centrará en el estudio del café y en aclarar su modo de acción sobre los telómeros en relación al envejecimiento molecular.
1. IMPORTANCIA DEL TELÓMERO:
La longitud de los telómeros es un biomarcador tanto del pasado replicativo como del potencial replicativo de las células. Cada vez hay más pruebas que apoyan la idea de que los telómeros desempeñan un papel importante en la senescencia, puesto que se ha demostrado que aquellos individuos con telómeros más cortos tienen un mayor riesgo de muerte prematura en comparación con aquellos con telómeros más largos. La longitud de los telómeros es predictiva de los años de vida sana.
1.1. ¿QUÉ SON LOS TELÓMEROS?
Los telómeros son los extremos de los cromosomas, los cuales van a resultar fundamentales para que los distintos cromosomas no se unan entre sí. Se caracterizan por ser regiones de DNA no codificante y altamente repetitivas. Son estructuras que van a dar estabilidad estructural a los cromosomas, y en la división celular. Las repeticiones teloméricas permiten que no se pierda esta información.
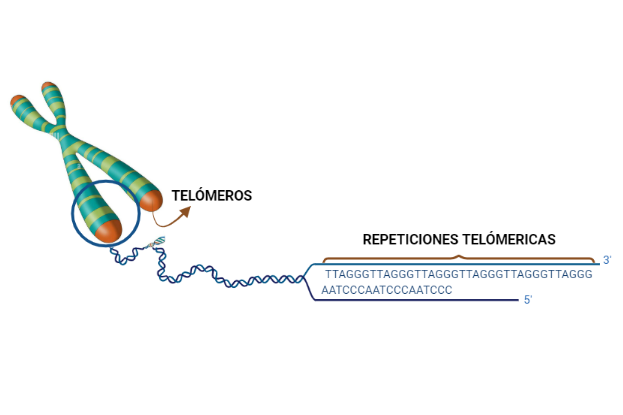
Imagen 1. Situación de los telómeros y repeticiones teloméricas. Imagen realizada en Biorender. (https://app.biorender.com/).
Los eucariotas presentan una característica diferente respecto a los procariotas, y es que tienen un final abierto, por lo que hay un problema: el acortamiento telomérico. Este consiste en que cada replicación se va acortando la secuencia del final, lo que nos lleva a la secuencia de Hayflick, que es el número limitado de replicaciones que puede tener la línea de una célula; en humanos es de hasta 40-60 replicaciones.
1.2. ESTRUCTURA DE LOS TELÓMEROS: G-CUADRUPLEXOS.
Los G-cuadruplexos son un tipo estructural de DNA. Su estructura se basa en 3 bases (XXX) + 3 G (GGG) + 3 bases (XXX). Estas estructuras rompen su estructura de DNA B, la molécula se abre y se unen las guaninas entre ellas formando pares de Hoogsteen, que es la estructura más estable entre guaninas. Se trata de 3 planos de una tétrada de guaninas que se estabilizan con un catéter metálico (normalmente es K+ y a veces Na+). Hablamos de G-tétradas, debido a que se produce una asociación de cuatro guaninas emparejadas a través de enlaces de hidrógeno de Hoogsteen, que se apilan verticalmente.
Los G-cuadruplexos son fundamentales en el funcionamiento del telómero, pues protegen la terminación de los genes de la acción de nucleasas.
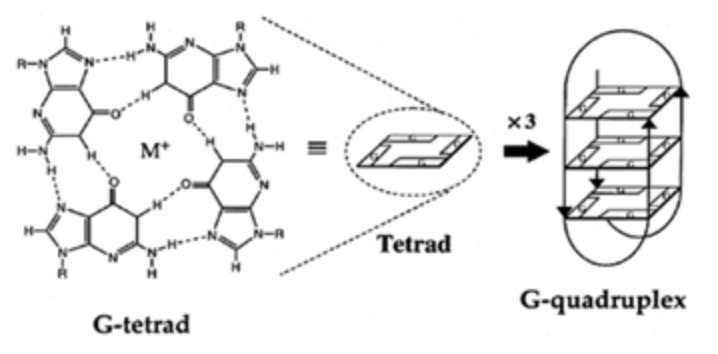
Imagen 2. Estructura normal de los G-cuadruplexos. Esquema obtenido de https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6747389/
1.3. REPLICACIÓN DE LOS TELÓMEROS.
Vamos a explicar brevemente la replicación de los telómeros, para entender el papel de algunas proteínas que se mencionarán en el artículo. Hay dos proteínas en los telómeros:
- La shelterina, la cual se une en la secuencia telomérica y fomentan el plegamiento de esta secuencia (T-loop), anudan el extremo del telómero y protege la secuencia de la acción de las nucleasas.
- La telomerasa, enzima polimerasa reversa, pues tiene un complejo de RNA y proteína, es decir, tiene su propia secuencia de RNA. Sintetiza DNA a partir de un molde de RNA, lo que forma el complejo de TERT. La telomerasa es una enzima altamente regulada para que la longitud de los telómeros se mantenga más o menos constante.
Para que comience la elongación de los telómeros es necesario abrir los G-cuadruplexos para que actúe la maquinaria enzimática de la replicación. Una vez que están abiertos, la telomerasa se encarga de sintetizar DNA. Cuando se termina de sintetizar todo el telómero, cesa su función y se retira. A continuación, el complejo CST recluta la DNA pol α y primasa, que sintetiza el cebador, y continúa la DNA pol δ. Cuando termina, actúa una ligasa para poder unir . De esta manera, se alarga el telómero.
Otras enzimas importantes que participan en el proceso de replicación del telómero son:
- RTLE1: es una proteína helicasa que abre los G-cuadruplexos, es fundamental para el mantenimiento de la estructura del telómero, pues tiene una actividad antirrecombinasa. Cuando el DNA tiene un extremo libre, con un overhang (como ocurriría con el telómero si no estuviese cerrado), es el momento en el que se activan las señales de reparación del DNA: recombinación homóloga, no homóloga y por medio de transposones (o retro).
- Mec1 y Tel1. Tel1 es fundamental para reclutar la telomerasa, con la ayuda de Mec1. Además, se encargan de coordinar la respuesta al daño en el DNA mediante la fosforilación de proteínas implicadas en la reparación del DNA y vías de control. Así estas dos proteínas pueden actuar cuando el DNA esta expuesto a agentes oxidantes. (1)
2. CONEXIÓN ENTRE ESTRÉS OXIDATIVO Y ACORTAMIENTO TELOMÉRICO:
2.1 CONCEPTOS EN RELACIÓN AL DAÑO OXIDATIVO.
A continuación vamos a definir algunos conceptos en relación al daño oxidativo:
- Radicales libres. Es una especie química que va a ser altamente reactiva, con capacidad oxidativa, debido a que presentan uno o más electrones desapareados, y tienden a captar un electrón de moléculas estables. Los radicales libres se forman como productos intermedios en reacciones químicas, por lo que como estas reacciones tienen lugar constantemente en el cuerpo, va a haber unas especies químicas para protegernos de los radicales libres, esta es la función de los antioxidantes.
- Antioxidante. Los antioxidantes son nutrientes que “retardan o previenen la oxidación de otras moléculas”. El modo de acción de los antioxidantes es “romper” y terminar la reacción de oxidación-reducción, eliminando intermediarios del radical libre o inhibiendo otras reacciones de oxidación. De esta manera, son capaces de disminuir el efecto perjudicial que originan los radicales libres. Estas moléculas, de diferente origen y estructura, se pueden encontrar en una gran variedad de alimentos como vegetales, frutas, vino tinto, chocolate, aceites, y café.
- Estrés oxidativo. El estrés oxidativo es una patología celular debida al aumento de la actividad oxidativa en el interior celular, como consecuencia de que las sustancias antioxidantes no son suficientes para combatir la cantidad de radicales libres en sangre. Origina cambios estructurales y funcionales en estas, provocando así envejecimiento celular y con ello una futura apoptosis; por lo tanto causa deterioro tisular y desarrollo de patologías. También, como veremos en este artículo, provoca daños en el DNA, afectando a los telómeros.
- Especies reactivas del oxígeno (ROS). Estas especies van a ser formadas de forma exógena y endógena, desde propios hábitos (fumar, inhalar humo del tabaco, consumo de alcohol y otras drogas, y consumir pocos antioxidantes, o gastarlos muy deprisa debido al metabolismo), que podríamos evitar, hasta el propio el ambiente en el que nos encontramos (radiación, luz solar y radiación UV, y contaminación del aire).
Estar expuestos a alguno de los elementos mencionados anteriormente, van a dar lugar especies reactivas del oxígeno (ROS), moléculas altamente reactivas debido a la presencia de una capa de electrones de valencia desapareada. Son moléculas inestables que contienen oxígeno y que reaccionan fácilmente con otras moléculas en la célula. Los ROS incluyen anión superóxido, peróxido de hidrógeno, radical hidroxilo y especies reactivas del nitrógeno, los cuales tienen que ser combatidos por antioxidantes. Estas especies se producen en la mitocondria durante procesos oxidativos del metabolismo.
Si alcanzamos una situación de estrés oxidativo, y hay sobreproducción de ROS, esto va a conllevar a un deterioro de los componentes celulares (ácidos nucleicos, proteínas y lípidos). Centrándonos en los ácidos nucleicos, pueden causar lesiones de bases, roturas en el DNA, entrecruzamientos entre cadenas…
2.2. ACORTAMIENTO DEL TELÓMERO EN RELACIÓN AL ESTRÉS OXIDATIVO.
Sabemos que los telómeros están en los extremos de los cromosomas, y son ricos en guanina, así que adopta estructuras del tipo G-cuadruplexo, dificultando la actuación de la telomerasa, debido a que hay que abrirlas para que se pueda llevar a cabo la elongación de los telómeros. (2)
Sin embargo, la guanina es la nucleobase más propensa a la oxidación (ya podemos ir deduciendo cúal es el problema). Como los G-cuadruplexos son estructuras ricas en guanina esta será una estructura que responde al estrés oxidativo, porque las guaninas provocarán daño oxidativo en el DNA, dando lugar a lesiones que provocan mutaciones y problemas en la replicación, traducción y transcripción del DNA. (2)
El por qué de la guanina es la nucleobase más propensa a la oxidación, se debe a que tiene un bajo potencial redox. Como resultado de la oxidación se forma 8-oxo-7,8-dihidroguanina, y el problema reside en que ahora esta guanina oxidada aparea con una adenina, en lugar de con una citosina como ocurre en situaciones normales, lo que conlleva a una mutación si no es reparada por los sistemas moleculares. Así, las ROS pueden ocasionar modificaciones en las guaninas, las cuales pueden afectar a la estructura de los G-cuadruplexos al reducir la estabilidad térmica de sus motivos, afectando a la unión de proteínas a la estructura. (2)
Vemos a continuación la estructura de la guanina y de la guanina oxidada:
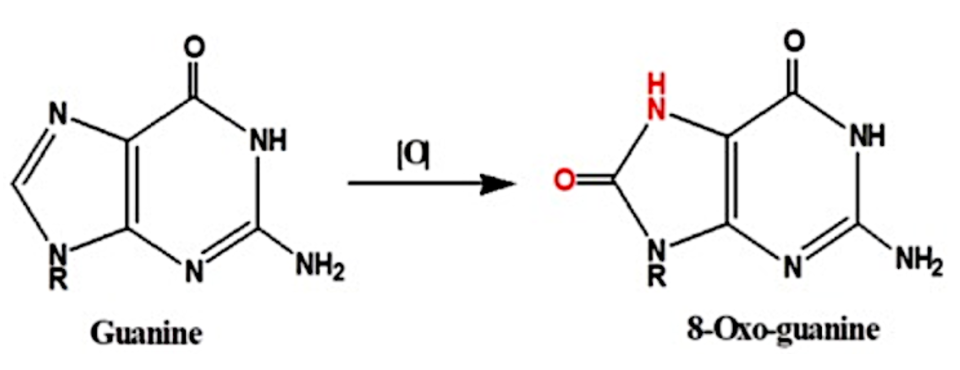
Imagen 3. Oxidación de la guanina a 8-oxo-guanina. Ilustración obtenida de https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6747389/
Ahora observamos cómo sería el apareamiento normal de la guanina con una citosina:
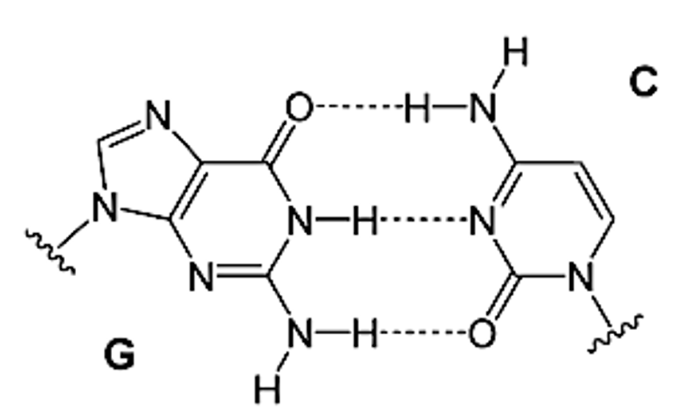
Imagen 4. Apareamiento normal, guanina con citosina. Ilustración obtenida de https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6747389/
Aquí observamos el apareamiento que tiene lugar entre la guanina oxidada con una adenina:
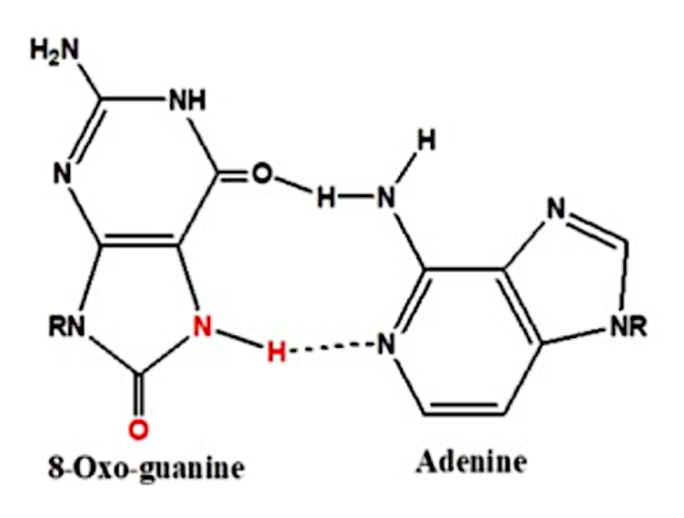
Imagen 5. Apareamiento entre guanina y adenina. Ilustración obtenida de https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6747389/
Vemos que el enlace entre la guanina – citosina, es un triple enlace, mucho más fuerte y estable que el que se forma entre la 8-oxo-guanina – adenina, el cual es un doble enlace, así entre G-C hay un emparejamiento de bases de Watson y Crick, y en el caso de 8-oxo-G – A hay un emparejamiento de bases de Hoogsteen. Esto supone que la ausencia de un tercer enlace de hidrógeno en el emparejamiento de Hoogsteen indica menor estabilidad, como ya hemos comentado, lo que conduce a la obstrucción de la formación de la tétrada de los G-cuadruplexos. (2)
Vemos cómo sería la tétrada de G-cuadruplexos con guanina:
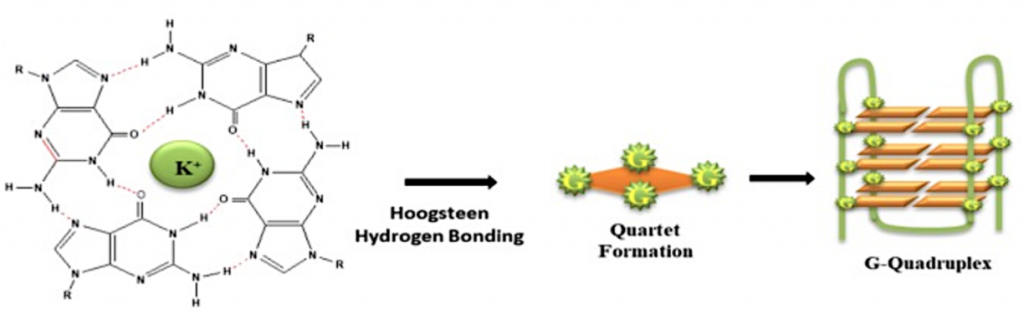
Imagen 6. Estructura G-cuadruplexos. Ilustración obtenida de https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6747389/
Y así es cómo se ve alterada la estructura de los G-cuadruplexos si la guanina se oxida, estructura que se encuentra en un estado casi desplegado:
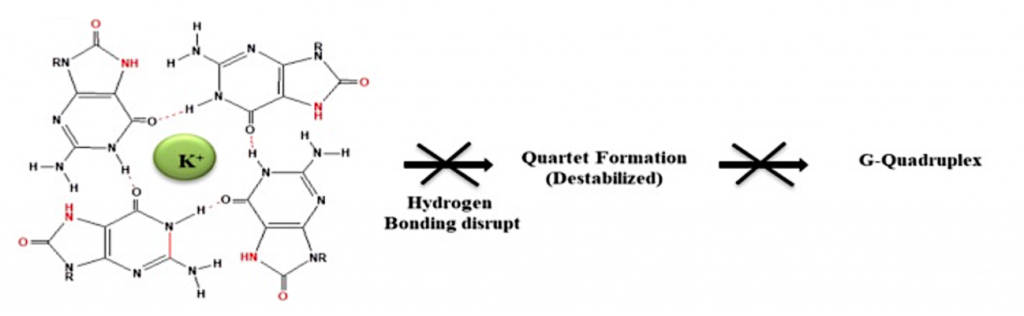
Imagen 7. Alteración G-cuadruplexos. Ilustración obtenida de https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6747389/
Varios grupos de investigación han estudiado este suceso, observando que se llega a oxidar hasta un 50% de la guanina en los G-cuadruplexos, pues es una estructura susceptible al estrés oxidativo. (2)
Lo que ocurre es que esta estructura de G-cuadruplexos se forma en los extremos de los cromosomas para protegerlos de la acción de las nucleasas, porque son extremos libres. Si en presencia de ROS los G-cuadruplexos se despliegan, y no es reparado, estos extremos van a estar expuestos a las nucleasas. Un nivel elevado de 8-oxo-guanina dificulta la actividad de la telomerasa, lo que va a producir un acortamiento de los telómeros, la función y su mantenimiento. (2)
El acortamiento de los telómeros va a producir senescencia prematura. Estudios han demostrado que la pérdida de los telómeros afecta a muchos procesos celulares, produciendo apoptosis, envejecimiento, carcinogénesis e inestabilidad cromosómica. Si esto no se repara, se producen roturas en el DNA y aparición de mutaciones puesto que ha habido un apareamiento 8-oxo-G – A que supone ante una posible futura replicación la aparición de un apareamiento A – T, cambiando completamente la base inicial. (2)
Hay estudios con fibroblastos humanos normales en los que por la incorporación de ROS, se aceleró el acortamiento de los telómeros en la replicación, lo que supuso roturas teloméricas de una sola hebra debido a los radicales libres. (2)
Roturas de una hebra en los telómeros supone la activación de vías de reparación, homóloga o no homóloga, pudiéndose dar lugar, en el caso de la reparación no homóloga, a los círculos teloméricos que llevarían a una situación anómala, de muerte o malignificación de la célula (2).
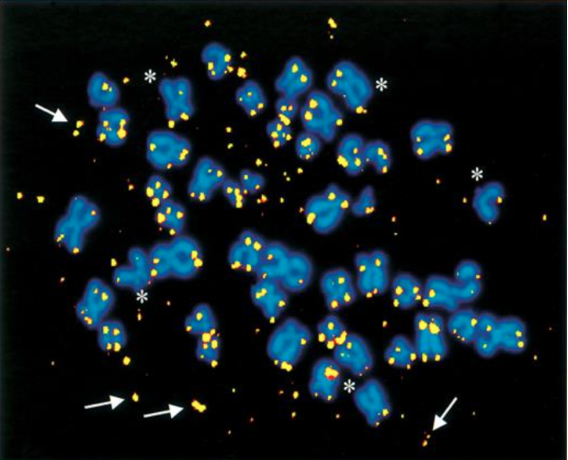
Vemos a continuación una imagen aportada por dicho estudio, se trata de “Múltiples fragmentos de ADN telomérico extra cromosómico en una célula en metafase A-T de un cultivo expuesto a una dosis alta de peróxido de hidrógeno (algunos de los fragmentos se indican con flechas) (…)”.
Imagen 8. Imagen obtenida de https://academic.oup.com/hmg/article/12/3/227/622382
3. EL CAFÉ:
A día de hoy, el café sigue siendo una de las bebidas más consumidas a nivel mundial debido, en gran parte, a su capacidad de mantener a los individuos en estado de alerta, a parte de por su buen aroma y sabor.
Generalmente, el consumo de café está relacionado con efectos negativos sobre la salud (existen creencias a nivel médico acerca de sus potenciales efectos adversos) y con estilos de vida poco saludables (relacionado con el tabaquismo, menos horas de sueño…), lo cual le otorga en ocasiones una imagen perjudicial.
Sin embargo, algunos estudios recientes demuestran que estaría asociado a un menor riesgo de padecer ciertas enfermedades o retrasar el envejecimiento, lo que se podría relacionar con el hecho de que contiene una gran concentración de antioxidantes.
3.1. GENERALIDADES DEL CAFÉ. ORIGEN Y COMPONENTES.
Se denomina café a la bebida preparada a partir de las semillas del fruto de los cafetos (arbusto tropical del género Coffea spp. ). Comprende muchas especies, sin embargo, sólo se cultivan Arábica y Robusta. Produce frutos carnosos rojos con dos núcleos que contienen cada uno un grano o semilla (3).

Granos de café. 
Fruto de la planta del café. 
Planta del café (Coffea spp. ), también conocida como cafeto.
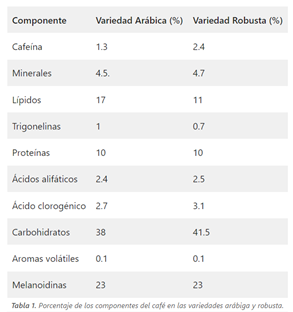
El café está compuesto por una gran cantidad de sustancias de diferente naturaleza química (se estiman alrededor de 1000). La mayoría han sido identificadas y están relacionadas con su aroma y sabor. La concentración de estas sustancias en el café es diferente en cada una de las variedades de café y el grano de tostado. (Tabla 1) (3).
En este caso, nos centraremos en dos de ellas: la cafeína y los ácidos clorogénicos, los cuales son muy abundantes, y además, poseen propiedades antioxidantes.
3.1.1. Cafeína:
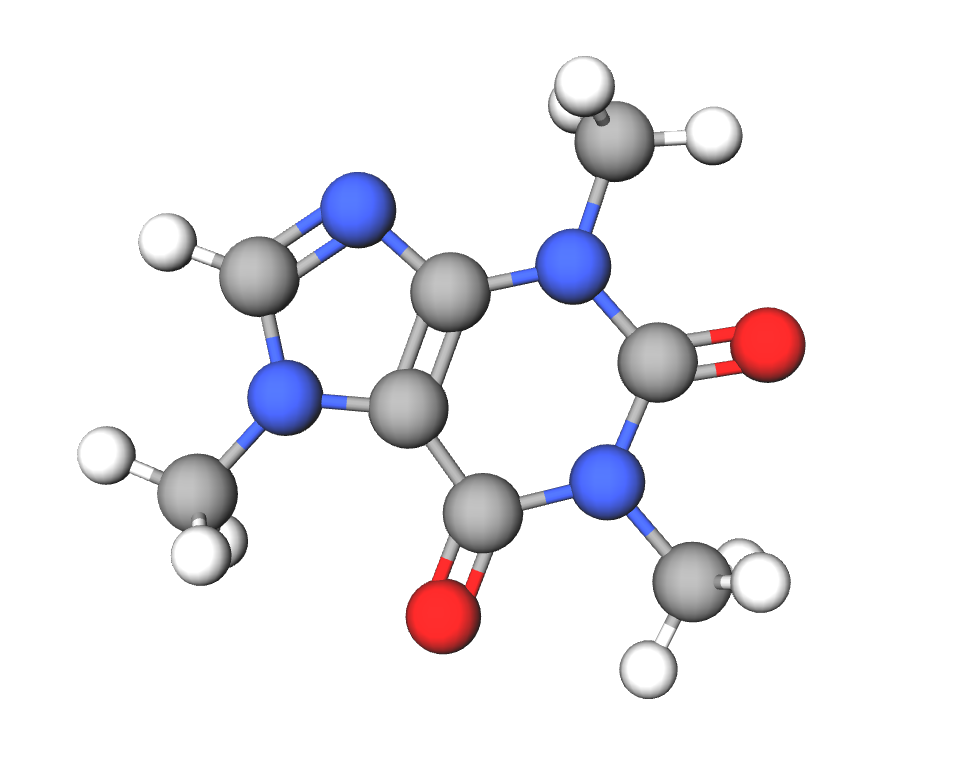
Tiene otros nombres como mateína o teína. Se trata de una molécula pequeña, que se conoce como 1,3,7-trimetilxantina. En su estructura contiene bases púricas no canónicas como la xantina (4). Es una de las tres metilxantinas que se encuentran en el café (3).
Imagen 9. Estructura molecular de la cafeína (1,3,7-trimetilxantina). Ilustración obtenida de https://molview.org/?cid=2519 (aquí también puedes ver la imagen en 3D).
Se encuentra de forma natural en el té (Camellia sisensis), cacao (Theobroma cacao) y obviamente, en el café. Además, se añade en bebidas de consumo habitual como son las bebidas energizantes y cola (3).
Sus funciones se basan principalmente en que actúa como antagonista del receptor de adenosina (del tipo A2a) los cuales son receptores inhibitorios de la señal sináptica. La cafeína estimula al Sistema Nervioso Central (SNC) permitiendo que la transmisión sináptica permanezca activa y de esta manera, se origina un estado de alerta y disminución de la somnolencia. También tiene efectos sobre el sistema cardiovascular, es estimulante de la respiración y se le atribuye una ligera acción diurética (4).
Actualmente se están realizando ensayos clínicos para poder estudiar su posible efecto en la prevención de enfermedades respiratorias pulmonares en prematuros, así también como en tratamientos contra la ansiedad, la diabetes de tipo II o la arteriosclerosis, junto con otras enfermedades cardiovasculares (3).
3.1.2. Ácidos clorogénicos:
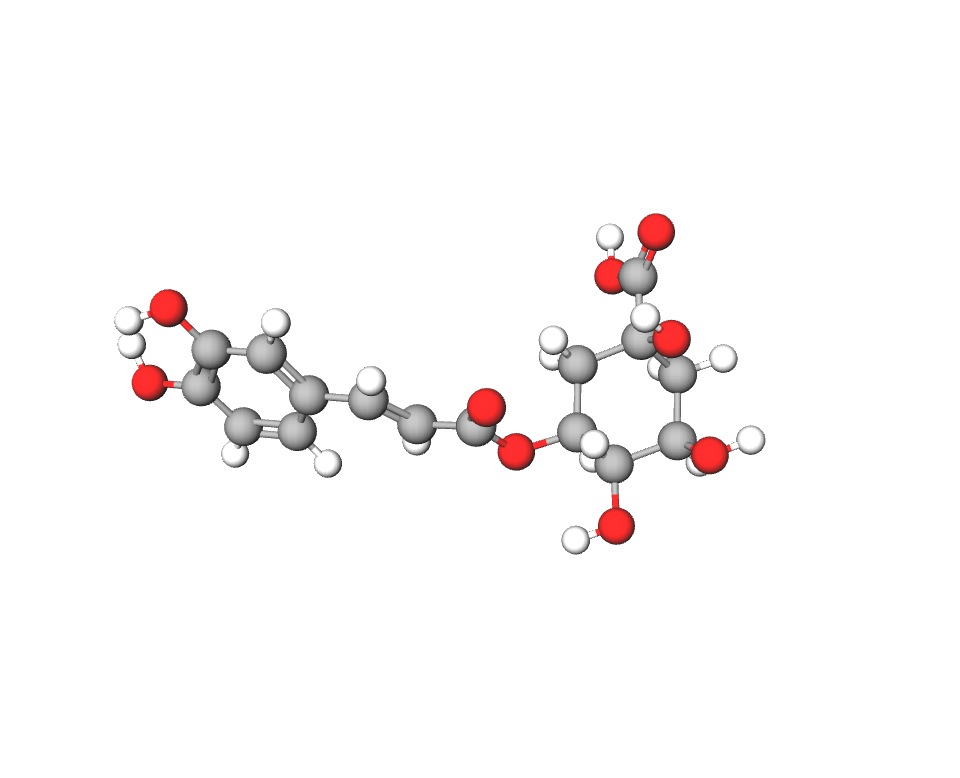
Químicamente son ésteres fenólicos (polifenoles). Derivan de la unión éster entre el ácido cafeico y el ácido quínico. En el café se han identificado un total de 11 ácidos clorogénicos, pero generalmente se refiere a aquel que se encuentra en mayor cantidad, que es el 5-O-cafeolquínico (3).
Imagen 10. Estructura del ácido 5-O-cafeolquínico. Ilustración obtenida de https://molview.org/?cid=5280633 (Aquí también puedes ver la imagen en 3D)
Se encuentra de manera natural en el té negro (Camellia sinensis) y en el café (3).
Entre algunas de sus funciones se encuentran: inhibe las metaloproteínas de la matriz, regula el metabolismo de la glucosa y de los ácidos grasos, favorece la secreción biliar y tiene cierta acción hipertensiva, favoreciendo la vasodilatación (3)(5).
Gran parte del ácido clorogénico es metabolizado en el colon por la microbiota, disminuyendo su actividad antioxidante pero favoreciendo su biodisponibilidad (3).
Ha sido utilizado en ensayos sobre el tratamiento del cáncer en estado avanzado y tratamientos para la tolerancia a la glucosa (puede ser de ayuda para las personas que sufren de diabetes de tipo II) y contra la obesidad (3) (5).
3.2. ¿CONSUMIR CAFÉ ES BENEFICIOSO O PERJUDICIAL?. EFECTOS SOBRE LOS TELÓMEROS. VENTAJAS Y DESVENTAJAS.
Debido a las importantes propiedades del café, existe un considerable interés sobre sus efectos por parte de Salud pública, sobre todo en los últimos años, donde se tiene en cuenta cada vez más cómo nuestra forma de vida afecta a nuestra salud.
Por ello, a pesar de que existen varios estudios que investigan cómo afecta el consumo de café al desarrollo de ciertas enfermedades, o en este caso, a la longitud de los telómeros, es un campo que está poco desarrollado en general porque los estudios son muy recientes. Se necesita más investigación, resultados más concluyentes y mecanismos que los puedan explicar con más precisión.
Una de las primeras investigaciones, publicada en The Journal of Nutrition realizó un estudio a más de 4700 enfermeras para descubrir si los niveles variables de consumo de café o cafeína estaban asociados con la longitud de los telómeros (en este caso, leucocitarios). Para ello, la información acerca del consumo de café se obtuvo a partir de cuestionarios de frecuencia alimenticia, con diferentes variables, y se midió la longitud relativa de los telómeros en leucocitos mediante técnicas de biología molecular (6).
Tras realizar el experimento, se encontraron asociaciones lineales significativas con telómeros más largos para un mayor consumo de café total con cafeína. Más concretamente, en comparación con las no bebedoras de café, las probabilidades de tener una longitud de los telómero por encima de la mediana fueron alrededor del 29% en aquellas enfermeras que bebían de 2 a 3 tazas de café al día, y un 36% para aquellas que bebían 3 o más tazas al día. Sin embargo, no se obtuvieron resultados significativos para el consumo de café descafeinado (6).
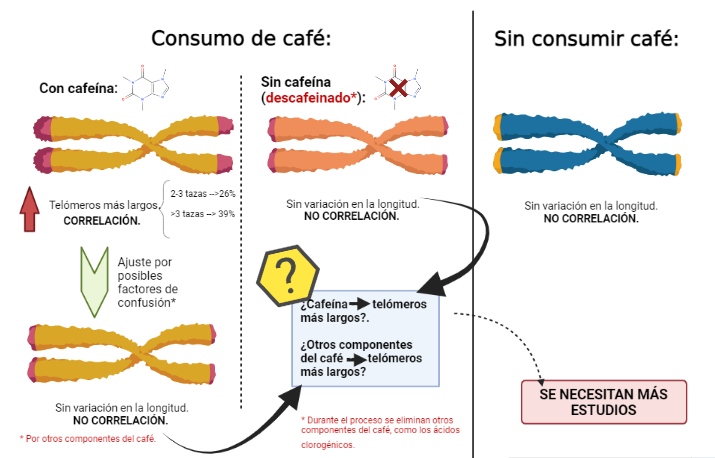
Los resultados del experimento nos indicarían que la capacidad antioxidante del café sería mayor debido a la cafeína. Sin embargo, después de realizar un ajuste adicional por el consumo total de café (como un ajuste indirecto de los posibles factores de confusión de los otros antioxidantes en el café), desapareció la correlación. Esto sugiere que los otros compuestos del café podrían ser los responsables de la asociación entre el café y la longitud de los telómeros, sin descartar por completo a la cafeína (6).
Imagen 11. Imagen realizada en Biorender. https://app.biorender.com/.
Esta idea además, podría verse reforzada por el hecho de que, durante el proceso de descafeinización, no solo se reduce la concentración de cafeína, sino también se puede reducir las concentraciones de otros antioxidantes como los ácidos clorogénicos (6).
En conclusión, los hallazgos de este primer estudio sugirieron que el consumo de café (especialmente con cafeína) se asociaba con telómeros más largos, pero se necesitaban estudios adicionales para poder aclarar esta idea y que explicaran como los compuestos de café estarían involucrados en en el mantenimiento de los telómeros (6).
En otro estudio posterior, se decidió observar los cambios en la longitud del telómero frente a diferentes estímulos externos, como la temperatura, el alcohol o la cafeína. Para realizar el experimento, se utilizó un cultivo de levaduras (Saccharomyces cerevisiae), a las que se les sometió a un total de 13 estímulos estresantes durante 400 generaciones para estudiar los mecanismos responsables de las alteraciones de la longitud de los telómeros en varias condiciones de estrés (7).
Mutaciones en al menos un 6% de los genes TLM (mantenimiento de la longitud de los telómeros) conducen a la alteración del tamaño de los telómeros. La homeostasis precisa de la longitud de los telómeros depende de una gran red genética que incluye alrededor de 400 genes (conservados en gran medida desde el punto de vista evolutivo). Esta red puede verse afectada precisamente, por varias señales ambientales y diferentes mecanismos de regulación (7).
En el caso concreto de la cafeína, se identificó a las proteínas Tel1 y Mec1 como proteínas directamente afectadas. Es decir, por primera vez se identificó que estas proteínas medían el estrés por la cafeína (7).
La cafeína es un inhibidor de las quinasas relacionadas con la fosfatidil inositol-3 quinasas (quinasas similares a PI3K) como la ATR humana y la ATM y sus contrapartes de levadura, Tel1 y Mec1. Por lo tanto, se estudió si las mutaciones en estos genes diana abolirían el acortamiento de los telómeros causado por la cafeína (7).
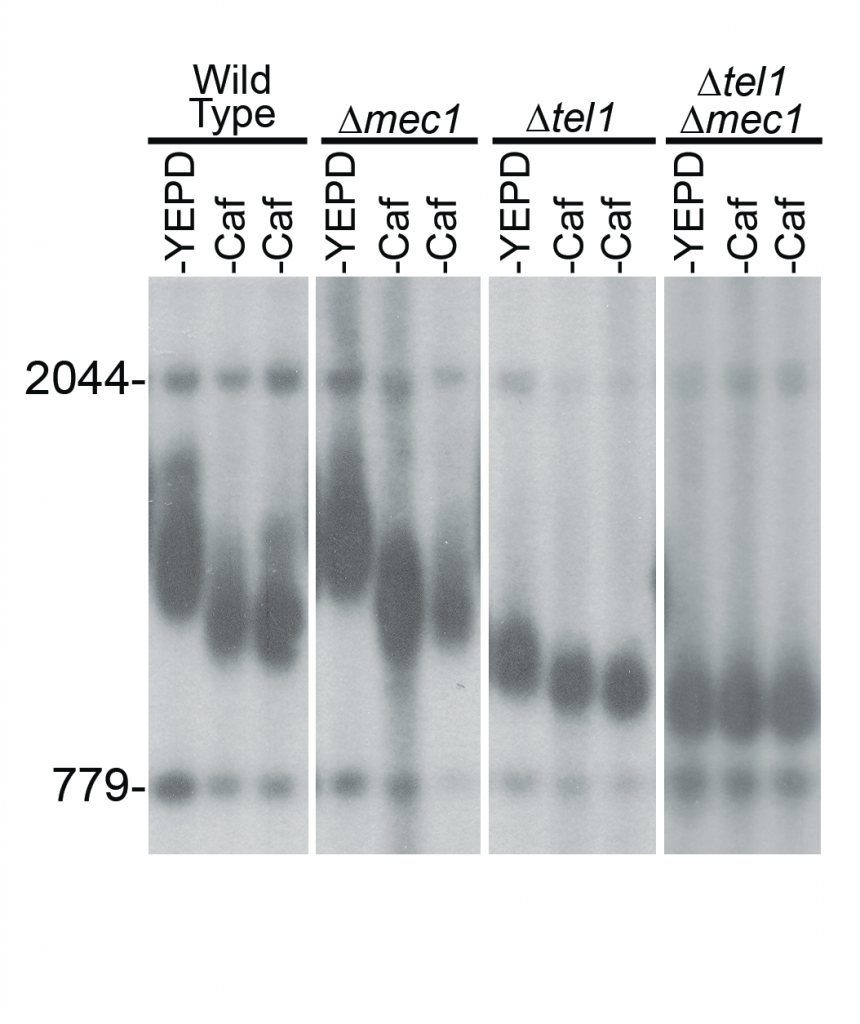
Durante el experimento se llegó a la conclusión de que la supresión de tanto Tel1 o Mec1 individual no frena la respuesta a la cafeína (acortamiento de los telómeros). Sin embargo, un doble mutante tel1Δ- mec1Δ es completamente insensible al efecto telomérico de la cafeína, en consonancia con la función conocida que desempeñan estas dos quinasas en la biología de los telómeros (7).
Imagen 12. Células de tipo salvaje (sin modificar genéticamente), así como las dos colonias independientes en donde se eliminaron los genes codificantes para MEC1 y TEL1 mostraron acortamiento por el efecto de la cafeína. Sin embargo, la cepa de dobles mutantes tel1Δ- mec1Δ no mostró acortamiento telomérico por el efecto de la cafeína. (7)
Por tanto, gracias a este estudio se pudo llegar a la conclusión de que, realmente, la cafeína provoca el acortamiento de los telómeros al inhibir las quinasas reguladoras de tipo ATM / ATR (7).
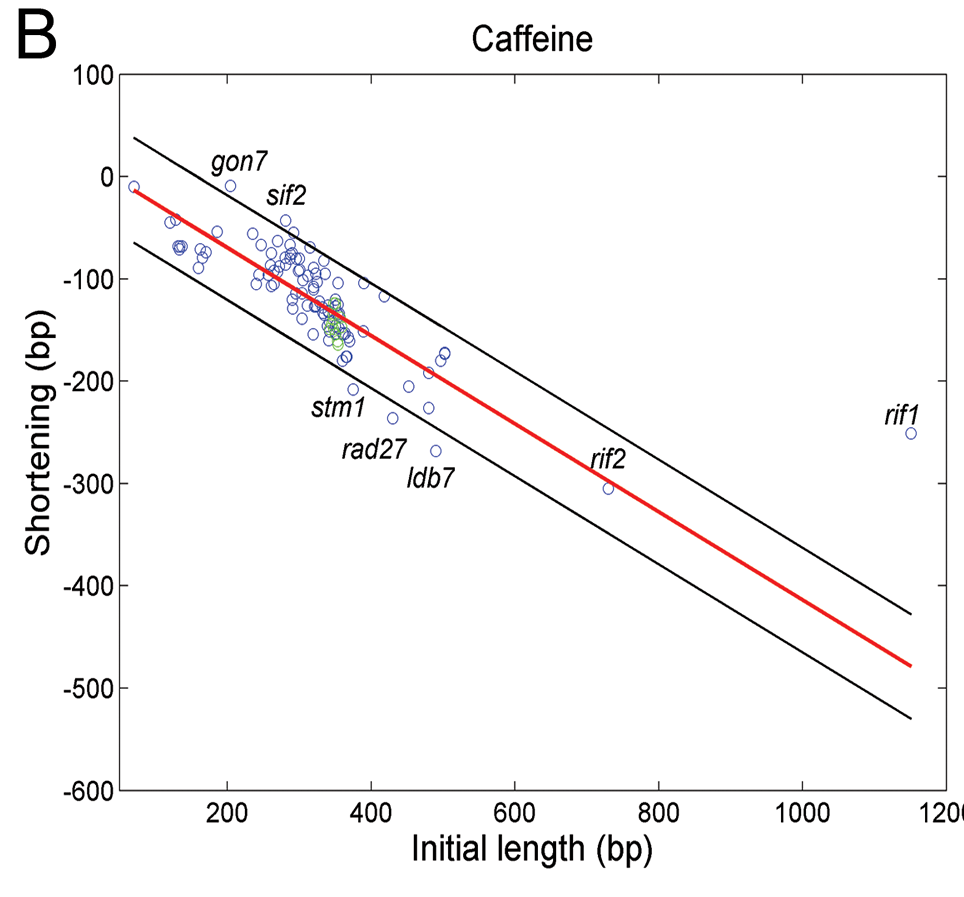
Imagen 13. Se muestra como afecta la cafeína a la longitud de los telómeros en cepas que mostraban deleciones u otras mutaciones. El eje X muestra la longitud inicial de cada mutante y el eje Y muestra el acortamiento tras 100 generaciones. (7)
Por último, se necesitaba un estudio en el que se pudiera comparar el efecto de la cafeína y el café de manera conjunta.
Los hallazgos del estudio realizado por Larry Tucker (Universidad Brigham Young, en EE.UU), basado en la encuesta nacional NHANES, sugieren que cuanta más cafeína consumían los participantes, más cortos eran los telómeros. Por cada 100 mg de cafeína consumida, los telómeros eran 35,4 pares de bases más cortos tras eliminar el efecto de la edad y de otros factores (8).
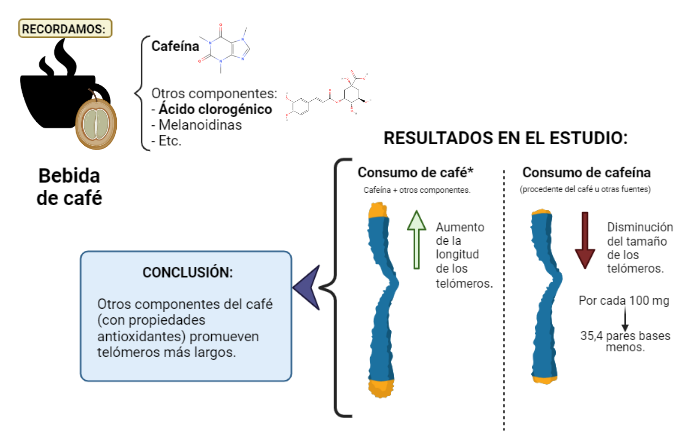
Sin embargo, el consumo de café demostró un efecto opuesto sobre la longitud de los telómeros: cuanto más café bebían, más largos eran sus telómeros, de forma independiente a las covariables (8).
Entonces, propone que el café en sí tiene propiedades beneficiosas para la longitud de los telómeros, pero se debe a los otros compuestos y no a la cafeína (8).
Imagen 14. Imagen realizada en Biorender (https://app.biorender.com/.).
Por lo tanto, significa que el consumo de cafeína procedente de otras fuentes distintas del café, como bebidas energéticas, suplementos y refrescos de cola, supone telómeros más cortos y es tan poco saludable como lo es para los que no beben café (8).
El objetivo de otros estudios más recientes se ha basado en encontrar una posible relación entre el consumo de café y el desarrollo de diferentes patologías, observando la variación del tamaño de los telómeros en las mismas. En un estudio realizado en el año 2020 por Ferruchi (Universidad de Yale, EE.UU) se evaluó la asociación transversal entre la ingesta de café y la longitud de los telómeros en los controles de cuatro estudios previos realizados para la detección de varios tipos de cáncer (9).
La conclusión general fue, otra vez, que los bebedores moderados y los bebedores en exceso (más de 3 tazas de café al día) tienen entre 2 y 3 veces más probabilidad de tener una longitud de telómeros por encima de la mediana, a pesar de que fuera poco probable que el consumo de café desempeñara un papel en las posibles asociaciones con la enfermedad (9).
2.2.1. Aspectos beneficiosos del consumo de café.
– Aspecto antioxidante (3):
La actividad antioxidante del café se debe tanto por los ácidos clorogénicos (concretamente del 5-O-cafeoilquínico) como a la presencia de cafeína y otros compuestos derivados del tostado.
Los ácidos clorogénicos son reconocidos como grandes antioxidantes. La capacidad antiradical hidroxilo (OH.) del café depende del ácido 5-O-cafeoilquínico. Actúa como captador de radicales libres superóxido.
Por otra parte, el proceso de tostado del café induce la formación de compuestos (como las melanoidinas) que también poseen actividad antioxidante. Como gran parte de los ácidos clorogénicos se pierden durante el tostado, el origen de nuevas moléculas con capacidad antioxidante compensa este hecho.
La cafeína tiene la capacidad de inhibir los efectos del estrés oxidativo provocado por radicales hidroxilos (OH.), peróxidos (ROO.) y oxígeno singlete. A pesar de que la cafeína se considera un gran antioxidante, los resultados de los estudios comentados sugieren que la cafeína no sería el componente con más propiedades beneficiosas, porque también puede actuar acortando los telómeros, tal y como hemos comentado anteriormente.
Los estudios han demostrado que el café y sus componentes, menos la cafeína, pueden proteger contra el daño oxidativo del DNA porque constituye un alimento con alta capacidad antioxidante al disminuir los niveles de los radicales ROS. De esta manera, se previene el daño provocado en la secuencia o estructura del DNA, y más concretamente, del telómero.
– Expresión de la TERT de la telomerasa (10)*.
Sin embargo, hace poco se ha descubierto que el consumo exclusivo de cafeína tiene, sorprendentemente, aspectos positivos sobre la longitud del telómero, contradiciendo los hallazgos de los estudios anteriores.
Los resultados de un estudio realizado recientemente por la Escuela de Biotecnología, Universidad de Ciencia y Tecnología de Tianjin han revelado que la cafeína promueve la expresión de la transcriptasa inversa de la telomerasa (TERT), esto ocurre tanto a niveles de ARNm como de proteínas. Como consecuencia, permite una mayor tasa de extensión de la longitud de los telómeros y previene la senescencia celular.
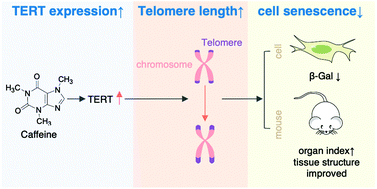
Este estudio se basó en un experimento realizado sobre ratones, a los cuales se les trató con cafeína durante ocho meses. Se observó la extensión de la longitud de los telómeros en el bazo y timo de los ratones, además de un cambio estructural histológico del timo, bazo e hígado de los ratones y la reducción de los niveles de beta-galactosidasa (un biomarcador de la senescencia) en las células.
Imagen 15. Posibles efectos de la cafeína sobre los telómeros: aumento de la expresión de TERT y disminución de la senescencia celular. (10)
Estos resultados sugieren que la cafeína podría promover la expresión de TERT para retrasar la senescencia celular y el envejecimiento.
3. CONCLUSIÓN:
La ingesta de café es generalizada en gran parte del mundo. Está relacionada con una serie de consecuencias beneficiosas pero también perjudiciales para la salud.
La longitud de los telómeros es un biomarcador de la senescencia de las células, y por tanto, del envejecimiento. Podemos concluir según los estudios realizados, que a medida que aumenta la ingesta de café, los telómeros tienden a ser más largos; sin embargo, un mayor consumo de cafeína supone el acortamiento de los mismos. Por lo tanto, el consumo de café moderado podría ser positivo para retrasar el envejecimiento.
Estos estudios no suponen la última palabra sobre los beneficios para la salud del café en cuanto a la longitud de los telómeros, dado que hallazgos recientes se contradicen con otros resultados anteriores; sino un comienzo y una llamada de atención para realizar más investigaciones sobre una posible vía para mejorar la salud y la calidad de vida de las personas.
4. BIBLIOGRAFÍA:
- Singh, A., Kukreti, R., Saso, L., & Kukreti, S. (2019). Oxidative stress: Role and response of short guanine tracts at genomic locations. International Journal of Molecular Sciences, 20(17), 4258. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6747389/
- Tchirkov, A., & Lansdorp, P. M. (2003). Role of oxidative stress in telomere shortening in cultured fibroblasts from normal individuals and patients with ataxia-telangiectasia. Human Molecular Genetics, 12(3), 227–232. https://doi.org/10.1093/hmg/ddg023
- Gotteland, M., & de Pablo, S., V. (2007). Algunas verdades sobre El café. Revista Chilena de Nutricion: Organo Oficial de La Sociedad Chilena de Nutricion, Bromatologia y Toxicologia, 34(2), 105–115. https://doi.org/10.4067/s0717-75182007000200002
- Caffeine. (n.d.). Retrieved January 3, 2022, from https://go.drugbank.com/drugs/DB00201
- PubChem. (n.d.). Chlorogenic acid. Nih.Gov. Retrieved January 3, 2022, from https://pubchem.ncbi.nlm.nih.gov/compound/1794427
- Liu, J. J., Crous-Bou, M., Giovannucci, E., & De Vivo, I. (2016). Coffee consumption is positively associated with longer leukocyte telomere length in the nurses’ Health Study. The Journal of Nutrition, 146(7), 1373–1378. https://doi.org/10.3945/jn.116.230490
- Romano, G. H., Harari, Y., Yehuda, T., Podhorzer, A., Rubinstein, L., Shamir, R., Gottlieb, A., Silberberg, Y., Pe’er, D., Ruppin, E., Sharan, R., & Kupiec, M. (2013). Environmental stresses disrupt telomere length homeostasis. PLoS Genetics, 9(9), e1003721. https://doi.org/10.1371/journal.pgen.1003721
- Tucker, L. A. (2017). Caffeine consumption and telomere length in men and women of the National Health and Nutrition Examination Survey (NHANES). Nutrition & Metabolism, 14(1), 10. https://doi.org/10.1186/s12986-017-0162-x
- Steiner, B., Ferrucci, L. M., Mirabello, L., Lan, Q., Hu, W., Liao, L. M., Savage, S. A., De Vivo, I., Hayes, R. B., Rajaraman, P., Huang, W.-Y., Freedman, N. D., & Loftfield, E. (2020). Association between coffee drinking and telomere length in the Prostate, Lung, Colorectal, and Ovarian Cancer Screening Trial. PloS One, 15(1), e0226972. https://doi.org/10.1371/journal.pone.0226972
- Tao, L., Zhang, W., Zhang, Y., Zhang, M., Zhang, Y., Niu, X., Zhao, Q., Liu, Z., Li, Y., & Diao, A. (2021). Caffeine promotes the expression of telomerase reverse transcriptase to regulate cellular senescence and aging. Food & Function, 12(7), 2914–2924. https://doi.org/10.1039/d0fo03246h


