Silvia Domínguez Toledo y Leire Fernández Crippa. Biología Sanitaria UAH.
INTRODUCCIÓN
En las últimas décadas del siglo XX tuvo lugar la aparición de los primeros casos del Síndrome de Inmunodeficiencia Adquirida (SIDA), siendo este el inicio de una de las peores epidemias de toda la historia de la humanidad.
Tanto la falta de conocimiento sobre cómo prevenir la enfermedad como el continuo cambio en la estructura biológica del virus causante, provocaron una tasa creciente en el número de infectados y por lo tanto la propagación de una de las más temidas enfermedades de los siglos XX y XXI que afecta a millones de personas hoy en día y que ha dejado a su paso millones de víctimas.
La inexistencia de una vacuna efectiva hace de la terapia farmacológica la herramienta más útil y de mayor uso contra la infección del virus de inmunodeficiencia humana tipo 1 (VIH–1), el retrovirus responsable de dicha enfermedad. Estas terapias se conocen como terapias antirretrovirales altamente activas. La mayoría de éstas hacen uso de dos clases de fármacos que actúan a distintos niveles del ciclo de infección con el fin de mantener la replicación del virus bajo control y observar, como consecuencia, un aumento en el recuento de linfocitos T4. [1]
PROCESO de REPLICACIÓN del VIH-1
Como ya hemos mencionado anteriormente, el VIH pertenece a la familia de los retrovirus, un tipo de virus capaces de sintetizar ADN de doble cadena utilizando como molde una molécula de ARN monocateriano. Contiene dos copias idénticas de ARN de cadena simple, que codifican para proteínas estructurales y no estructurales del virus.
El mecanismo de replicación de este retrovirus comienza con la infección por VIH-1. Una vez dada la infección, se experimenta un proceso en el que interaccionan las glicoproteínas de la envoltura viral con los receptores de los linfocitos CD4 de la persona infectada. Esta interacción genera un cambio conformacional en la estructura de las glicoproteínas virales, favoreciendo la fusión de membranas del virus y la célula huésped.
Una vez fusionadas las membranas, el núcleo del virus se sitúa en el citoplasma celular del huésped, dando lugar al inicio del “uncoating”,un proceso en el cual la cápside del virus libera el “complejo de transcripción reversa” (conjunto enzima-sustrato) , sobre el que actuará la enzima transcriptasa inversa. [1]

ESTRUCTURA de la TRANSCRIPTASA INVERSA
Las enzimas son proteínas que catalizan reacciones químicas en los seres vivos y su función es acelerar aquellas reacciones que espontáneamente podrían producirse. [3]
Descubierta por David Baltimore y Howard Temin en 1970, la transcriptasa inversa o retrotranscriptasa es una enzima de tipo ADN-polimerasa presente en los ya mencionados retrovirus. Esta enzima cataliza la reacción de transcripción inversa, posibilitando la síntesis de ADN de doble cadena y por lo tanto la replicación del retrovirus dentro de la célula a la que infectan. [2][4]
La transcriptasa inversa del VIH-1 es una proteína heterodimérica asimétrica compuesta por dos subunidades que están relacionadas entre sí, p66 y p51.
La subunidad p66 es la más grande y la conforman un total de 560 aminoácidos. A su vez, está compuesta por dos dominios catalíticos: sitio de ADN-polimerasa (POL) y sitio de ribonucleasa (RNasa H). El dominio POL está compuesto por cuatro subdominios que abarcan una serie de residuos. Estos se conocen como: dedos, palma, pulgar y conexión, debido a la similitud de la estructura de la enzima con una “mano”, como podemos ver a continuación.
Por otro lado la subunidad p51 está compuesta por 440 aminoácidos y se pliega en los mismos cuatro subdominios que p66, aunque con diferentes posiciones. La subunidad p51 tiene un papel relacionado con la estructura y es la encargada de proporcionar soporte para los sitios activos en p66. [1]

MECANISMO de ACTUACIÓN de la TRANSCRIPTASA INVERSA
Y ¿Cómo lleva a cabo la transcriptasa inversa su función?
Pues bien, en primer lugar entra en la célula la hebra monocateriana de ARN a partir de la fusión de las membranas de la célula y del virus, que lleva consigo la transcriptasa inversa. Como ya hemos mencionado anteriormente, esta enzima tiene dos sitios catalíticos: sitio de ADN-polimerasa (POL) y sitio de ribonucleasa (RNasa H).
En segundo lugar, el sitio POL es capaz de sintetizar una cadena simple de ADN (en dirección 5’-3’) a partir de la plantilla de ARN procedente del virus y de un cebador.
Este cebador consiste en una secuencia de 18 nucleótidos que corresponde al tRNALys3 (El tRNALys3 es el primer de la transcriptasa inversa del VIH-1 y se incorpora selectivamente al VIH-1 durante el ensamblaje viral) y que es complementario al sitio de unión al cebador (PBS) una secuencia de igual longitud en el extremo 5’ del genoma viral de ARN. El tRNA de la célula huésped hibrida con el PBS, formando el híbrido al que conocemos como el cebador del ARN, lo que permite que el sitio POL inicie la síntesis de la cadena de ADN.
En un primer paso, el sitio POL forma una cadena doble híbrida de ARN-ADN que el sitio RNasa H utilizará posteriormente como sustrato con el fin de separar la cadena híbrida. Para llevar a cabo esta separación, la cadena de ARN entra en un proceso de degradación a manos del dominio RNasa H, con la excepción del tracto de polipurina (PPT), una región de la cadena de ARN rica en 5 purina que es resistente a la acción de este dominio. Debido a su resistencia, permanecerá pareada a la región de ADN complementaria y más tarde estos fragmentos del PPT servirán como cebadores para la síntesis de la segunda cadena de ADN (en dirección 5’-3’). Durante la síntesis de esta cadena, se desplazan las secuencias PBS y PPT del ARN, formándose así la cadena de ADN doble.
Cuando se ha formando la cadena doble de ADN viral, se incorpora al núcleo celular a través de la membrana nuclear y se inserta en el genoma del huésped por medio de una integrasa. Este genoma integrado es capaz de utilizar la maquinaria celular a su favor, transcribiendo sus genes y proteínas e iniciando un nuevo proceso infeccioso. [1][4]

PAPEL BIOLÓGICO
Debido a que la infección por el virus de la inmunodeficiencia humana es un problema de salud global, con un aumento de casos cada año, se investigan varios tratamientos en contra del VIH. Actualmente no hay cura del VIH pero sí tratamientos para intentar combatirlo y mejorar la calidad de vida de los enfermos.
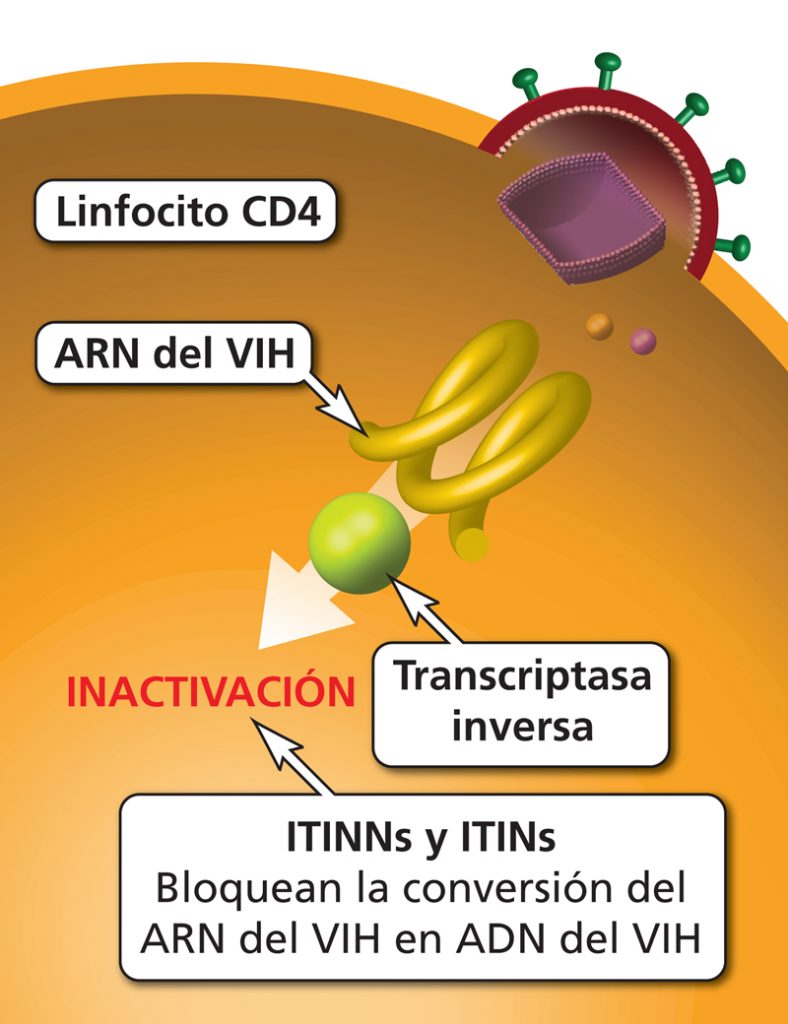
Por ejemplo, se están desarrollando una serie de inhibidores nucleótidos o no nucleótidos de la transcriptasa reversa, estos fueron los primeros fármacos aprobados para el tratamiento por infección de VIH.
Estos inhibidores se basan en bloquear la transcripción inversa, de manera que no se produzca la retrotranscripción.
Sin embargo este tipo de inhibidores también bloquean las actividades de la transcriptasa reversa humana y la ADN polimerasa, proteínas importantes para el crecimiento y reproducción celular. Por ello pueden interferir con las funciones celulares normales en células no infectadas y en células sí infectadas.
Aún que con estos inhibidores se logra una reducción de la carga viral, debido a que este virus muta frecuentemente ya se han encontrado mutaciones resistentes a este tipo de tratamientos. [5]
Fuente.
Para los más interesados dejamos un estudio de estos inhibidores. [8]
Actualmente está pendiente de desarrollo una vacuna contra el VIH. Se trata, por ejemplo, de vacunas vivas atenuadas, que se basan en limitar o eliminar la capacidad patogénica del virus, pero conserva su capacidad de inducir una respuesta inmune celular y humoral, por lo tanto no es una estrategia ideal para este tipo de virus.
Cabe señalar que hay más tipos de vacunas que se están estudiando.[6]
Dentro del tratamiento antirretroviral contra el VIH se encuentran actualmente fármacos antirretrovirales que pertenecen a tres grupos principales: los inhibidores de unión, los inhibidores de la proteasa y los inhibidores de la transcriptasa inversa (ITI). Los inhibidores de la transcriptasa inversa (ITI) pueden ser o no análogos de los nucleósidos. Los inhibidores no nucleósidos de la TI (INNTI) impiden la retrotranscripción del ARN. [7]
IMPORTANCIA BIOMÉDICA
La familia de las transcriptasas inversas posee gran importancia en el campo de la biomedicina, como por ejemplo causando una de las enfermedades sexuales más conocidas y con mayor número de infectados como es el SIDA, y además cabe señalar que se puede utilizar para detectar la presencia de virus como explicaremos a continuación.
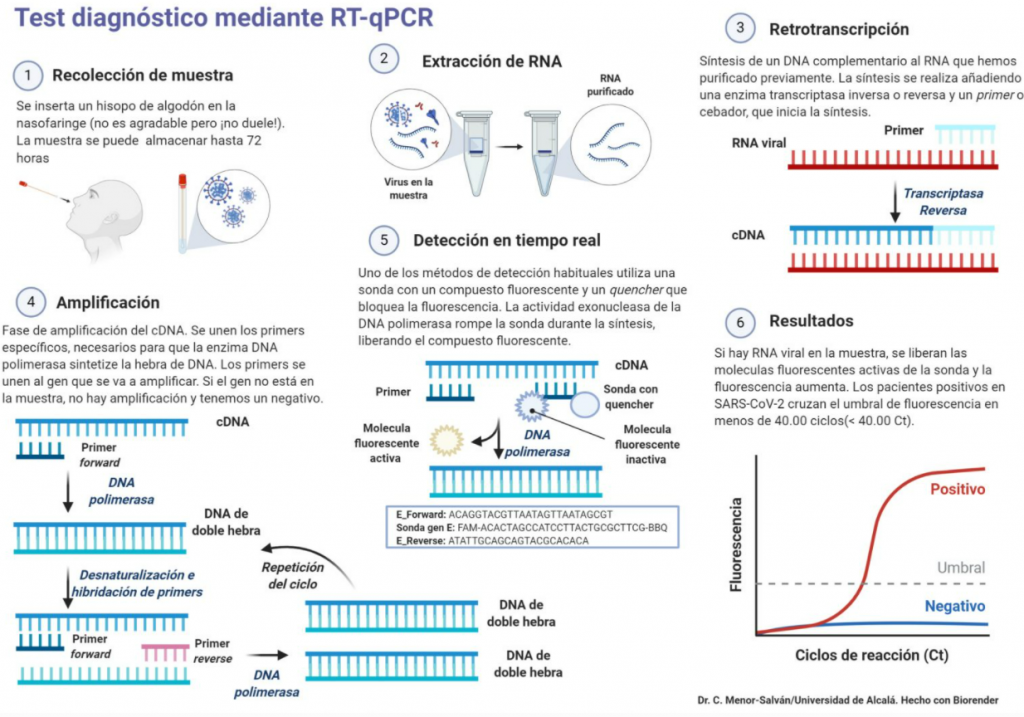
Actualmente y debido a la pandemia ocasionada por el COVID-19, la familia de las transcriptasas inversas ha obtenido un papel importante debido a que gracias a ellas se puede diagnosticar la presencia o ausencia del virus mediante una PCR, más en concreto una RT-PCR.
Se basa en detectar la presencia de material genético específico de los patógenos como en este caso SARS-Cov2.
¿Y cómo funciona la RT-PCR?
En primer lugar se toma una muestra del paciente en zonas donde se acumula el virus introduciendo un hisopo, como por ejemplo la nariz y esta muestra es tratada por varias disoluciones en las que, a continuación solo se extrae el ARN de la muestra.
Tras esto, se produce la transcripción inversa de dicho ARN gracias a la acción de las transcriptasas inversas, y se convierte en una molécula de ADN.
A esta molécula de ADN se le van añadiendo fragmentos de ADN que complementan el ADN vírico, si el virus está presente en la muestra los fragmentos se añaden a partes concretas del ADN vírico, si por el contrario, el ADN no es vírico, estas moléculas no se unen al ADN.
A medida que se van añadiendo dichos fragmentos y se va replicando más ADN vírico, mientras que en los ordenadores del laboratorio van apareciendo marcas de fluorescencia, cuando dicha fluorescencia supera un nivel, se puede afirmar que el paciente está infectado de dicho virus. [9]
Fuente.
Para más información pinche aquí.
DATOS VIH
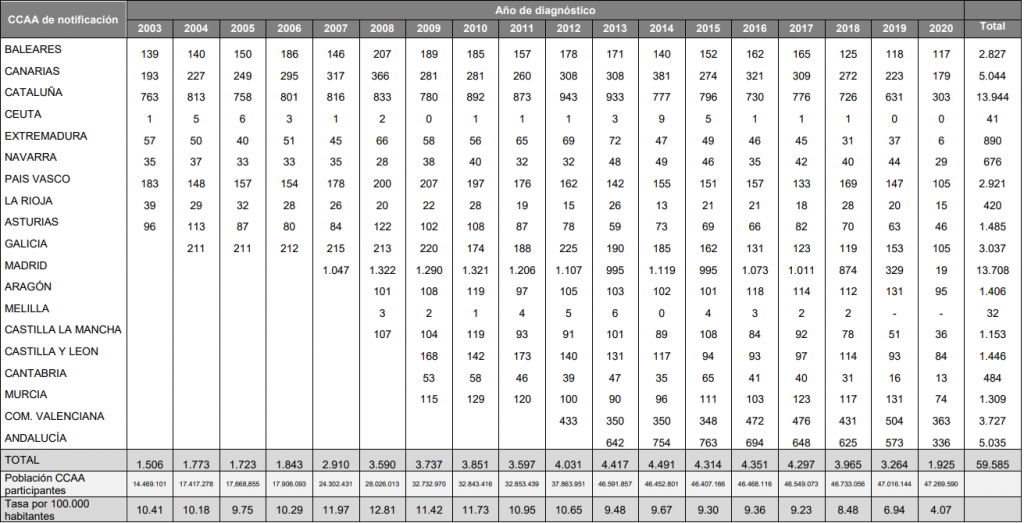
Para reflejar la importancia de lo que causa esta enzima debido a la enfermedad que produce adjuntamos los datos de las personas infectadas por VIH en los últimos años.
En el año 2020 se notificaron 1.925 nuevos diagnósticos de VIH. Comparados con los casos diagnosticados en 2019, se observa un descenso del 41% en los nuevos diagnósticos de VIH de 2020, notificados en 2021. [10]
Fuente.
Para más información sobre los datos en España sugerimos visitar este enlace.
REFERENCIAS
[1] I.F. Tonatiuh Benítez González “Síntesis y modelado farmacofórico basado en la estructura de la transcriptasa reversa del VIH tipo 1 de amidas derivadas del β2-triptófano” Mayo, 2017
[2] Fundación Instituto Roche/ Glosario de genética: «transcriptasa inversa» https://www.institutoroche.es/recursos/glosario/transcriptasa+inversa
[3] Enzimas. Aspectos generales. http://www.ehu.eus/biomoleculas/enzimas/enz1.htm
[4] Miguel Ángel Lendínez y Celia Izurrategui. Biología Sanitaria. Universidad de Alcalá de Henares. Chemevol: «RETROTRANSCRIPCIÓN Y RETROVIRUS»
https://chemevol.web.uah.es/wp/index.php/2021/01/06/retrotranscripcion-y-retrovirus/
[5] Inhibidores de Transcriptasa Reversa (msd.com.mx)
[6]Carmona-Pérez, L., Acevedo-Sáenz, L., & Rugeles, M. T. (2013). Avances en el desarrollo de una estrategia efectiva para la vacuna contra el virus de la inmunodeficiencia humana. Vacunas, 14(4), 162-170.
[7] Velásquez, A. C. Docking de compuestos novedosos derivados de piridinona potencialmente inhibidores de transcriptasa inversa del VIH-SIDA. Estudio teórico y experimental del ácido 2, 2′-azino-bis-(3-etilbenzotiazolin-6-sulfónico) para la búsqueda, 40.
[8] Puche, D. Tratamiento combinado de Antiretrovirales con Inmunix plus en adultos con infección por VIH-SIDA.
[9] Detección del virus de la COVID-19 mediante la RT-PCR en tiempo real | OIEA (iaea.org)
[10] Unidad de vigilancia de VIH, ITS y hepatitis. Vigilancia Epidemiológica del VIH y sida en España 2020: Sistema de Información sobre Nuevos Diagnósticos de VIH y Registro Nacional de Casos de Sida. Plan Nacional sobre el Sida – División de control de VIH, ITS, Hepatitis virales y tuberculosis-DG de Salud Pública / Centro Nacional de Epidemiología – ISCIII. Madrid; Nov 2021.


