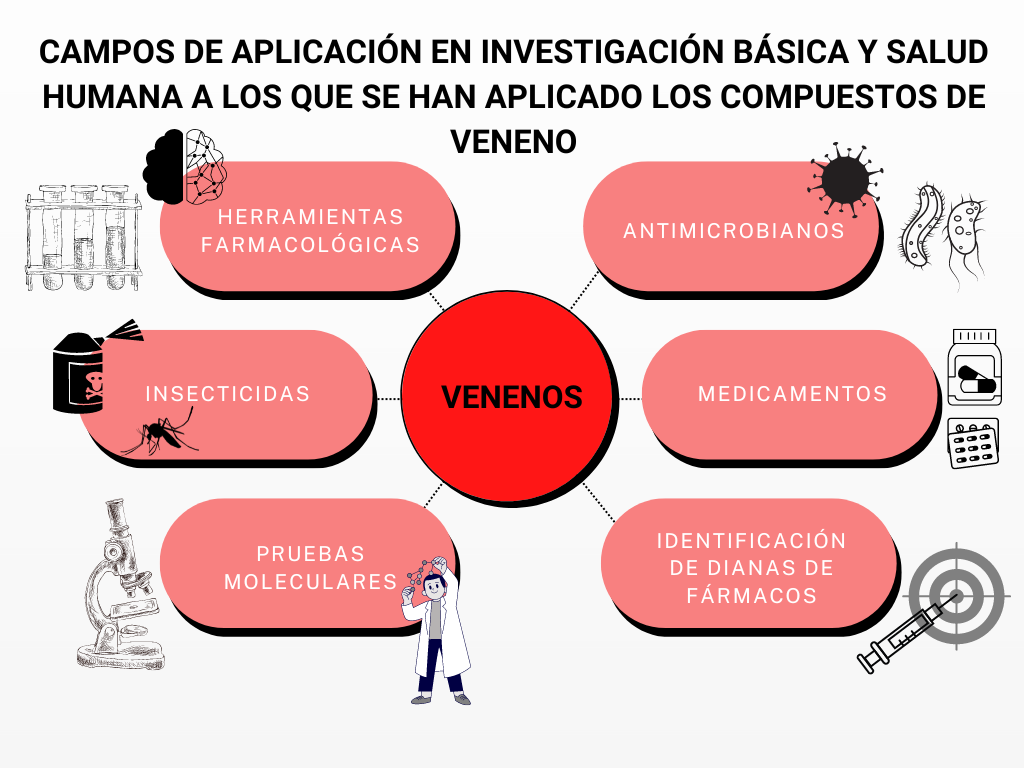
Veneno: nuestro aliado
Por Lorea Ayape, 3º Biología Sanitaria. Universidad de Alcalá.
Introducción
Desde la introducción de la insulina hace casi un siglo, se han comercializado más de 80 fármacos peptídicos para el tratamiento de una amplia gama de enfermedades, como la diabetes, el cáncer, la osteoporosis, la esclerosis múltiple, la infección por VIH y el dolor crónico (Muttenthaler et al., 2021). Los grandes avances en biología molecular y química peptídica siguen haciendo progresar este campo, así como la venómica integrada, una estrategia emergente que crea nuevas vías para el descubrimiento de fármacos peptídicos (Muttenthaler et al., 2021).
A continuación, explicaremos un ejemplo de cómo los venenos, esas sustancias dañinas que presentan ciertos animales de los que muchos huimos despavoridos, pueden convertirse en nuestros aliados con ayuda de la ciencia, pues contienen determinados péptidos que podemos usar en nuestro beneficio. Para ello, le propongo al lector que visualice a nuestra protagonista: la tarántula, ese animal grande y peludo de 8 patas que tan rápido se mueve con, aparentemente, enormes ganas de morder a su víctima humana cuando nos encontramos frente a él. No obstante, las tarántulas tienen poca importancia clínica debido a que no son muy agresivas y evitan el contacto con el entorno humano (Murray, Rosenthal and Pfaller, 2021). Sin más dilación, comencemos a tratar esta curiosidad científica y, quizás, incluso les terminemos cogiendo un poquito de cariño a las arañas.

Necesidad de un nuevo analgésico
Recientemente, se han descubierto determinados componentes del veneno de tarántulas capaces de bloquear la ruta por la que se envían las señales de dolor al cerebro.
El estudio de Klint et al. ha sido realizado debido a la gran necesidad clínica que tenemos de crear analgésicos eficaces para tratar el dolor crónico, puesto que la mayoría de los fármacos disponibles actualmente tienen una eficacia limitada y efectos secundarios que limitan la dosis (Klint et al., 2015). Por su parte, el dolor crónico es un importante problema de salud en todo el mundo que afecta a una media del 15% de las personas adultas (Gaskin and Richard, 2012). Además, tan solo en Estados Unidos, la carga económica anual que supone el dolor crónico es de unos 600.000 millones de dólares, lo que supera el coste económico en conjunto del cáncer, la diabetes y los accidentes cerebrovasculares (Gaskin and Richard, 2012).
En definitiva, la prevención en dolor crónico es muy importante al ser un problema muy extendido, producir una inestimable cantidad de sufrimiento y constituir un coste económico enorme (Rodríguez-Marín, Bernabeu and Hofstadt, 2021).
Fisiología de los canales de sodio dependientes de voltaje
La comunicación celular en el sistema nervioso se basa en fenómenos de señalización eléctrica y química mediados por canales iónicos (Boron, 2017). En las células con dicha propiedad es posible desencadenar un impulso eléctrico denominado potencial de acción, que actúa como una señal capaz de propagarse a grandes distancias a lo largo de las fibras nerviosas o musculares. La conducción de los potenciales de acción permite que se pueda transmitir información a través de nervios desde los órganos hacia el cerebro (Boron, 2017). En el ejemplo que tratamos, las señales que se envían al cerebro viajan mediante la vía del dolor.
Por otro lado, debemos conocer los canales de sodio dependientes de voltaje (NaV), unas proteínas situadas en la membrana de estas células especiales que permiten el paso de los iones sodio a su través. Si no hay canales de sodio, no se producen potenciales de acción y, por tanto, tampoco se transmiten las señales.
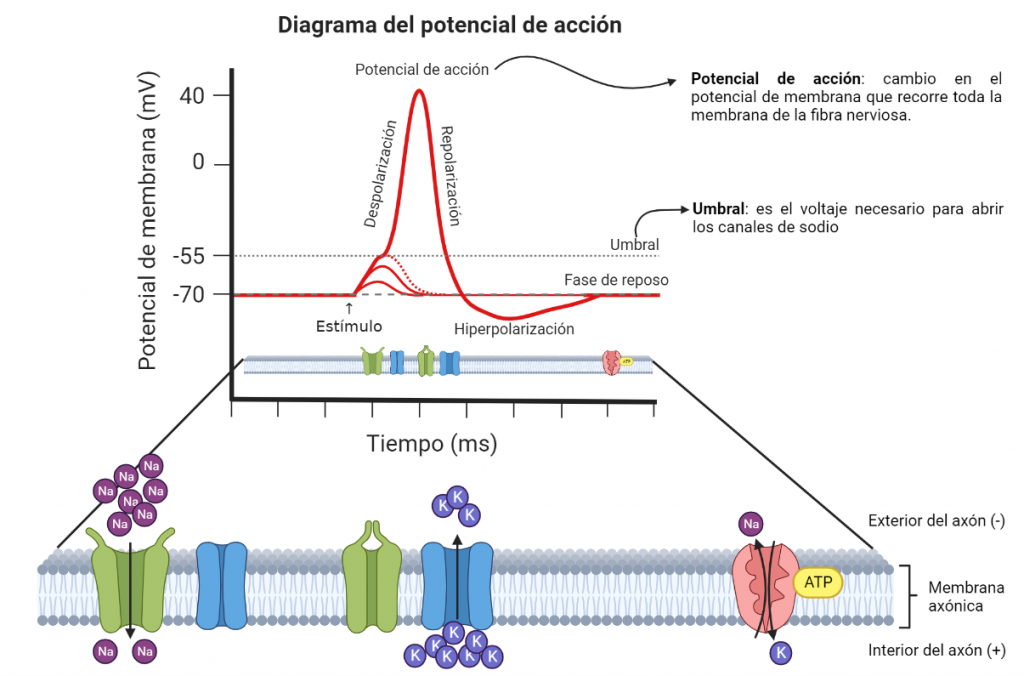
Diagrama elaborado a partir de un modelo de BioRender.
En concreto, el hNaV1.7 es un canal de sodio presente en las neuronas nociceptivas. Estudios anteriores ya han demostrado que las mutaciones de pérdida de función en el gen que da lugar al hNaV1.7 generan una insensibilidad a todas las formas del dolor (Cox et al., 2006).
Estos hallazgos sugieren que el hNaV1.7 podría ser una buena diana en la investigación de nuevos fármacos para el tratamiento del dolor (Boron, 2017). Es por todo ello que Klint et al. se han centrado en los canales de sodio, específicamente en el hNaV1.7.
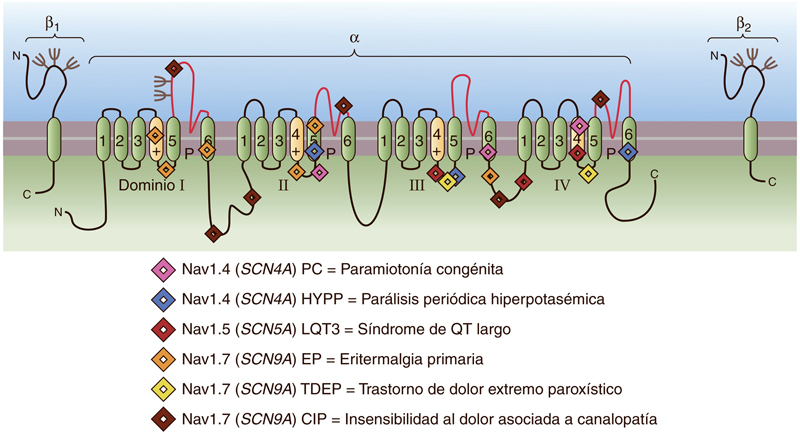
Imagen obtenida de Boron, W. F. (2017) ‘Excitabilidad eléctrica y potenciales de acción’, in Fisiología médica. third, pp. 172–189.
Relación entre las arañas y los analgésicos
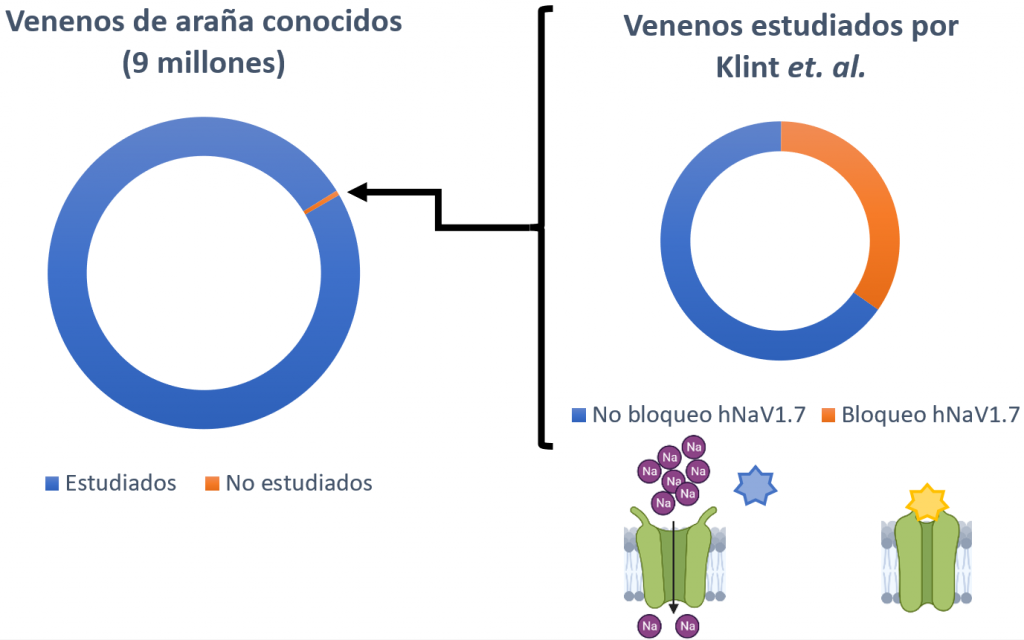
Las arañas son el grupo que más animales venenosos alberga. A su vez, existe un total de 9 millones de péptidos de veneno de araña, de los cuales solo se ha explorado un 0,01% (Klint et al., 2015); por lo tanto, estos venenos suponen una gran fuente para buscar nuevos moduladores del canal hNaV1.7.
En total se analizaron los venenos de 206 especies de arañas, de los cuales un 40% presentaban algún compuesto capaz de bloquear al canal hNaV1.7 (Klint et al., 2015). Finalmente, la estructura del Hd1a (un péptido de la araña Haplopelma doriae) demostró que se trataba del mejor candidato a posible analgésico, puesto que presenta una gran estabilidad química, térmica y biológica (Klint et al., 2015). Además, inhibió el hNaV1.7 con un alto nivel de selectividad sobre todos los demás subtipos, excepto el hNaV1.1 (Klint et al., 2015).
Otros canales de sodio como diana de analgésicos
A partir de una serie de venenos que activan neuronas sensoriales de ratón, Osteen et al. aislaron dos péptidos (Hm1a y Hm1b) del veneno de la tarántula Heteroscodra maculata que activaban tan sólo a unas pocas neuronas sensoriales (Osteen et al., 2016). Después comprobaron que el efecto de dichos péptidos era bloqueado mediante la tetrodotoxina (TTX), la cual actúa inhibiendo a los canales de sodio activados por voltaje (NaV) (Osteen et al., 2016). Esto llevó al descubrimiento de que los péptidos aislados son agonistas de los canales NaV1.1 y, a su vez, de que éstos están implicados en la señalización del dolor, lo cual se desconocía hasta entonces (Osteen et al., 2016).
También se demostró que el NaV1.1 regula la excitabilidad de unas fibras nerviosas que transmiten señales de dolor a la médula espinal, con lo que este canal iónico también se convirtió en una posible diana analgésica (Osteen et al., 2016). De hecho, se ha comprobado que los inhibidores del NaV1.1 reducen la hipersensibilidad mecánica en varios modelos de dolor visceral crónico (Salvatierra et al., 2018).
Es decir, en este caso los péptidos de araña mencionadas no se usarían como analgésico contra NaV1.1 (como veíamos en el caso anterior), puesto que realmente contribuyen a que dichos canales produzcan su efecto. No obstante, Hm1a y Hm1b permitieron descubrir que el NaV1.1 está relacionado con la señalización del dolor, posicionándolo así como un objetivo más contra el que aplicar analgésicos.
Conclusiones
El proceso de elaboración de un nuevo fármaco requiere muchísimos años, no solo por las fases que debe superar dicho medicamento hasta aparecer en las farmacias, sino también por el trabajo previo que implica detectar la diana correcta y el compuesto capaz de dirigirse hasta ella afectándola específicamente, como hemos podido comprobar.
Por su parte, todavía quedan millones de péptidos de veneno sin ser explorados, debido a la lentitud del método tradicional de descubrimiento, en el que las fracciones crudas de veneno se analizan frente a dianas conocidas, seguidas de purificación y secuenciación para dilucidar la secuencia de una diana (Muttenthaler et al., 2021).
En esta entrada del blog nos hemos centrado en algunos estudios con péptidos de arañas, pero los escorpiones y los caracoles cono también proporcionan una de las más ricas diversidades químicas (Muttenthaler et al., 2021). Afortunadamente, los nuevos avances tecnológicos están sentando las bases de un potente enfoque denominado «venómica integrada» (Muttenthaler et al., 2021).
Referencias
- Bonica, J. J. (1976) ‘Organization and function of a multidisciplinary pain clinic’, in Pain. Springer, pp. 11–20.
- Boron, W. F. (2017) ‘Excitabilidad eléctrica y potenciales de acción’, in Fisiología médica. third, pp. 172–189.
- Cox, J. J. et al. (2006) ‘An SCN9A channelopathy causes congenital inability to experience pain’, Nature, 444, pp. 894–898.
- Drenth, J. P. H. and Waxman, S. G. (2007) ‘Mutations in sodium-channel gene SCN9A cause a spectrum of human genetic pain disorders’, Journal of Clinical Investigation, 117(12), pp. 3603–3609. doi: 10.1172/JCI33297.
- Gaskin, D. J. and Richard, P. (2012) ‘The economic costs of pain in the United States’, Journal of Pain, 13(8), pp. 715–724. doi: 10.1016/j.jpain.2012.03.009.
- Herzig, V. et al. (2020) ‘Animal toxins — Nature’s evolutionary-refined toolkit for basic research and drug discovery’, Biochemical Pharmacology, 181(May), p. 114096. doi: 10.1016/j.bcp.2020.114096.
- Klint, J. K. et al. (2015) ‘Seven novel modulators of the analgesic target NaV1.7 uncovered using a high-throughput venom-based discovery approach’, British Journal of Pharmacology, 172(10), pp. 2445–2458. doi: 10.1111/bph.13081.
- Li, T. and Chen, J. (2018) ‘Voltage-Gated Sodium Channels in Drug Discovery’, Ion Channels in Health and Sickness. doi: 10.5772/intechopen.78256.
- Murray, P. R. ., Rosenthal, K. S. . and Pfaller, M. A. (2021) ‘Artrópodos’, in Elsevier (ed.) Microbiología médica. ninth, pp. 791–807.
- Muttenthaler, M. et al. (2021) ‘Trends in peptide drug discovery’, Nature Reviews Drug Discovery, 20(4), pp. 309–325. doi: 10.1038/s41573-020-00135-8.
- Osteen, J. D. et al. (2016) ‘Selective spider toxins reveal a role for the Nav1.1 channel in mechanical pain’, Nature, 534(7608), pp. 494–499. doi: 10.1038/nature17976.
- Rodríguez-Marín, J., Bernabeu, P. and Hofstadt, C. J. van-der (2021) ‘Dolor crónico, enfermedades crónicas y enfermedades terminales’, in Psicología médica. second, pp. 391–412.
- Salvatierra, J. et al. (2018) ‘NaV1.1 inhibition can reduce visceral hypersensitivity.’, JCI insight, 3(11). doi: 10.1172/jci.insight.121000.


 Entrada siguiente
Entrada siguiente
Muy bien