Verano, piscina y desinfección con sal: una introducción a la electrolisis y las leyes de Faraday
Una piscina puede ser un sitio excelente para aprender química. En este experimento sencillo podéis ver como funciona la cloración de piscinas con sal y cómo nos enseña conceptos como la electrolisis y la química del cloro
El mantenimiento de la calidad del agua de una piscina es un interesante problema de química, y no es tan sencillo como parece. Uno de los aspectos claves del agua de la piscina es la desinfección por cloración, que requiere el uso de cloro (Cl2) o hipoclorito (ClO−), poderosos oxidantes y desinfectantes. Un sistema actual efectivo para conseguir la cloración del agua es la “cloración por sal”, en la que se añade a la piscina una determinada cantidad de sal común (cloruro sódico, NaCl) y, aprovechando la química inorgánica del cloro, conseguimos la cloración. Este sistema tiene una serie de ventajas y de inconvenientes, pero para nosotros nos resulta útil como un contexto de interés para enseñar algunos conceptos químicos. En el sencillo experimento que os muestro, veremos cómo funciona la cloración por sal. Esto puede ser útil para la enseñanza de la química a nivel Bachillerato. Como tal, vamos a abordarlo sencillamente y sin tener en cuenta posibles reacciones secundarias más complejas.
Electrolisis
Disolvemos 2-2.5 gramos de NaCl en medio litro de agua, en un vaso grande que usaremos a modo de celda electrolítica:

Esta cantidad de sal supone aproximadamente un 0.5%, algo más baja que la concentración de sal en el suero fisiológico, que es 0.9%. Por ello, esta cantidad en la piscina no produce ni escozor ni molestias, pero es suficiente para desinfectar el agua.
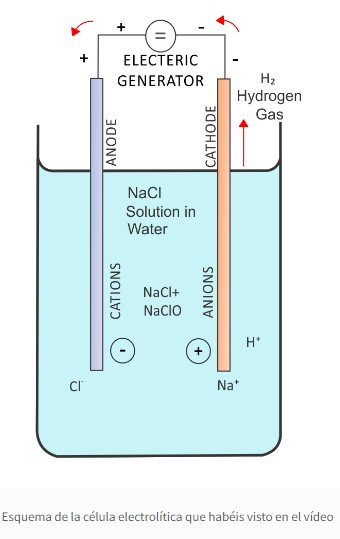
Una vez disuelta la sal, montamos un pH-metro para controlar el pH, así como dos electrodos de grafito para realizar la electrolisis. El pH del agua con sal en nuestro caso es prácticamente neutro (introducimos el concepto de pH).
Una vez sumergidos los electrodos en la disolución de agua con sal, los conectamos a la fuente de alimentación y hacemos pasar una corriente de 100 mA. Los iones de la sal se desplazarán en el campo eléctrico generado por los electrodos, y, en ellos, tendrán lugar unas reacciones químicas. Lo primero que le ocurre a la sal al disolverse en agua, es que se disocia (concepto: compuestos y enlace iónico):
NaCl + nH2O–> Na+(H2O)n + Cl−(H2O)n
El agua hidrata los iones, que se estabilizan en solución. Los iones positivos son atraídos hacia el electrodo negativo (que llamaremos cátodo: el electrodo hacia el que van los cationes o iones positivos) y los iones negativos irán hacia el ánodo (electrodo positivo; nótese que en las pilas la denominación es al revés). Así, tendremos dos situaciones distintas:
Anodo
En él se verifica la reacción (prescindiendo del agua de hidratación de los iones) en la que un anión cloruro libera un electrón, que constituye la corriente eléctrica que fluirá por el electrodo; el átomo de cloro resultante queda adsorbido en la superficie de grafito (concepto: adsorción):
Cl− —> Cl (ad) + e− (reacción de Volmer)
Pero los átomos de cloro son muy inestables y reactivos, por lo que rápidamente tenemos dos posibles reacciones: un átomo reacciona con otro, formándose una molécula de cloro elemental, o bien un átomo reacciona con un ión cloruro, formándose cloro elemental también:
Cl (ad) + Cl (ad) —> Cl2 (reacción de Tafel)
Cl− + Cl (ad) —> Cl2 + e− (reacción de Heyrovsky)
Este mecanismo de formación de cloro se conoce como mecanismo de Tafel-Heyrovsky. En él, la porosidad del electrodo juega un papel clave. El cloro en este mecanismo es muy reactivo, por lo que también reacciona con el carbono del electrodo, formando compuestos clorados que se descomponen después en carbón, cloro y óxidos de carbono. Esto hace que el electrodo sufra corrosión (otro concepto químico implicado), que se manifiesta en desgaste del electrodo y formación de carbón finamente dividido en el agua. Si tenéis un sistema de cloración por sal en la piscina, hay que tener ésto en cuenta para el desgaste de los electrodos.
Cátodo
Aquí no podemos esperar la formación de sodio elemental (Na+ + e− –> Na), debido a que es un metal muy activo. Mientras haya agua, no puede formarse sodio metálico, debido a que su potencial de reducción es negativo, considerando el del hidrógeno como potencial cero. Todos los metales que tengan un potencial de reducción negativo, no pueden formar el metal libre en la electrólisis, y, al revés, los metales con potencial de reducción positivo pueden formar metal en la electrolisis (caso del cobre o la plata). Esto nos permite introducir el concepto de la serie electroquímica. Como el hidrógeno tiene “preferencia” respecto del sodio, la reacción en el electrodo negativo será:
2H2O + 2e− –> H2 + 2 OH−
El hidrógeno es un gas, por lo que se desprenderá en forma de burbujitas, formado gracias a los electrones proporcionados por la corriente eléctrica que estamos suministrando. El cloro también es un gas, pero veremos muchas menos burbujas debido a su solubilidad en agua. Como veis, en la reacción se forma un anión, el hidroxilo o OH−. Para conservar la carga tenemos los cationes Na+ . Globalmente, la reacción que estamos llevando a cabo es:
2 H2O + 2 NaCl —> H2 + Cl2 + 2 NaOH
Y así, con ayuda de la corriente eléctrica, estamos convirtiendo la sal común en cloro, que nos desinfectará el agua. Vamos a verlo:
Llevamos a cabo la electrolisis durante tan sólo un minuto. Veis cómo en el electrodo negativo o cátodo se desprenden abundantes burbujas de hidrógeno, mientras que en el ánodo, a simple vista, no parece pasar mucho. Pero…¿que hay del pH?. Tras un minuto de electrolisis, el pH ha subido hasta 9, haciéndose alcalino. Esto es debido al hidróxido sódico, o NaOH, que se ha formado en la reacción catódica. Este compuesto (también llamado sosa caústica y que podéis encontrar en el súper) aumenta el pH del agua. Un pH alto haría el agua no usable para el baño, por lo que en un sistema de cloración debe controlarse estrictamente. El aumento de pH tiene otra desventaja: puede favorecer la precipitación de carbonato de calcio si el agua de la piscina es muy calcárea. Esto se traduce en turbidez blanca en el agua o formación de depósitos de “cal” en el sistema, algo que hay que tener en cuenta en el mantenimiento de sistemas de cloración por sal. Si agitamos bien y dejamos reposar unos momentos, vemos cómo el pH baja rápidamente, aunque sigue manteniéndose por encima de la neutralidad:

¿por qué al cabo de un poco de tiempo y al agitar se reduce el pH final?. Esto es debido a que el cloro elemental, que hemos generado en el ánodo, se disuelve en el agua y reacciona con el hidróxido sódico que hemos generado en el otro electrodo, por lo que tenemos:
Cl2 + 2NaOH —> NaClO + NaCl + H2O
El NaClO es el hipoclorito sódico o lejía común. La formación de hipoclorito estabiliza el cloro “activo” en el agua y es un gran desinfectante. A pesar de ésta reacción, el agua queda alcalina debido a que el hipoclorito es una sal de ácido débil y base fuerte, otro concepto químico que se puede introducir. No podemos bañarnos en agua con un pH elevado, pues podría producir irritaciones en la piel; por ello, debemos añadir a la piscina un corrector de pH. En éste caso, el corrector de pH adecuado es el ácido clorhídrico (HCl), que neutraliza el exceso de pH y regenera la sal. Así, teóricamente, una vez añadida la carga inicial de sal, no es necesario añadir más; bastaría con, simplemente, ir neutralizando con ácido clorhídrico para mantener los niveles de sal constantes, gracias a la reacción:
HCl + NaOH —> NaCl + H2O
2HCl + NaClO —> NaCl + Cl2 + H2O
Detección de cloro con o-tolidina
¿como verificamos la formación del cloro y su concentración en el agua de nuestra “piscina”? Pues simplemente con el reactivo usual que se utiliza para medir el cloro en piscinas, y que constituye una prueba colorimétrica del contenido en cloro. Con ello introducimos el concepto químico de la colorimetría, en la que un reactivo produce una reacción coloreada con la sustancia que queremos analizar, y el color resultante es proporcional a la concentración de dicha sustancia. En nuestro caso, utilizaremos un reactivo bien conocido por quien se ocupe de mantener una piscina, llamado O-tolidina (también orto-tolidina. No confundir con la orto-toluidina, que es un compuesto distinto). Basta con añadir un par de gotas de una solución del reactivo en el agua que queremos analizar, para revelar la presencia y estimar la concentración de cloro o hipoclorito. Cuanto más intenso es el color amarillo, mayor será la concentración.
¿que ha ocurrido?. El reactivo o-tolidina, que es incoloro, reacciona con el cloro contenido en el agua para formar un colorante de color naranja o amarillo intenso, dependiendo de la concentración:
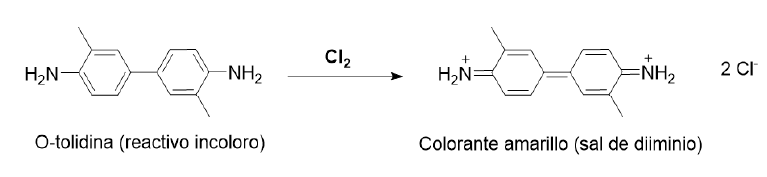
Esto es debido a la oxidación del reactivo por el cloro, que forma una molécula intensamente conjugada y, por tanto, fuertemente coloreada (el concepto químico de la conjugación es algo más complejo, por lo que no se si se introduce a nivel bachillerato). Esta reacción es muy sensible y nos permite detectar tan sólo 0.14 ppm de cloro en agua.
La utilidad de la o-tolidina en la determinación de cloro en agua se descubrió en 1913. Un siglo después, sigue siendo un método sencillo, rápido y útil para estimar la concentración de cloro. Es importante tomar la medida del nivel de cloro, pues un nivel demasiado bajo puede poner en riesgo nuestra salud, así como un nivel demasiado alto puede provocar irritaciones molestas, dermatitis y molestias en ojos y garganta, además de formar una concentración más alta de cloraminas, responsables del olor “a piscina” y que son irritantes.
Calculando cuánto cloro se va a liberar: leyes de Faraday
¿podemos calcular la cantidad de cloro que vamos a generar?. Si, gracias a otro importante concepto químico: las leyes de Faraday. Un gran genio y uno de los héroes científicos de la Historia, el químico inglés Michael Faraday, estudió la electrólisis y, en 1833, enunció sus leyes fundamentales:
- El peso de un elemento liberado en un electrodo es directamente proporcional a la cantidad de electricidad (carga total) que pasa a traves de la celda electrolítica, es decir, es proporcional a la intensidad eléctrica multiplicada por el tiempo. En nuestro ejemplo, hemos hecho pasar una carga de 0.1A x 60 segundos = 6 culombios.
- El peso de un elemento liberado por una cantidad dada de electricidad es proporcional al peso equivalente, o equivalente gramo (peso atómico / carga) del elemento.
- La cantidad necesaria de electricidad para que se libere un peso equivalente de un elemento es de 96494 culombios. Este valor es lo que conocemos como constante de Faraday.
Siguiendo las leyes de Faraday, entonces, si en nuestro experimento hubieran pasado 96494 culombios de electricidad, se habían liberado 35.5 gramos de cloro (o sea, un peso equivalente de cloro). Dado que han pasado 6 culombios, se habrán liberado 2,2 miligramos de cloro. Como teníamos medio litro de agua, esto nos da una concentración esperada de 4.4 ppm. ¡Muy próxima al valor que medimos con la o-tolidina!. ¡Gracias, profesor Faraday!. Si hacemos el experimento cuidadosamente (midiendo tiempo e intensidad, y haciendo la colorimetría con un colorímetro) veríamos que la ley de Faraday se cumple con gran precisión. Este entonces es un magnífico experimento para enseñar, de modo práctico, las leyes de Faraday de la electrólisis.

Como las leyes de Faraday predicen, si aumentamos el tiempo de electrólisis, aumentamos la intensidad eléctrica, o, manteniendo el mismo voltaje de celda, aumentamos la concentración de sal, aumentaremos la concentración final resultante de cloro. Por ello es importante, en las piscinas, mantener la concentración de sal dentro de las especificaciones de la instalación.
Indicador de pH
En los videos anteriores hicimos la reacción en nuestra celda electrolítica midiendo el pH con un pH-metro electrónico. Una modificación vistosa del experimento con fines didácticos y que nos permite introducir el concepto de indicador de pH consiste simplemente en añadir fenolftaleína al agua del vaso. La fenolftaleína es incolora a pH inferior a 8.2, tomando un color rosa a púrpura a pH más alto, hasta volverse de nuevo incolora a pH mayor de 10. La reacción de la fenolftaleína es:
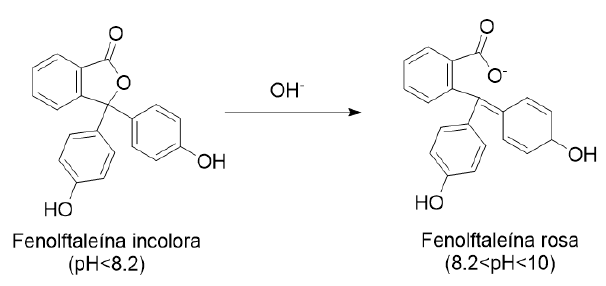
La fenolftaleína nos va a revelar la formación de OH− en el cátodo de un modo sencillo:
Como veis, usando la piscina como marco y aplicación, podemos hacer un experimento muy simple y que nos permite abordar, de modo práctico, una serie muy amplia de conceptos químicos:
- Electrolisis y leyes de Faraday
- Compuestos iónicos: disolución y conductividad
- Química del cloro: síntesis del elemento y reacciones
- Colorimetría
- pH e indicadores de pH. Acidos, bases y neutralización.
- Otros conceptos anejos, como adsorción, corrosión, formación de cal en agua corriente, conjugación y el color de los colorantes…
Y esto, mas o menos, es lo que tiene en la cabeza un químico (bueno, al menos yo) cuando va a bañarse a la piscina. ¿la piscina en la que estáis ahora usa cloración con sal o cloración clásica?




