Cambiando la perspectiva: la glucolisis como ciclo autocatalítico y la entropía de la vida.
C. Menor-Salván. Octubre 2023
«The best that most of us can hope to achieve in Science is simply to misunderstand at a deeper level»
Wolfgang Pauli
En los cursos introductorios y de bioquímica general, se suele explicar el metabolismo central como una complicada serie de reacciones químicas, que los estudiantes, en ocasiones, son casi forzados a memorizar. En esta exposición del metabolismo, la glucólisis se muestra como una ruta lineal, desde la glucosa al piruvato, que conecta con el ciclo de Krebs y con la ruta de las pentosas-fosfato.
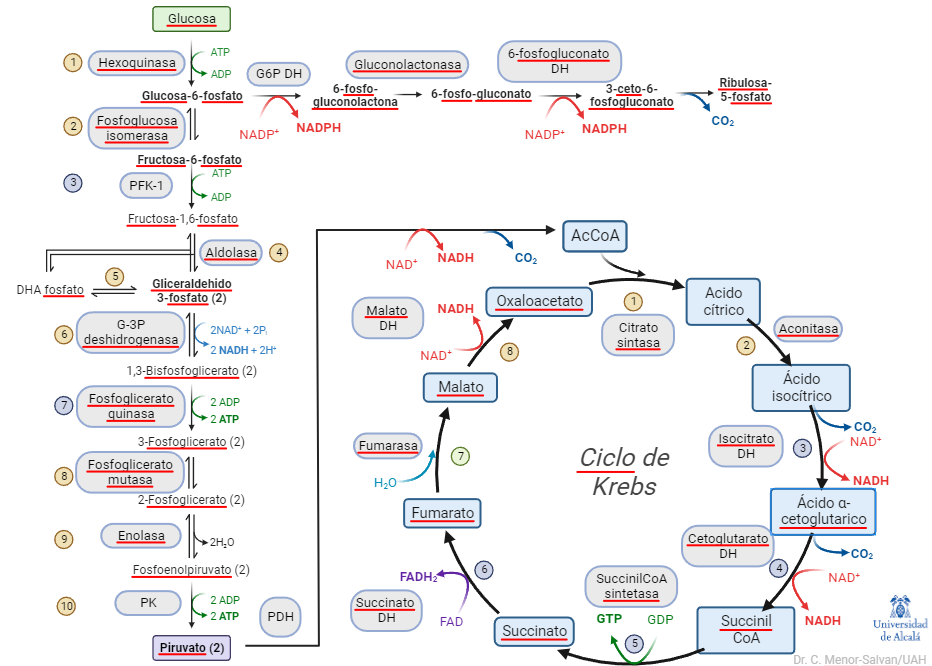
El problema de esta representación es que no da una visión sintética u holística de la glucolisis en el metabolismo. Desglosa sus reacciones y muestra su papel mecánico, pero ignora un aspecto esencial para la organización de un organismo vivo. El desglose de las reacciones, no obstante, ya nos da una pista: la glucolisis es una serie de reacciones reversibles e irreversibles. Y el relato de su auto-regulación nos muestra la importancia del control de sus pasos irreversibles. Si simplificamos la representación y la cambiamos ligeramente de perspectiva, podemos ver el metabolismo central así:
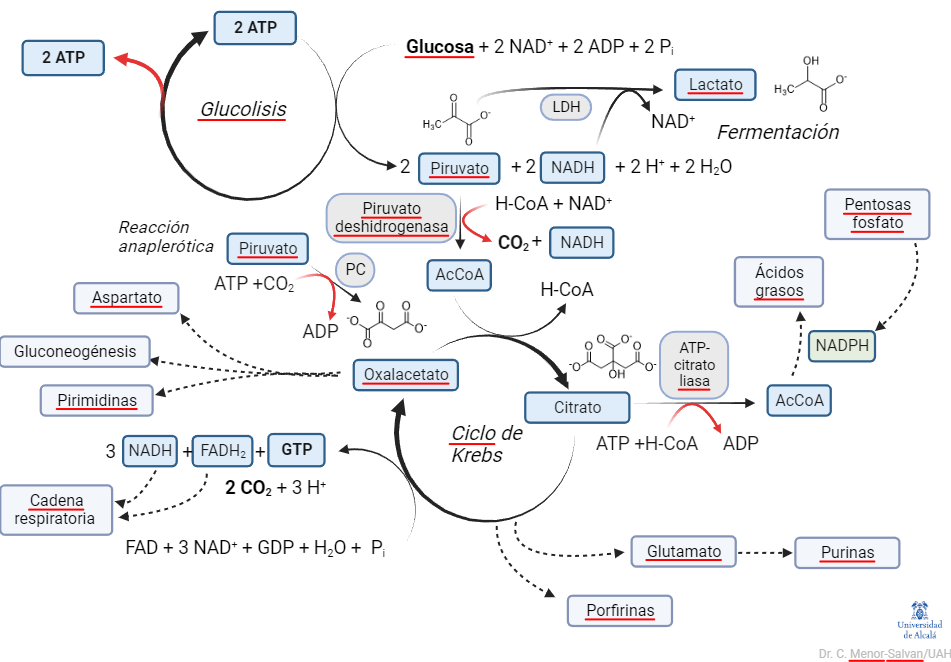
¿Qué vemos en esta representación? Primero, resaltamos el papel del ciclo de Krebs: es la «M40 del metabolismo». Como una carretera de circunvalación en una ciudad muy poblada, distribuye el tráfico de carbono entre diversas rutas. También, impulsa la transformación de la energía del azúcar en hidrógeno, en pasos oxidativos claves. Este hidrógeno (en forma de cofactores NADH y FADH2), a su vez, mantendrá un gradiente, cuya disipación mueve la ATPasa, la dinamo del metabolismo.
Segundo, la glucolisis no aparece como una ruta lineal, sino como un ciclo de reacciones. Además, es un ciclo peculiar, en el que los productos del ciclo son, a su vez, reactivos. Una reacción, o ciclo de reacciones que representa una reacción global, en la que los productos son reactivos de la reacción se denomina reacción autocatalítica o ciclo autocatalítico.
Podemos resumir la glucolisis en una reacción global:
Glucosa + 2 NAD+ + 2 ADP + 2 ATP + 2 Pi –> 2 piruvato + 2 NADH + 4 ATP + 2 H+ + 2 H2O
Los ciclos autocatalíticos tienen unas propiedades peculiares. Estas propiedades surgen como consecuencia de que estos sistemas se alejan del equilibrio. En el ciclo, gradualmente acelerado, se producen dos fenómenos superpuestos: las etapas formadas por reacciones irreversibles y que constituyen puntos de control, y los fenónenos no lineales de transporte de los componentes (difusión de ADP y ATP y disponibilidad de glucosa por ejemplo). La reacción pasa un umbral de inestabilidad tras el cual, surgen comportamientos complejos: oscilaciones periódicas, caos en la formación de los productos, ruptura de la homogeneidad, creación de ondas de diferente composición, cooperación molecular a nivel macroscópico y morfogénesis. La glucolisis y su regulación entonces se convierte en el control crucial de la formación de toda la estructura metabólica.
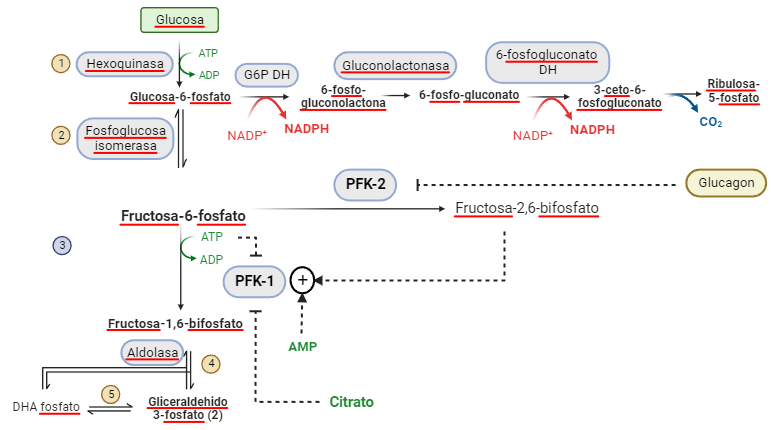
La vida se sostiene sobre este alejamiento del equilibrio, y las células manifiestan varios ciclos autocatalíticos esenciales y sistemas alejados del equilibrio: la autoorganización de membranas impulsada por las propias membranas, o la síntesis de ácidos nucleicos, la señalización celular, los impulsos nerviosos… etc.
Estos comportamientos complejos alejados del equilibrio pueden dar lugar a la creación de estructuras organizadas, pero no siempre tiene que ser así. Cuando un sistema autocatalítico sobrepasa el umbral de inestabilidad, se bifurca en dos posibles estados: uno de los estados puede ser caótico, y el otro estado puede conducir a oscilaciones periódicas y cooperación molecular, y ambas pueden sucederse una a otra en sucesivas bifurcaciones.
Bioanálogos
Hay dos modelos de reacciones autocatalíticas que ilustran ambos comportamientos. El primero es la reacción de la formosa, una reacción autocatalítica de síntesis de azúcares a partir de formaldehído que entra en régimen caótico y conduce a una explosión combinatorial, resultando en una mezcla desorganizada de centenares de componentes. Podemos ilustrarlo con una analogía física: si acoplamos un micrófono y un altavoz, aunque la sala esté en silencio, las pequeñas perturbaciones que generan ruido en el altavoz, son amplificadas autocatalíticamente hasta producir un ruido ensordecedor.
El segundo es una de las reacciones químicas más importantes del siglo XX: la reacción de Belousov-Zhabotinsky. Esta reacción es una ‘maqueta’ del metabolismo sostenida por una reacción autocatalítica. Hablamos de ella algo más en nuestra entrada sobre entropía.
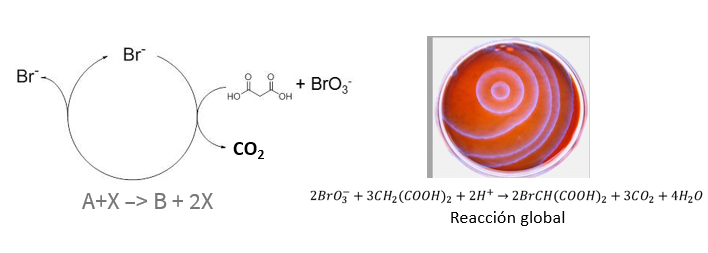
Esta reacción es una buena forma de visualizar qué ocurre cuando un sistema se aleja del equilibrio y se produce una ruptura de simetría. Esto es, cómo, desde una mezcla homogénea original, se produce espontáneamente una compartimentalización con diferentes especies y reacciones. En definitiva, cómo un sistema de reacciones impulsa que surjan estructuras organizadas. Estas estructuras se llaman patrones de Turing.
Al igual que en la reacción de Belousov, la glucolisis genera patrones de Turing en la concentración celular de ATP, que actúa como señal intracelular y controla toda la estructura. Un sistema caótico, como son estas reacciones, dependen en gran medida de las condiciones iniciales. Si se arranca una serie temporal con la glucolisis a dos concentraciones distintas de fructosa-1,6-bifosfato, el patrón de producción de ATP es muy diferente:
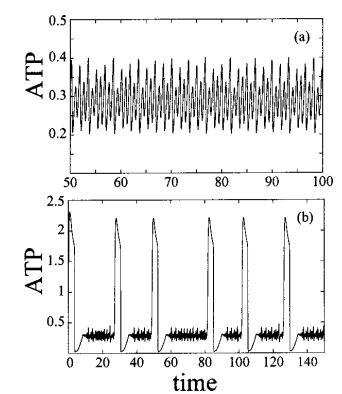
Entropía, glucolisis y cáncer
Durante procesos patolóticos como el cáncer, los patrones de la glucolisis cambian completamente (efecto Warburg). Esto tiene un profundo efecto en el sistema celular. La glucolisis nos permite conectar la idea de autocatálisis y control de la estructura con la entropía. La ruta glucolítica genera entropía y, globalmente, el metabolismo disipa energía y bombea entropía al exterior. La entropía vertida al exterior supera la incorporada al interior (en forma de nutrientes y calor) y la generada por el sistema, resultando en una disminución temporal de la entropía interna. Esto se denomina principio de mínima producción de entropía de Prigogine: el sistema metabolico tiende a minimizar la producción de entropía y maximizar el vertido de entropía al exterior, de modo que el balance favorezca el crecimiento o mantenimiento estacionario de la estructura biológica. Otros científicos piensan mas bien que las células siguen el teorema de máxima producción de entropía. Esto es, la vida evoluciona maximizando el flujo de entropía hacia el exterior. En cualquier caso, la glucolisis es un sistema esencial para la vida, pues es el impulsor, mediante la generación de entropía, del sostenimiento de toda la organización biológica.
En el cáncer se produce un cambio muy profundo en los balances energéticos de las células. La glucolisis cambia durante el desarrollo de tumor. Se ha sugerido que las células tumorales, que, debido a las condiciones ambientales dentro del tumor (menor disponibilidad de oxígeno y competición por la glucosa), favorecen la via de fermentación frente a la respiración, lo que implica una reducción en la producción de entropía. Ello mejora su adaptación a un entorno competitivo mejorando su proliferación y favoreciendo la extensión del tumor. El desarrollo tumoral entonces sería una muestra del funcionamiento del principio de mínima producción de entropía: el tumor evoluciona minimizando su producción de entropía en respuesta a la presión del entorno.
El hidrógeno, el combustible de las células
La vida es una estructura que surge durante el proceso de disipación de energía con un bajo flujo de entropía a un alto flujo de entropía. En el proceso es el hidrógeno el que juega el papel energético fundamental. El gran impulso evolutivo en la vida terrestre lo dió la fotosíntesis oxigénica. Los organismos fotosintéticos escinden el agua en oxígeno e hidrógeno, que es una fuente de energía valiosa. La energía del hidrógeno se maneja en forma de cofactores NADH y NADPH.
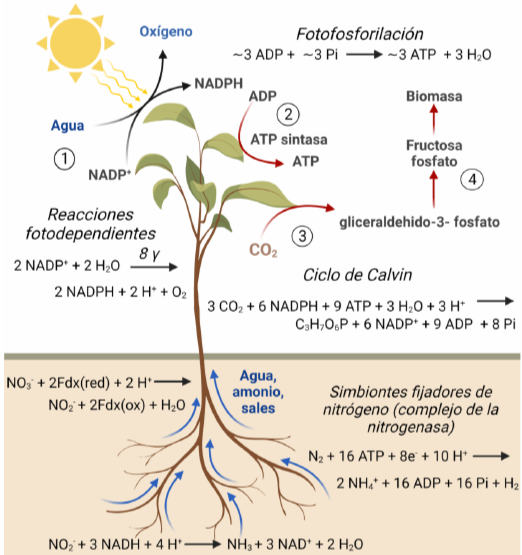
Esta energía se utiliza en la generación de biomasa, que almacena la energía del hidrógeno en forma de productos con baja entropía. La biomasa (particularmente los azúcares) son una buena forma de transportar la energía de unos organismos a otros. Los organismos heterótrofos disiparán la energía, alimentandose de moléculas con baja entropía y generando un flujo de entropía más elevado al exterior. Gracias al metabolismo central, vuelven a recuperar la energía en forma de hidrógeno (NADH y NADPH), que se utiliza para mantener un gradiente electroquímico que se disipa (el hidrógeno se combina con el oxígeno formando agua) y mueve una ‘dinamo’ que produce ATP que, a su vez, controla el mantenimiento de toda la estructura metabólica y molecular. Toda la estructura es temporal y depende del flujo de entropía hacia dentro y fuera del sistema, y de la disipación de la energía. En el momento en el que cambia el balance de entropía, la estructura desaparece: extinción o muerte.
Una vez alguien me preguntaba qué diferencia hay entre un cristal, una estructura de baja entropía, y la vida, una estructura que requiere a su vez baja entropía. La diferencia es que la vida es un proceso. Es una estructura temporal que surge durante la disipación de energía, desde una fuente de baja entropía a un estado de alta entropía.

Como las ondas y formas que surgen durante el proceso de mezclar leche con café, en el que pasamos de un estado de baja entropía (café y leche por separado) a uno de mayor entropía (una mezcla homogénea), así la vida surge temporalmente en el proceso de disipación de un estado de baja entropía (la Tierra primitiva y la energía del Sol) a un estado de alta entropía, en el que esas energías se han ‘esparcido’ en el universo.
Referencias
Bar-Even, A. et al. (2012) ‘Rethinking glycolysis: On the biochemical logic of metabolic pathways’, Nature Chemical Biology. Nature Publishing Group, 8(6), pp. 509–517. doi: 10.1038/nchembio.971.
Baier, G., Müller, M. and Ørsnes, H. (2002) ‘Excitable Spatio-Temporal Chaos in a Model of Glycolysis’, The Journal of Physical Chemistry B, 106(12), pp. 3275–3282. doi: 10.1021/jp0138173.
Kleidon, A. (2009) ‘Nonequilibrium thermodynamics and maximum entropy production in the Earth system’, Naturwissenschaften, 96(6), pp. 653–677. doi: 10.1007/s00114-009-0509-x.
Nielsen, K., SØrensen, P. G. and Hynne, F. (1997) ‘Chaos in glycolysis’, Journal of Theoretical Biology, 186(3), pp. 303–306. doi: 10.1006/jtbi.1996.0366.
Sabater, B. (2022) ‘Entropy Perspectives of Molecular and Evolutionary Biology’, International Journal of Molecular Sciences, 23(8), p. 4098. doi: 10.3390/ijms23084098.


